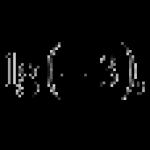Základymolekulová fyzika a termodynamika
Štatistické a termodynamické metódy výskumu. Molekulárna fyzika a termodynamika sú odvetvia fyziky, v ktorých študujú makroskopické
procesy v telách, spojené s obrovským počtom atómov a molekúl obsiahnutých v telách. Na štúdium týchto procesov sa používajú dve kvalitatívne odlišné a vzájomne sa dopĺňajúce metódy: štatistické (molekulárne kinetické) a termodynamické. Prvá je základom molekulárnej fyziky, druhá - termodynamika.
Molekulárna fyzika - odbor fyziky, ktorý študuje štruktúru a vlastnosti hmoty na základe molekulárnych kinetických konceptov, založený na skutočnosti, že všetky telesá pozostávajú z molekúl v nepretržitom chaotickom pohybe.
Myšlienku atómovej štruktúry hmoty vyjadril staroveký grécky filozof Democritus (460-370 pred Kristom). Atomizmus bol znovu oživený až v 17. storočí. a je rozvinutý v prácach M.V.Lomonosova, ktorého názory na štruktúru hmoty a tepelné javy boli blízke moderným. Dôsledný rozvoj molekulárnej teórie sa datuje do polovice 19. storočia. a spája sa s prácami nemeckého fyzika R. Clausiusa (1822-1888), anglického fyzika J. Maxwella (1831 - 1879) a rakúskeho fyzika L. Boltzmanna (1844-1906).
Procesy, ktoré študuje molekulárna fyzika, sú výsledkom kombinovaného pôsobenia obrovského množstva molekúl. Študujú sa zákony správania veľkého počtu molekúl, ktoré sú štatistickými zákonmi štatistická metóda. Táto metóda je založená na
že vlastnosti makroskopického systému sú v konečnom dôsledku určené vlastnosťami častíc systému, vlastnosťami ich pohybu a spriemerované hodnoty dynamických charakteristík týchto častíc (rýchlosť, energia atď.). Napríklad teplota telesa je určená rýchlosťou náhodného pohybu jeho molekúl, ale keďže v každom okamihu majú rôzne molekuly rôznu rýchlosť, možno ju vyjadriť iba priemernou hodnotou rýchlosti pohybu telesa. molekuly. Nedá sa hovoriť o teplote jednej molekuly. Makroskopické charakteristiky telies majú teda fyzikálny význam len v prípade veľkého počtu molekúl.
Termodynamika- odbor fyziky, ktorý študuje všeobecné vlastnosti makroskopických systémov v stave termodynamickej rovnováhy a procesy prechodu medzi týmito stavmi. Termodynamika nezohľadňuje mikroprocesy, ktoré sú základom týchto transformácií. Toto termodynamická metóda odlišné od štatistických. Termodynamika je založená na dvoch princípoch - základných zákonoch stanovených ako výsledok zovšeobecnenia experimentálnych údajov.
Rozsah použitia termodynamiky je oveľa širší ako rozsah molekulárnej kinetickej teórie, pretože neexistujú oblasti fyziky a chémie, v ktorých by sa termodynamická metóda nedala použiť. Na druhej strane je však termodynamická metóda do istej miery obmedzená: termodynamika nehovorí nič o mikroskopickej štruktúre hmoty, mechanizme javov, ale iba stanovuje súvislosti medzi makroskopickými
vlastnosti látky. Molekulárna kinetická teória a termodynamika sa navzájom dopĺňajú, tvoria jeden celok, ale líšia sa rôznymi metódami výskumu.
Termodynamika sa zaoberá termodynamický systém- súbor makroskopických telies, ktoré interagujú a vymieňajú si energiu medzi sebou aj s inými telesami (vonkajšie prostredie). Základom termodynamickej metódy je určenie stavu termodynamického systému. Stav systému je nastavený termodynamické parametre (stavové parametre) - súbor fyzikálnych veličín, ktoré charakterizujú vlastnosti termodynamického systému. Typicky sa ako stavové parametre vyberajú teplota, tlak a špecifický objem.
Teplota je jedným zo základných pojmov, ktorý zohráva dôležitú úlohu nielen v termodynamike, ale aj vo fyzike všeobecne. Teplota- fyzikálna veličina charakterizujúca stav termodynamickej rovnováhy makroskopického systému. V súlade s rozhodnutím XI. Generálnej konferencie pre váhy a miery (1960) sa v súčasnosti môžu používať iba dve teplotné stupnice. - termodynamické a medzinárodné praktické, odstupňované v Kelvinoch (K) a stupňoch Celzia (°C).
V medzinárodnej praktickej škále teploty mrazu a varu vody pri tlaku 1,013 10 5 Pa, respektíve 0 a 100 °C (tzv. referenčné body).
Termodynamická teplotná stupnica sa určuje jedným referenčným bodom, ktorý sa berie ako trojitý bod vody(teplota, pri ktorej sú ľad, voda a nasýtená para pri tlaku 609 Pa v termodynamickej rovnováhe). Teplota tohto bodu na termodynamickej stupnici je 273,16 K (presne). Stupeň Celzia sa rovná Kelvinom. Na termodynamickej stupnici je bod tuhnutia vody 273,15 K (pri rovnakom tlaku ako na Medzinárodnej praktickej stupnici), preto podľa definície termodynamická teplota a teplota na Medzinárodnej praktickej stupnici súvisia pomerom T = 273,15 + t . Teplota T=0 sa nazýva nula kelvinov. Analýza rôznych procesov ukazuje, že 0 K je nedosiahnuteľné, hoci priblížiť sa k nej čo najbližšie je možné.
Špecifický objemv je objem na jednotku hmotnosti. Keď je teleso homogénne, t.j. jeho hustota =konšt v=V/m= 1/. Keďže pri konštantnej hmotnosti je špecifický objem úmerný celkovému objemu, makroskopické vlastnosti homogénneho telesa možno charakterizovať objemom telesa.
Nastavenia stavu systému sa môžu zmeniť. Každá zmena v termodynamickom systéme spojená so zmenou aspoň jedného z jeho termodynamických parametrov sa nazýva termodynamický proces. Makroskopický systém je in termodynamická rovnováha, ak sa jeho stav v čase nemení (predpokladá sa, že sa nemenia vonkajšie podmienky posudzovaného systému).
Kapitola 8
Molekulárna kinetická teória ideálnych plynov
§ 41. Experimentálne zákony ideálneho plynu
V molekulárnej kinetickej teórii používajú idealizovaný modelideálny plyn, podľa ktorého:
1) vnútorný objem molekúl plynu je zanedbateľný v porovnaní s objemom nádoby;
2) medzi molekulami plynu nie sú žiadne interakčné sily;
3) zrážky molekúl plynu medzi sebou a so stenami nádoby sú absolútne elastické.
Model ideálneho plynu sa môže použiť pri štúdiu skutočných plynov, pretože za podmienok blízkych normálu
malé (napríklad kyslík a hélium), ako aj pri nízkych tlakoch a vysokých teplotách, sú svojimi vlastnosťami blízke ideálnemu plynu. Navyše, vykonaním korekcií, ktoré zohľadňujú vnútorný objem molekúl plynu a pôsobiace molekulárne sily, možno prejsť k teórii skutočných plynov.
Experimentálne, ešte pred príchodom molekulárnej kinetickej teórie, bola stanovená celá séria zákonov, ktoré popisujú správanie ideálnych plynov, ktoré budeme uvažovať.
zákonBoyle - Mariotta : pre danú hmotnosť plynu pri konštantnej teplote je súčin tlaku plynu a jeho objemu konštantná hodnota:
pV = konšt(41,1) at T= const, m=konšt.
Krivka znázorňujúca vzťah medzi veličinami R A V, charakterizujúce vlastnosti látky pri konštantnej teplote sa nazýva izoterma. Izotermy sú hyperboly umiestnené na grafe, čím vyššia je teplota, pri ktorej proces prebieha (obr. 60).
zákonGay Lussac : 1) objem daného množstva plynu pri konštantnom tlaku sa mení lineárne s teplotou:
V=V 0 ( 1+ t)(41,2) at p= konštanta, m= konštanta;

2) tlak daného množstva plynu pri konštantnom objeme sa mení lineárne s teplotou:
p = p 0 ( 1+ t)(41,3) at V=konšt., m=konšt.
V týchto rovniciach t- teplota na stupnici Celzia, R 0 A V 0 - tlak a objem pri 0°C, koeficient =1/273,15 K -1.
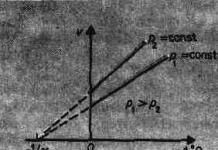
proces, tečúci pri konštantnom tlaku sa nazýva izobarický. Na diagrame v súradniciach V,t(obr. 61) je tento proces znázornený priamkou tzv izobara. proces, tečúci pri konštantnom objeme sa nazýva izochorický. Na diagrame v súradniciach R,t(obr. 62) je znázornená priamkou tzv izochóra.
Z (41.2) a (41.3) vyplýva, že izobary a izochóry pretínajú teplotnú os v bode t=-1/=-273,15 °C, stanovené z podmienky 1+t=0. Ak posuniete počiatok do tohto bodu, potom nastane prechod na Kelvinovu stupnicu (obr. 62), odkiaľ
T = t+ 1/ .

Zavedením termodynamickej teploty do vzorcov (41.2) a (41.3) môžu byť Gay-Lussacove zákony pohodlnejšie:
V=V 0 (1+ t) = V 0 = v 0 t,
p=p 0 (1+ t) = p 0 =p 0 T, alebo
V 1 /V 2 = T 1 /T 2 (41.4)
pričom p = const, m = const,
R 1 /R 2 = T 1 /T 2 (41,5) at V=konšt., m=konšt.,
kde indexy 1 a 2 sa vzťahujú na ľubovoľné stavy ležiace na rovnakej izobare alebo izochore.
zákonAvogadro : móly akýchkoľvek plynov pri rovnakej teplote a tlaku zaberajú rovnaké objemy. Za normálnych podmienok je tento objem 22,41 10 -3 m 3 /mol.
Podľa definície jeden mol rôznych látok obsahuje rovnaký počet molekúl, tzv Avogadrova konštanta:
n a = 6,022 1023 mol -1.
zákonDalton : tlak zmesi ideálnych plynov sa rovná súčtu parciálnych tlakov plynov do nej vstupujúcich, t.j.
p=p 1 +p 2 +... +str n ,
Kde p 1 ,p 2 , ..., p n- parciálne tlaky- tlak, ktorý by vyvíjali plyny zmesi, keby samotné zaberali objem rovný objemu zmesi pri rovnakej teplote.
Molekuly v ideálnom plyne sa pohybujú chaoticky. Pohyb jednej molekuly charakterizujú mikroskopické parametre (hmotnosť molekuly, jej rýchlosť, hybnosť, kinetická energia). Vlastnosti plynu ako celku sú opísané pomocou makroskopických parametrov (hmotnosť plynu, tlak, objem, teplota). Molekulárna kinetická teória stanovuje vzťah medzi mikroskopickými a makroskopickými parametrami.
Počet molekúl v ideálnom plyne je taký veľký, že vzorce ich správania sa dajú určiť len pomocou štatistickej metódy. Rovnomerné rozloženie molekúl ideálneho plynu v priestore je najpravdepodobnejším stavom plynu, teda najbežnejším.
Rozloženie molekúl ideálneho plynu podľa rýchlosti pri určitej teplote je štatistický vzor.
Najpravdepodobnejšia rýchlosť molekúl je rýchlosť, ktorú má maximálny počet molekúl. Stacionárny rovnovážny stav plynu je stav, v ktorom počet molekúl v danom rozsahu rýchlosti zostáva konštantný.
Telesná teplota je mierou priemernej kinetickej energie translačného pohybu jeho molekúl:
kde stĺpec hore je znakom priemerovania rýchlostí, k = 1,38 10 -23 J/K je Boltzmannova konštanta.
Termodynamická jednotka teploty- kelvin (K).
Pri absolútnej nulovej teplote je priemerná kinetická energia molekúl nulová.
Stredná kvadratická (tepelná) rýchlosť molekúl plynu

kde M je molárna hmotnosť, R = 8,31 J/(K mol) je molárna plynová konštanta.
Tlak plynu- dôsledok nárazov pohybujúcich sa molekúl:

kde n je koncentrácia molekúl (počet molekúl na jednotku objemu), E k je priemerná kinetická energia molekuly.
Tlak plynu je úmerný jeho teplote:

Loschmidtova konštanta- ideálna koncentrácia plynu za normálnych podmienok (atmosférický tlak p = 1,01 10 5 Pa a teplota T = 273 K):
Clapeyron-Mendelejevova rovnica- stavová rovnica ideálneho plynu, spájajúca tri makroskopické parametre (tlak, objem, teplota) danej hmotnosti plynu.

Izoprocess- proces, pri ktorom jeden z makroskopických parametrov stavu danej hmotnosti plynu zostáva konštantný. Izotermický proces je proces zmeny skupenstva určitého množstva plynu pri konštantnej teplote.
Zákon Boyle-Mariotte: pre plyn danej hmotnosti pri konštantnej teplote:

kde p 1, p 2, V 1, V 2 - tlak a objem plynu v počiatočnom a koncovom stave
izoterma- graf zmien makroskopických parametrov plynu počas izotermického procesu. Izobarický proces je proces zmeny skupenstva určitého množstva plynu pri konštantnom tlaku.
Gay-Lussacov zákon: pre plyn danej hmotnosti pri konštantnom tlaku
Veľkosť: px
Začnite zobrazovať zo stránky:
Prepis
1 48 Prednáška 8. Stavová rovnica ideálneho plynu a základná rovnica MKT kapitola 8, 4-4 Plán prednášky. Základné ustanovenia a základné pojmy MKT.. Stavová rovnica ideálneho plynu. Zákony experimentálnych plynov.. Základná rovnica MKT pre ideálne plyny.. Základné ustanovenia a základné pojmy MKT. Existujú dve hlavné metódy na opis fyzikálnych javov a vytváranie zodpovedajúcich teórií:) molekulárno-kinetické (štatistické);) termodynamické. Molekulárna kinetická metóda považuje vlastnosti fyzikálnych objektov za celkový výsledok pôsobenia všetkých molekúl. Správanie jednotlivej molekuly sa analyzuje na základe zákonov klasickej mechaniky a získané výsledky sa rozšíria na populáciu veľkého počtu molekúl pomocou štatistickej metódy využívajúcej zákony teórie pravdepodobnosti. Je to možné, pretože pohyb každej molekuly, hoci sa riadi zákonmi klasickej mechaniky, je náhodný, pretože molekulárne rýchlosti sa riadia zákonmi teórie pravdepodobnosti. Čím viac častíc je v systéme, tým lepšia je zhoda medzi závermi štatistickej teórie a experimentálnymi výsledkami. Výhodou metódy je jasný obraz mechanizmu posudzovaného javu. Nevýhoda - závery teórie MC sú výsledkom spriemerovania, preto sú približné. Termodynamická metóda je založená na zavedení pojmu energie a uvažuje o všetkých procesoch z energetického hľadiska, na základe zákonov zachovania a premeny energie z jedného druhu na druhý. Molekulárna fyzika je oblasť fyziky, ktorá študuje štruktúru a vlastnosti hmoty na základe molekulárnej kinetickej teórie. Myšlienku atómovej štruktúry hmoty vyjadril staroveký grécky filozof Democritus (4 pred Kristom). Ako vedecká hypotéza je teória atomizmu oživená v 12. storočí a rozvinutá v prácach Lomonosova (8. storočie), ktorý vysvetlil tepelné javy ako výsledok pohybu najmenších častíc hmoty. Hlavné ustanovenia MCT sú založené na množstve experimentálnych údajov a pozorovaní (difúzia, Brownov pohyb).. Všetky látky pozostávajú z atómov alebo molekúl.. Atómy všetkých látok sú v neustálom chaotickom pohybe.. Atómy (alebo molekuly) všetkých látky na seba vzájomne pôsobia. Difúzia je fenomén prenikania molekúl jednej látky medzi molekuly druhej, keď sa dostanú do kontaktu. Brownov pohyb je chaotický pohyb častíc suspendovaných v kvapaline alebo plyne.
2 49 Molekula je najmenšia častica látky, ktorá má všetky jej chemické vlastnosti. 6 kg, d m Molekulová hmotnosť - hmotnosť jednej molekuly, meraná v amu. Predstavme si pojem mól látky. hmotnosť látky m-ly (amu) hmotnosť látky (g) počet molekúl H 6, C 6, O 6, CO, mol - je to množstvo látky, ktoré obsahuje toľko molekúl, koľko je v g 6 C (SI Základna jednotka). Avogadrove číslo A je počet molekúl obsiahnutých v jednom móle akejkoľvek látky. Molárna hmotnosť je hmotnosť jedného mólu. kg n, A 6, mol mol, počet mólov látky, počet molekúl látky.. Stavová rovnica ideálneho plynu. Experimentálne zákony o plynoch. MCT používa idealizovaný model ideálneho plynu. Ideálny plyn je plyn, ktorého molekuly možno považovať za hmotné body a ich vzájomné pôsobenie má charakter absolútne elastického nárazu. (pri nízkom p a vysokom T sa reálne plyny približujú ideálnym plynom). Stav určitej hmotnosti plynu určujú tri termodynamické parametre: p,. Tlak plynu je výsledkom dopadu molekúl plynu na steny nádoby, v ktorej sa plyn nachádza. [p] = pa, = m V súlade s rozhodnutím XI Generálnej konferencie pre váhy a miery (96) sa používajú dve teplotné stupnice – termodynamická (Kelvin) a Medzinárodná praktická (Celsius). Teplota tuhnutia vody pri p = atm sa berie ako C. K je teplota, pri ktorej by sa mal chaotický pohyb molekúl zastaviť. Analýza rôznych procesov ukazuje, že K je nedosiahnuteľné, hoci sa k nemu priblížiť tak blízko, ako je to možné. Stupeň Kelvina sa rovná stupňu Celzia. Т= tс+ 7, t. Medzi parametrami plynu existuje určitý vzťah, ktorý sa nazýva stavová rovnica. Rovnica týkajúca sa parametrov stavu ideálneho plynu sa nazýva stavová rovnica ideálneho plynu alebo Clapeyronova rovnica: konšt. ()
3 5 Pre danú hmotnosť ideálneho plynu je pomer súčinu tlaku a objemu k absolútnej teplote konštantnou hodnotou. Určme hodnotu konštanty pre určité množstvo ideálneho plynu, a to pre jeden mól. Podľa Avogadrovho zákona má mol akéhokoľvek plynu za normálnych podmienok (T = 7 K, p = 5 Pa) M =.4 - m. Pre jeden mol 5. Pa.4 m / mol J 8, ; 7K mol K J R 8, je molárna plynová konštanta. mol K Pre ľubovoľnú hmotnosť plynu R, R, R je Mendelejevova-Clapeyronova rovnica stavovou rovnicou ideálneho plynu ľubovoľnej hmotnosti. Rovnica () spája tri špeciálne prípady, tri empirické zákony pre izoprocesy, t.j. procesy, pri ktorých jeden z parametrov zostáva konštantný.. T = konštantný izotermický proces, alebo konštanta - Boyle-Mariotteho zákon: pre danú hmotnosť ideálneho plynu pri T = konštantná je súčin tlaku a objemu konštantná hodnota. Grafy závislosti medzi parametrami stavu plynu pri T=konst sú uvedené na obr... p= const izobarický proces, alebo const - Gay-Lussacov zákon: pre danú hmotnosť ideálneho plynu pri p=konšt. objem je priamo úmerný absolútnej teplote. Ryža. Grafy závislosti medzi parametrami stavu plynu pri p=konst sú uvedené na obr... =const je izochorický dej, alebo const - Charlesov zákon: pre danú hmotnosť ideálneho plynu pri =konst uveďte obr. Ryža.
4 5 teplota je priamo úmerná absolútnej teplote. Grafy závislosti medzi parametrami stavu plynu pri =konšt. sú znázornené na obrázku Zrážky molekúl plynu so stenami. Priemerná sila vznikajúca pri kombinovanom pôsobení všetkých molekúl plynu určuje tlak plynu. Predstavme si nádobu v tvare pravouhlého rovnobežnostena obsahujúceho ideálny plyn (obr. 4). Vypočítajme tlak plynu na jednej zo stien priestoru nádoby. Uvažujme náraz jednej molekuly, ktorá sa pred nárazom pohybovala kolmo na stenu. Podľa zákona zachovania hybnosti Y Z C, C, c t Obr. 4,. Základná MKT rovnica pre ideálne plyny. Základná rovnica MKT spája parametre stavu plynu s charakteristikami pohybu jeho molekúl. Tlak plynu na steny nádoby je dôsledkom nekonečnej zmeny C C C C hybnosti steny v dôsledku dopadu jednej molekuly. Počas času t sa na miesto dostanú len tie molekuly, ktoré sú obsiahnuté v objeme rovnobežnostena so základňou a výškou t. Je potrebné vziať do úvahy, že v skutočnosti sa molekuly pohybujú smerom k miestu pod rôznymi uhlami. Pre zjednodušenie výpočtov je chaotický pohyb molekúl nahradený pohybom v troch vzájomne kolmých smeroch, takže / molekuly sa pohybujú pozdĺž každého z nich, pričom polovica molekúl (/6) sa pohybuje v danom smere v jednom smere, polovica v smere opačný smer. n n t, 6 6 n koncentrácia molekúl, ich počet na jednotku objemu. Počas času t bude zmena hybnosti steny C n t n t 6 Pretože F, t F n je sila, ktorou molekuly pôsobia na stenu, a tlak spôsobený touto silou, t.j. tlak plynu sa rovná X s F n. ()
5 5 Ak objem obsahuje molekuly pohybujúce sa rýchlosťou..., potom je vhodné zvážiť priemernú adratickú rýchlosť charakterizujúcu celú množinu molekúl plynu: Rovnica () a zohľadnenie () bude mať tvar: kde molekuly.. ... () n - základná rovnica MKT. n n - priemerná kinetická energia translačného pohybu jedného Od n,. Vyjadrime to parametrami plynu. Za týmto účelom porovnajte Mendelejevovu-Clapeyronovu rovnicu a MKT rovnicu. kde k R R, n, n R, pretože, n, R R k, n J J,8 K K k. 8, - Boltzmannova konštanta; 6. Absolútna teplota je teda mierou priemernej kinetickej energie molekúl. Zoberme si iný výraz pre tlak: n n k nk.
Zákony ideálneho plynu Molekulárna kinetická teória Statická fyzika a termodynamika Statická fyzika a termodynamika Makroskopické telesá sú telesá pozostávajúce z veľkého počtu molekúl Metódy
11. prednáška Kinetická teória ideálnych plynov. Tlak a teplota. Experimentálne zákony ideálneho plynu. Molekulárna kinetická teória je oblasť fyziky, ktorá študuje vlastnosti hmoty na základe myšlienok
Lekcia 9 (.11.017) Základy MCT. Mendelejevova-Clapeyronova rovnica. Odvodenie základnej MKT rovnice. 1. Experimentálne údaje o štruktúre hmoty. Brownov pohyb anglický botanik R. Brown, 187 Myšlienka:
TECHNICKÁ TERMODYNAMIKA Osnova prednášky: 1. Technická termodynamika (základy a definície) 2. Parametre vnútorného stavu (tlak, teplota, hustota). Pojem termodynamika
FYZIKÁLNO-TECHNICKÝ ÚSTAV Katedra „všeobecnej a teoretickej fyziky“ Potemkina S.N. METODICKÉ POKYNY PRE LABORATÓRNE PRÁCE 7 KONTROLA BOYLE-MARIOTTOVA ZÁKONA Tolyatti 7 Obsah. Účel práce...3. Zariadenia
Prednáška 3 Základná rovnica molekulárnej kinetickej teórie plynov 1. Boltzmannova konštanta. 2. Mendelejevova Clapeyronova rovnica. 3. Univerzálna plynová konštanta. 4. Zákony o plyne. 5. Meranie teploty
SCHÉMA MAPY PRE SPRACOVANIE TÉMY ZÁKLADY MOLEKULÁRNEJ FYZY Všeobecné charakteristiky ideálneho plynu: molekulárne kinetické a termodynamické prístupy. Definícia ideálneho plynu. Stavové parametre. Základné
Základy molekulárnej kinetickej teórie plynov Prednáška 6.1. Termodynamika a štatistická fyzika Dve úzko súvisiace oblasti fyziky, ktoré študujú najvšeobecnejšie vlastnosti makroskopických fyzikálnych systémov
TEPELNÁ FYZIKA Plán prednášky: 1. Termodynamika (základy a definície) 2. Parametre vnútorného stavu (tlak, teplota, hustota). Stavová rovnica ideálneho plynu 4. Pojem termodynamiky
„MOLEKULÁRNA KINETICKÁ TEÓRIA“. Hlavné ustanovenia MKT (molekulárna kinetická teória): Všetky telesá pozostávajú z molekúl; Molekuly sa pohybujú (náhodný, chaoticky Brownov pohyb); Molekuly interagujú
98. Molekulárna fyzika a termodynamika.1. Programové otázky Základné princípy molekulárnej kinetickej teórie a ich experimentálne zdôvodnenie. Brownov pohyb. Hmotnosť a veľkosť molekúl. Mol látky. Neustále
TERMODYNAMIKA Prednáška Plán prednášok:. Základné ustanovenia a definície termodynamiky (termodynamický systém, termodynamický proces, stavové parametre) 2. Vnútorné stavové parametre (tlak,
3. prednáška Základná rovnica molekulárnej kinetickej teórie plynov. Boltzmannova konštanta. Teplota a tlak ako štatistické veličiny. Jednou z vlastností fyziky je používanie abstrakcií
4. prednáška Základné princípy molekulárnej kinetickej teórie štruktúry hmoty. Termodynamické systémy. Entropia. Všetky látky sa skladajú z atómov a molekúl. Atóm je najmenšia štruktúrna jednotka chemickej látky
4. prednáška (8.4.5) Práca s plynom v rôznych procesoch. V predchádzajúcich prednáškach sme sa naučili, že všeobecný vzorec pre prácu vykonávanú plynom je A d. () Geometrický význam tohto vzorca je
Prednáška 6 Molekulárna fyzika (I. časť) I Krátke historické informácie Ľudia si dlho kládli otázku: Z čoho sú vyrobené predmety? Boli predložené rôzne hypotézy - od naivných po brilantné,
Záverečný test, Mechanická veda (tepelné inžinierstvo) 1. Ideálny plyn odovzdal množstvo tepla 300 J a zároveň sa vnútorná energia plynu znížila o 100 J. Práca, ktorú plyn vykonal je 1) 400 J 2) 200
A. A. Kindaev, T. V. Lyapina, N. V. Paskevich PRÍPRAVA NA SKÚŠKU Z FYZIKY MOLEKULÁRNA FYZIKA A TERMODYNAMIKA Penza 2010 ÚVOD Molekulárna fyzika a termodynamika 1 sekcia fyziky venovaná štúdiu
Prednáška 1 Úvod. Predmet molekulovej fyziky. Základné ustanovenia molekulárnej kinetickej teórie (MKT) hmoty a ich experimentálne zdôvodnenie. Štatistické a termodynamické prístupy k štúdiu
Základy termodynamiky a molekulovej fyziky Termodynamické a statické metódy výskumu. Stavová rovnica. Ideálny plyn. Rovnica molekulárnej kinetickej teórie pre tlak plynu. 4 Vnútorné
Molekulárna fyzika Molekulárna kinetická teória Molekulárna kinetická teória vysvetľuje štruktúru a vlastnosti telies pohybom a interakciou atómov molekúl a iónov, ktoré tvoria telesá. Na základni
JEDNOTKA 4 „MOLEKULÁRNA KINETICKÁ TEÓRIA“. Hlavné ustanovenia MKT (molekulárna kinetická teória): Všetky telesá pozostávajú z molekúl; Molekuly sa pohybujú (náhodný, chaoticky Brownov pohyb); Molekuly
9.11 Väzbová energia sústavy Nech sa teleso s pokojovou hmotnosťou M 0 skladá z N častí s pokojovými hmotnosťami m 0i (i=1,n). Pokojová energia takéhoto telesa sa skladá z pokojových energií častí, kinetických energií častí vzhľadom na
1 MOLEKULÁRNA FYZIKA A TERMODYNAMIKA Základné princípy a definície Dva prístupy k štúdiu hmoty Hmota pozostáva z obrovského množstva mikročastíc - atómov a molekúl Takéto systémy sa nazývajú makrosystémy
4. prednáška Kinetická teória ideálnych plynov. Tlak a teplota. Experimentálne zákony ideálneho plynu. Základná rovnica molekulárnej kinetickej teórie plynov. Adiabatický proces. Termodynamika Termodynamika
Safronov V.P. 1 ZÁKLADY MOLEKULÁRNEJ KINETICKEJ TEÓRIE - 1 - ČASŤ MOLEKULÁRNA FYZIKA A ZÁKLADY TERMODYNAMIKY Kapitola 8 ZÁKLADY MOLEKULÁRNEJ KINETICKEJ TEÓRIE 8.1. Základné pojmy a definície Skúsený
Prednáška 10 Izoprocesy. Vnútorná energia. Prvý zákon termodynamiky. Práca a teplo v izoprocesoch. Nurusheva Marina Borisovna odborný asistent, Katedra fyziky 03 NRNU MEPhI Mendelejevova rovnica
MOLEKULÁRNA FYZIKA PREDNÁŠKA 1 Základné pojmy molekulovej fyziky Molekulárna kinetická teória ideálneho plynu Základné pojmy molekulovej fyziky. Štatistické a termodynamické metódy výskumu
PREDNÁŠKA 4 Stavová rovnica ideálneho plynu. Univerzálna plynová konštanta. Základné zákony o plyne. Rovnice získané na základe MCT umožňujú nájsť vzťahy, ktoré spolu súvisia
Genkin B.I. Prvky obsahu testované na jednotnej štátnej skúške z fyziky. Sprievodca na preskúmanie vzdelávacieho materiálu. Petrohrad: htt://auditori-um.ru, 2012 2.1 MOLEKULÁRNA FYZIKA Molekulárna fyzika je veda o
Základy teórie molekulovej kinetiky Molekulárna fyzika je oblasť fyziky, ktorá študuje štruktúru a vlastnosti hmoty v rôznych stavoch agregácie na základe koncepcií molekulovej kinetiky.
Teoretické informácie k prednáške 3 Základy molekulárnej kinetickej teórie (MKT) Plyny majú formu nádoby a úplne vypĺňajú objem ohraničený stenami nepriepustnými pre plyny.
Fyzikálně-technologická fakulta Teória: Molekulárna fyzika. Termodynamika Shimko Elena Anatolyevna kandidátka pedagogických vied, docentka Katedry všeobecnej a experimentálnej fyziky Altajskej štátnej univerzity, predsedníčka regionálnej predmetovej komisie dňa
Ministerstvo školstva a vedy Ruskej federácie IRKUTSKÁ ŠTÁTNA UNIVERZITA STANOVENIE PARAMETROV VZDUCHU PRI POVRCHU ZEME Smernice Irkutsk 24 Zverejnené rozhodnutím
TECHNICKÁ TERMODYNAMIKA Plán prednášky:. Úvod. Základné princípy termodynamiky (termodynamický systém, termodynamický proces). Stavové parametre (tlak, teplota, hustota) 4. Rovnica
5 Prednáška 9 Maxwellovo a Boltzmannovo rozdelenie Transportné javy kapitola 8 4-48 Plán prednášky Maxwellov zákon o distribúcii rýchlostí molekúl Charakteristické rýchlosti molekúl Boltzmannovo rozdelenie Priemer
63 Prednáška Základy termodynamiky kapitola 9 5-54 Plán prednášky Základné pojmy termodynamiky Počet stupňov voľnosti molekuly Zákon rovnomerného rozloženia energie medzi stupňami voľnosti 3 Vnútorná energia
Osnova prednášky: TECHNICKÁ TERMODYNAMIKA Prednáška 2. Stavová rovnica ideálneho plynu 2. Stavová rovnica reálnych plynov a kvapalín 3. Zmesi plynov. ROVNICE STAVU IDEÁLNEHO PLYNU Ako je známe,
Ministerstvo školstva Ruskej federácie Uralská štátna technická univerzita - UPI MOLEKULÁRNE KINETICKÁ TEÓRIA IDEÁLNEHO PLYNU MAXWELL-BOLZMANNOVA ŠTATISTIKA pre študentov všetkých foriem
Záverečný test, Mechanické vedy (Tepelné inžinierstvo) (3181) 3. (61c.) Hodnota zodpovedajúca rádu hmotnosti molekuly prvku alebo zlúčeniny 1) 10 27 kg. 2) 10-27 kg. 3) 10 27 g 4) 10 10 kg. 4. (61 c.)
Všeobecná fyzika 9. prednáška Molekulárna fyzika Trushin Oleg Stanislavovič Vedúci. laboratórium. JAF FTIAN RAS, Assoc. oddelenie nanotechnológia v elektronike YarSU Plán prednášok Štatistická fyzika a termodynamika Hmotnosť a rozmery
KAPITOLA 1. ZÁKLADY MOLEKULÁRNEJ KINETICKEJ TEÓRIE PLYNOV Na charakterizáciu hmotností atómov a molekúl sa používa relatívna atómová hmotnosť prvku a relatívna molekulová hmotnosť látky. Relatívna
Možnosť 1. 1. Je možné použiť štatistické metódy pri štúdiu správania mikroskopických telies? prečo? 2. Môže byť jedna molekula v stave termodynamickej rovnováhy? 3. Ak
1. prednáška Predmet molekulovej fyziky 1. Termodynamické a štatistické prístupy k štúdiu makroskopických systémov. 2. Základné princípy molekulárnej kinetickej teórie hmoty. 3. Experimentálne
Dnes je streda 9. júla 014 MOLEKULÁRNA KINETICKÁ TEÓRIA Prednáška Obsah prednášky: *Základná rovnica kinetickej teórie plynov *Priemerná kinetická energia molekúl * Rýchlosti molekúl plynu *Priemer
2.1. Základné ustanovenia molekulárnej kinetickej teórie Základné zákony a vzorce Na charakterizáciu hmotností atómov a molekúl sa používajú veličiny nazývané relatívna atómová hmotnosť prvku.
MINISTERSTVO ŠKOLSTVA A VEDY RUSKA Federálna štátna rozpočtová vzdelávacia inštitúcia vyššieho vzdelávania "Ukhta State Technical University" (USTU) 87 ZÁKONOV IDEÁLNEHO PLYNU Boyleov zákon
Teplota 1. Termometrická látka a termometrická veličina (vlastnosť). 2. Teplota a tlak 3. Boltzmannova konštanta. Teplota 2 m0< v кв >p = n Z rovnice 3 2 vyplýva, že tlak
Prednáška 6. Základné pojmy a princípy teórie molekulovej kinetiky. Zákony o plyne. Grafické znázornenie tepelných procesov Ph.D. S.E. Muravyov. Základné pojmy a princípy molekulárnej kinetiky
I. V. Jakovlev Materiály z fyziky MathUs.ru Izoprocesy Témy jednotnej štátnej skúšky kodifikátor: izoprocesy, izotermické, izochorické, izobarické procesy. V tomto dokumente sa budeme držať nasledujúceho predpokladu:
Množstvo, jeho definícia Označenie Adresár vzorcov Merná jednotka Vzorec Množstvo vo vzorci. Koncentrácia látky je fyzikálna veličina, ktorá vyjadruje počet častíc za m n / m n =. Molár
PRÁCA 2 ŠTÚDIUM IZOTERMICKÝCH PROCESOV STLAČOVANIA A EXPANZIE VZDUCHU Účel práce: skontrolovať plnenie Boyleovho-Mariotteho zákona v izotermických procesoch. Úvod Termodynamika sa zaoberá termodynamikou
Prednáška. Dôsledky Lorentzových transformácií Lorentzova kontrakcia dĺžky Spomalenie toku času. Relativistická dynamika 3. Základy molekulovej fyziky Model ideálneho plynu, stavová rovnica ideálu
Kuzmichev Sergey Dmitrievich 1 Obsah prednášky 1 1. Termodynamika a molekulová kinetická teória (štatistická fyzika). 2. Systém, mikro- a makroskopický stav, termodynamická rovnováha,
Molekulárna fyzika. Ktorý z nasledujúcich vzorcov vyjadruje počet molekúl v danej hmotnosti plynu? p N a A) M m B) N M A N m C) A M m N D) A M V E) n V 2. Ktoré grafy na obrázkoch predstavujú izobarický proces?
Federálna agentúra pre vzdelávanie Ruskej federácie TOMSK ŠTÁTNA UNIVERZITA RIADIACICH SYSTÉMOV A RÁDIOELEKTRONIKY (TUSUR) Katedra fyziky A.M. Kirillov FYZIKA V POZADÍCH POZNÁMKY A PRÍKLADY
Zákony o plyne. Clapeyron-Mendelejevova rovnica (prednáška 1a, akademický rok 2015-2016) Teplota a metódy jej merania Z každodennej skúsenosti každý vie, že existujú horúce a studené telesá. Experimenty a pozorovania
6. prednáška Lukyanov I.V. Transportné javy v plynoch. Obsah: 1. Stredná voľná dráha molekúl. 2. Distribúcia molekúl strednou voľnou cestou. 3. Difúzia. 4. Viskozita plynu (vnútorné trenie).
Zákony plynu určujú kvantitatívne vzťahy medzi dvoma parametrami plynu s konštantnou hodnotou tretieho. Zákony o plynoch platia pre všetky plyny a zmesi plynov. Stav daného množstva plynu
Oboznámenie stredoškolákov so štruktúrou rozvinutej fyzikálnej teórie pri opakovaní a zovšeobecňovaní študovaného materiálu Sterelyukhin A.I., Fedorov V.A. (TSU pomenovaná po G.R. Derzhavinovi) V metodológii vedeckej
Téma 8. Základy MCT štruktúra hmoty 1. Základné ustanovenia MCT MCT je teória, ktorá vysvetľuje tepelné javy v makroskopických telesách na základe myšlienky, že všetky telesá pozostávajú zo súvisle
Termodynamika a molekulová fyzika Makrosystémy štatistická metóda termodynamická metóda štatistická fyzika molekulová fyzika MCT termodynamika Termodynamika a molekulová fyzika Zákony ideálov
3.. Práca a množstvo tepla. 3... Práca vonkajších síl a práca tela. Zapíšme si prácu da vykonanú vonkajšou silou -F x (mínus znamená, že vonkajšia sila smeruje proti vnútorným silám tlaku plynu)
CL 2 Možnosť 1 1. Formulujte Galileov princíp relativity. 2. Kinetická energia relativistickej častice. Zapíšte vzorec, vysvetlite 3. Napíšte vzorec pre strednú druhú Brownovu rýchlosť
Dištančný tréning bituru FYZIKA Článok 9 Model ideálneho plynu Teoretický materiál V tomto článku sa budeme zaoberať prvkami molekulárnej kinetickej teórie (ďalej len MKT) Pripomeňme si základné vzorce,
Laboratórne práce.8 KONTROLA BOYLE-MARIOTTEHO ZÁKONA I.A. Aniščenko, A. Yu. Pyrkin Účel práce: kontrola plnenia Boyleovho-Mariottovho zákona pre vzduch pri izbovej teplote. Úloha: zmerajte tlak
Ministerstvo školstva a vedy Ruskej federácie Federálna agentúra pre vzdelávanie Štátna vzdelávacia inštitúcia vyššieho odborného vzdelávania "ŠTÁTNA UNIVERZITA ROSTOV"
Základné ustanovenia IKT. Ideálny plynový model. Zákony Boyle-Mariotte, Gay-Lussac, Charles. Clapeyron - Mendelejevova rovnica. Molekula a mol látky. Molekulová a molárna hmotnosť. Avogadroovo číslo.
Základná rovnica MKT. Molekulárno-kinetický význam pojmu termodynamická teplota.
Rozloženie rýchlosti molekúl ideálneho plynu (Maxwellovo rozdelenie). Charakteristické rýchlosti molekúl. Rozloženie molekúl ideálneho plynu v potenciálnom silovom poli (Boltzmannovo rozdelenie). Barometrický vzorec.
Priemerný počet zrážok a priemerná voľná dráha molekúl. Prenosové javy: difúzia, vnútorné trenie, tepelná vodivosť.
Základy termodynamiky
Termodynamická metóda na štúdium všeobecných vlastností makroskopických systémov. Vnútorná energia ako termodynamická funkcia stavu systému. Počet stupňov voľnosti molekuly. Zákon rovnomerného rozloženia energie v stupňoch voľnosti molekúl. Prvý zákon termodynamiky. Práca plynu a množstvo tepla. Špecifické a molárne tepelné kapacity. Mayerova rovnica.
Aplikácia prvého zákona termodynamiky na izoprocesy. Adiabatický proces.
Tepelné motory. Carnotov cyklus a jeho účinnosť. Pojem entropia. Druhý zákon termodynamiky.
Elektrostatika
Elektrické náboje a ich vlastnosti. Zákon zachovania elektrického náboja. Coulombov zákon. Elektrostatické pole. Intenzita elektrostatického poľa. Princíp superpozície elektrostatických polí.
Vektorový tok napätia. Gaussova veta a jej aplikácia na výpočet elektrostatických polí.
Potenciál a potenciálny rozdiel elektrostatického poľa. Ekvipotenciálne plochy. Vzťah medzi napätím a potenciálom.
Dipól v elektrostatickom poli. Polarizácia dielektrika. Dielektrická konštanta látky. Indukcia elektrického poľa.
Vodiče v elektrostatickom poli. Rozloženie nábojov na povrchu vodičov. Elektrické kapacity izolovaného vodiča a kondenzátora. Paralelné a sériové zapojenie kondenzátorov. Energia nabitého vodiča a kondenzátora. Energia a hustota energie elektrostatického poľa.
Jednosmerný elektrický prúd
Prúdová sila a hustota. Vonkajšie sily. Elektromotorická sila a napätie. Ohmov zákon. Odpor vodiča. Sériové a paralelné pripojenie vodičov. Práca a súčasný výkon. Joule-Lenzov zákon. Kirchhoffove pravidlá pre rozvetvené reťazce.
| N O M E R A S A D A H | 7.11 | 7.12 | 7.13 | 7.14 | 7.15 | 7.16 | 7.17 | 7.18 | 7.19 | 7.20 |
| 7.1 | 7.2 | 7.3 | 7.4 | 7.5 | 7.6 | 7.7 | 7.8 | 7.9 | 7.10 | |
| 6.11 | 6.12 | 6.13 | 6.14 | 6.15 | 6.16 | 6.17 | 6.18 | 6.19 | 6.20 | |
| 6.1 | 6.2 | 6.3 | 6.4 | 6.5 | 6.6 | 6.7 | 6.8 | 6.9 | 6.10 | |
| 5.1 | 5.2 | 5.3 | 5.4 | 5.5 | 5.6 | 5.7 | 5.8 | 5.9 | 5.10 | |
| 4.1 | 4.2 | 4.3 | 4.4 | 4.5 | 4.6 | 4.7 | 4.8 | 4.9 | 4.10 | |
| 3.21 | 3.22 | 3.23 | 3.24 | 3.25 | 3.26 | 3.27 | 3.28 | 3.29 | 3.30 | |
| 3.11 | 3.12 | 3.13 | 3.14 | 3.15 | 3.16 | 3.17 | 3.18 | 3.19 | 3.20 | |
| 3.1 | 3.2 | 3.3 | 3.4 | 3.5 | 3.6 | 3.7 | 3.8 | 3.9 | 3.10 | |
| 2.31 | 2.32 | 2.33 | 2.34 | 2.35 | 2.36 | 2.37 | 2.38 | 2.39 | 2.40 | |
| 2.21 | 2.22 | 2.23 | 2.24 | 2.25 | 2.26 | 2.27 | 2.28 | 2.29 | 2.30 | |
| 2.11 | 2.12 | 2.13 | 2.14 | 2.15 | 2.16 | 2.17 | 2.18 | 2.19 | 2.20 | |
| 2.1 | 2.2 | 2.3 | 2.4 | 2.5 | 2.6 | 2.7 | 2.8 | 2.9 | 2.10 | |
| 1.11 | 1.12 | 1.13 | 1.14 | 1.15 | 1.16 | 1.17 | 1.18 | 1.19 | 1.20 | |
| 1.1 | 1.2 | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 1.10 | |
| č. var |
Prvky kinematiky
Základné vzorce
· Priemerné a okamžité rýchlosti hmotného bodu:
kde je pohyb bodu v čase, je vektor polomeru, ktorý určuje polohu bodu.
Pre priamočiary rovnomerný pohyb ():
kde je cesta prejdená bodom v čase .
· Priemerné a okamžité zrýchlenie hmotného bodu:
Plné zrýchlenie pri pohybe v oblúku:
kde je tangenciálna zložka zrýchlenia nasmerovaná tangenciálne k trajektórii; - normálna zložka zrýchlenia smerujúca do stredu zakrivenia trajektórie ( - polomer zakrivenia trajektórie v danom bode).
· Dráha a rýchlosť rovnomerného pohybu hmotného bodu ():
kde je počiatočná rýchlosť, „+“ zodpovedá rovnomerne zrýchlenému pohybu, „-“ rovnomerne pomalému pohybu.
· Uhlová rýchlosť:
Uhlové zrýchlenie:
· Uhlová rýchlosť pre rovnomerný rotačný pohyb tuhého telesa:
kde je uhol natočenia tela, je doba otáčania; - frekvencia otáčania ( – počet otáčok vykonaných telom v priebehu času).
· Uhol otáčania a uhlová rýchlosť pre rovnomerný rotačný pohyb tuhého telesa ():
kde je počiatočná uhlová rýchlosť, „+“ zodpovedá rovnomerne zrýchlenej rotácii, „-“ rovnomerne pomalej rotácii.
· Vzťah medzi lineárnymi a uhlovými veličinami:
kde je vzdialenosť od bodu k okamžitej osi rotácie.
Príklady riešenia problémov
Problém 1. Závislosť vzdialenosti prejdenej telesom od času vyjadruje rovnica ( = 2 m/s, = 3 m/s 2, = 5 m/s 3). Zapíšte si výrazy pre rýchlosť a zrýchlenie. Určte prejdenú vzdialenosť, rýchlosť a zrýchlenie pre okamih po začiatku pohybu.
| Dané: ; ; ; ; . | Riešenie: Na určenie závislosti rýchlosti telesa od času určíme prvú deriváciu dráhy vzhľadom na čas: , alebo po dosadení Na určenie závislosti zrýchlenia telesa od času určíme prvú deriváciu. rýchlosti vzhľadom na čas: , alebo po striedaní . Prejdená vzdialenosť je definovaná ako rozdiel. |
| |
Úloha 2. Teleso je hodené rýchlosťou pod uhlom k horizontále. Berúc telo ako hmotný bod, určte normál a tangenciálny zrýchlenie tela 1,2 s po začatí pohybu.

Pri pohybe bodu zostáva veľkosť a smer projekcie konštantná.
Projekcia na os sa zmení. V bode C (obrázok 1.1) je rýchlosť smerovaná horizontálne, t.j. . To znamená, že , kde je čas, počas ktorého hmotný bod vystúpi do svojej maximálnej výšky, alebo po dosadení .
Do 1,2 s bude telo na zostupe. Celkové zrýchlenie počas pohybu smeruje kolmo nadol a rovná sa gravitačnému zrýchleniu. Normálne zrýchlenie sa rovná priemetu tiažového zrýchlenia do smeru polomeru zakrivenia a tangenciálne zrýchlenie sa rovná priemetu tiažového zrýchlenia do smeru rýchlosti pohybu (pozri obr. 1.1).
Z trojuholníkov rýchlostí a zrýchlení máme:
kde , ,
kde je rýchlosť v čase
Po nahradení dostaneme:
Odpoveď: ,.
Úloha 3. Koleso auta sa otáča rovnakou rýchlosťou. V priebehu 2 minút zmenil rýchlosť otáčania z 240 na 60 min -1. Určte: 1) uhlové zrýchlenie kolesa; 2) počet úplných otáčok kolesa počas tejto doby.
kde sú uhlové rýchlosti v počiatočných a konečných časových okamihoch.
Z rovnice (2) dostaneme:
Uhol natočenia. Preto výraz (1) možno zapísať takto: .
Odtiaľ: .
Odpoveď: ; .
Úloha 4. Bod sa pohybuje po kružnici s polomerom tak, že závislosť uhla natočenia polomeru od času je daná rovnicou , kde , . Do konca druhej sekundy rotácie určite: a) uhlovú rýchlosť; b) lineárna rýchlosť; c) uhlové zrýchlenie; d) normálne zrýchlenie; e) tangenciálne zrýchlenie.
| Vzhľadom na to: ; . | Riešenie: Závislosť uhlovej rýchlosti od času určíme tak, že vezmeme prvú deriváciu uhla natočenia vzhľadom na čas, t.j. . Na určitý čas , . Lineárna rýchlosť bodu alebo po substitúcii. |
| Závislosť uhlového zrýchlenia bodu od času je určená prvou deriváciou uhlovej rýchlosti vzhľadom na čas, t.j. . Na určitý čas . Normálne a tangenciálne zrýchlenie sú určené vzorcami: | |
| |
Testovacie úlohy
1.1. Teleso padá vertikálne z výšky 19,6 m s nulovou počiatočnou rýchlosťou. Akú vzdialenosť prekoná teleso: 1) počas prvých 0,1 s svojho pohybu, 2) počas posledných 0,1 s svojho pohybu? počítať . Zanedbajte odpor vzduchu.
1.2. Teleso padá vertikálne z výšky 19,6 m s nulovou počiatočnou rýchlosťou. Ako dlho bude telu trvať, kým prekoná: 1) prvý 1 m svojej dráhy, 2) posledný 1 m svojej dráhy? počítať . Zanedbajte odpor vzduchu.
1.3. Teleso je vrhané z veže v horizontálnom smere s počiatočnou rýchlosťou 10 m/s. Zanedbajúc odpor vzduchu určte pre čas = 2 s po začatí pohybu: 1) rýchlosť tela; 2) polomer zakrivenia trajektórie. počítať .
1.4. Kameň je hodený horizontálne rýchlosťou 5 m/s. Určte normálne a tangenciálne zrýchlenie kameňa 1 s po začatí pohybu. počítať . Zanedbajte odpor vzduchu.
1.5. Hmotný bod sa začne pohybovať po kružnici s polomerom = 2,5 cm s konštantným tangenciálnym zrýchlením = 0,5 cm/s 2 . Určte: 1) časový okamih, v ktorom vektor zrýchlenia zviera s vektorom rýchlosti uhol 45°; 2) dráhu, ktorú prejde pohybujúci sa bod počas tejto doby.
1.6. Závislosť vzdialenosti prejdenej telesom od času je daná rovnicou, kde =0,1m, =0,1m/s, =0,14m/s2, =0,01m/s3. 1) Ako dlho po začatí pohybu bude zrýchlenie telesa rovné 1 m/s 2? 2) Aké je priemerné zrýchlenie tela počas tohto časového obdobia? po začatí pohybu prejdená vzdialenosť, rýchlosť a zrýchlenie. pre túto chvíľu.
1.13. Kotúč sa otáča okolo pevnej osi tak, že závislosť uhla natočenia polomeru kotúča od času je daná rovnicou ( = 0,1 rad/s 2). Určte celkové zrýchlenie bodu na okraji disku do konca druhej sekundy po začiatku pohybu, ak je v tomto okamihu lineárna rýchlosť tohto bodu 0,4 m/s.
1.14. Kotúč s polomerom 0,2 m sa otáča okolo pevnej osi tak, že závislosť uhlovej rýchlosti od času je daná rovnicou, kde . Pre body na okraji disku do konca prvej sekundy po začiatku pohybu určite celkové zrýchlenie a počet otáčok, ktoré disk vykoná počas prvej minúty pohybu.
1.15. Kotúč s polomerom 10 cm sa otáča tak, že závislosť uhla natočenia polomeru kotúča od času je daná rovnicou ( = 2 rad, = 4 rad/s 3). Určte pre body na ráfiku kolesa: 1) normálne zrýchlenie v čase 2 s; 2) tangenciálne zrýchlenie pre ten istý moment; 3) uhol natočenia, pri ktorom je celkové zrýchlenie s polomerom kolesa 45°.
1.16. Kotva elektromotora s rýchlosťou otáčania 50 s -1 sa po vypnutí prúdu zastavila a urobila 628 otáčok. Určte uhlové zrýchlenie kotvy.
1.17. Koleso automobilu sa otáča rovnomerným zrýchlením. V priebehu 2 minút zmenil rýchlosť otáčania zo 60 na 240 min -1. Určte: 1) uhlové zrýchlenie kolesa; 2) počet úplných otáčok kolesa počas tejto doby.
1.18. Koleso, rotujúce rovnomerne zrýchlené, dosiahlo uhlovú rýchlosť 20 rad/s 10 otáčok po začiatku rotácie. Nájdite uhlové zrýchlenie kolesa.
1.19. Koleso 1 minútu po začiatku otáčania nadobudne rýchlosť zodpovedajúcu frekvencii 720 ot./min. Nájdite uhlové zrýchlenie kolesa a počet otáčok kolesa počas tejto minúty. Pohyb sa považuje za rovnomerne zrýchlený.
1.20. Koleso, ktoré sa otáča rovnakou rýchlosťou, počas brzdenia znížilo rýchlosť otáčania za 1 minútu z 300 otáčok za minútu na 180 otáčok za minútu. Nájdite uhlové zrýchlenie kolesa a počet otáčok vykonaných počas tejto doby.
Táto príručka obsahuje testy na sebaovládanie, nezávislú prácu a viacúrovňové testy.
Navrhované didaktické materiály sú zostavené v úplnom súlade so štruktúrou a metodikou učebníc V. A. Kasyanova „Fyzika. Základná úroveň. 10. ročník“ a „Fyzika. Pokročilá úroveň. Stupeň 10".
Príklady úloh:
TS 1. Pohyb. Rýchlosť.
Rovnomerný lineárny pohyb
možnosť 1
1. Rovnomerným pohybom prejde cyklista 40 m za 4 s. Ako ďaleko prejde pri pohybe rovnakou rýchlosťou za 20 s?
A. 30 m B. 50 m C. 200 m.
2. Obrázok 1 ukazuje graf pohybu motocyklistu. Určte z grafu vzdialenosť, ktorú prejde motocyklista v časovom intervale od 2 do 4 s.
A. 6m. B. 2 m C. 10 m.
3. Obrázok 2 znázorňuje grafy pohybu troch telies. Ktorý z týchto grafov zodpovedá pohybu vyššou rýchlosťou?
A. 1. B. 2. C. 3.
4. Pomocou grafu pohybu uvedeného na obrázku 3 určite rýchlosť telesa.
A. 1 m/s. B. 3 m/s. V. 9 m/s.
5. Po ceste sa pohybujú dve autá konštantnou rýchlosťou 10 a 15 m/s. Počiatočná vzdialenosť medzi autami je 1 km. Určte, ako dlho bude trvať, kým druhé auto dobehne prvé.
A. 50 s. B. 80 p. V. 200 s.
Predslov.
SEBAOVLÁDACIE TESTY
TS-1. Sťahovanie. Rýchlosť.
Rovnomerný priamy pohyb.
TS-2. Priamočiary pohyb s konštantným zrýchlením
TS-3. Voľný pád. Balistický pohyb.
TS-4. Kinematika periodického pohybu.
TS-5. Newtonove zákony.
TS-6. Sily v mechanike.
TS-7. Aplikácia Newtonových zákonov.
TS-8. Zákon zachovania hybnosti.
TS-9. Dielo sily. Moc.
TS-10. Potenciálna a kinetická energia.
TS-11. Zákon zachovania mechanickej energie.
TS-12. Pohyb telies v gravitačnom poli.
TS-13. Dynamika voľných a vynútených vibrácií.
TS-14. Relativistická mechanika.
TS-15. Molekulárna štruktúra hmoty.
TS-16. Teplota. Základná rovnica teórie molekulovej kinetiky.
TS-17. Clapeyron-Mendelejevova rovnica. Izoprocesy.
TS-18. Vnútorná energia. Práca s plynom počas izoprocesov. Prvý zákon termodynamiky.
TS-19. Tepelné motory.
TS-20. Odparovanie a kondenzácia. Nasýtená para. Vlhkosť vzduchu. Vriaca kvapalina.
TS-21. Povrchové napätie. Zmáčanie, vzlínavosť.
TS-22. Kryštalizácia a topenie pevných látok.
TS-23. Mechanické vlastnosti pevných látok.
TS-24. Mechanické a zvukové vlny.
TS-25. Zákon zachovania náboja. Coulombov zákon.
TS-26. Intenzita elektrostatického poľa.
TS-27. Práca síl elektrostatického poľa. Potenciál elektrostatického poľa.
TS-28. Dielektrika a vodiče v elektrostatickom poli.
TS-29. Elektrická kapacita izolovaného vodiča a kondenzátora. Energia elektrostatického poľa.
NEZÁVISLÁ PRÁCA
SR-1. Rovnomerný priamy pohyb.
SR-2. Priamočiary pohyb s konštantným zrýchlením.
SR-3. Voľný pád. Balistický pohyb.
SR-4. Kinematika periodického pohybu.
SR-5. Newtonove zákony.
SR-6. Sily v mechanike.
SR-7. Aplikácia Newtonových zákonov.
SR-8. Zákon zachovania hybnosti.
SR-9. Dielo sily. Moc.
SR-9. Dielo sily. Moc.
SR-10. Potenciálna a kinetická energia. Zákon zachovania energie.
SR-11. Absolútne nepružná a absolútne elastická kolízia.
SR-12. Pohyb telies v gravitačnom poli.
SR-13. Dynamika voľných a vynútených vibrácií.
SR-14. Relativistická mechanika.
SR-15. Molekulárna štruktúra hmoty.
SR-16. Teplota. Základná rovnica teórie molekulovej kinetiky.
SR-17. Clapeyron-Mendelejevova rovnica. Izoprocesy.
SR-18. Vnútorná energia. Práca s plynom počas izoprocesov.
SR-19. Prvý zákon termodynamiky.
SR-20. Tepelné motory.
SR-21. Odparovanie a kondenzácia. Nasýtená para. Vlhkosť vzduchu.
SR-22. Povrchové napätie. Zmáčanie, vzlínavosť.
SR-23. Kryštalizácia a topenie pevných látok. Mechanické vlastnosti pevných látok.
SR-24. Mechanické a zvukové vlny.
SR-25. Zákon zachovania náboja. Coulombov zákon.
SR-26. Intenzita elektrostatického poľa.
SR-27. Práca síl elektrostatického poľa. Potenciál.
SR-28. Dielektrika a vodiče v elektrostatickom poli.
SR-29. Elektrická kapacita. Energia elektrostatického poľa
TESTOVACIE LISTY
KR-1. Priamočiary pohyb.
KR-2. Voľný pád tiel. Balistický pohyb.
KR-3. Kinematika periodického pohybu.
KR-4. Newtonove zákony.
KR-5. Aplikácia Newtonových zákonov.
KR-6. Zákon zachovania hybnosti.
KR-7. Zákon zachovania energie.
KR-8. Molekulárna kinetická teória ideálneho plynu
KR-9. Termodynamika.
KR-10. Súhrnné stavy hmoty.
KR-11. Mechanické a zvukové vlny.
KR-12. Sily elektromagnetickej interakcie stacionárnych nábojov.
KR-13. Energia elektromagnetickej interakcie stacionárnych nábojov.
ODPOVEDE
Testy na sebaovládanie.
Samostatná práca.
Testovacie papiere.
Bibliografia.
Stiahnite si e-knihu zadarmo vo vhodnom formáte, pozerajte a čítajte:
Stiahnite si knihu Fyzika, ročník 10, didaktické materiály k učebniciam Kasyanova V.A., Maron A.E., 2014 - fileskachat.com, rýchle a bezplatné stiahnutie.
- Fyzika, ročník 10, základná úroveň, učebnica, Kasyanov V.A., 2014