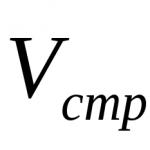1) Fyzikálne metódy: odparovanie (odparovanie), destilácia
Odparovanie – neúplné odparenie rozpúšťadla (zníženie objemu – koncentrácia)
Odparovanie – odparenie rozpúšťadla do sucha (nasledované rozpustením suchého zvyšku v malom objeme)
Destilácia – oddelenie prchavých zložiek
2) Chemické metódy: zrážky, koprecipitácia
Zrážky – separácia (systematický priebeh analýzy); koncentrácia (precipitácia iónu, ktorá sa má stanoviť z veľkého objemu analyzovaného roztoku a rozpustenie zrazeniny v malom objeme)
Spoluzrážanie – súčasné vyzrážanie z rovnakého roztoku mikrozložky rozpustnej za daných podmienok s vyzrážanou makrozložkou.
Príčiny koprecipitácie: 1) povrchová adsorpcia - spoluvyzrážaná látka sa adsorbuje na povrch kolektora a ukladá sa s ním; 2) oklúzia - mechanické zachytenie časti materského roztoku s koprecipitovaným iónom vo vnútri kolektorového sedimentu; 3) inklúzia – tvorba zmiešaných kryštálov
Koprecipitácia slúži na zahustenie látok prítomných v mikromnožstvách v analyzovanom roztoku s následným ich stanovením v koncentráte.
3) Fyzikálno-chemické metódy: extrakcia, chromatografia
Extrakcia – spôsob extrakcie látky z roztoku alebo suchej zmesi pomocou vhodného rozpúšťadla. Na extrakciu z roztoku sa používajú rozpúšťadlá, ktoré sú s týmto roztokom nemiešateľné, ale v ktorých sa látka rozpúšťa lepšie ako v prvom rozpúšťadle. Ťažba sa používa v chemickom, rafinérskom, potravinárskom, hutníckom a farmaceutickom priemysle.
Chromatografia – dynamická sorpčná metóda na separáciu a analýzu zmesí látok, ako aj štúdium fyzikálno-chemických vlastností látok. Je založená na distribúcii látok medzi dve fázy – stacionárnu (tuhá fáza alebo kvapalina viazaná na inertnom nosiči) a mobilnú (plynnú alebo kvapalnú fázu).
88. Metódy kvalitatívnej chemickej analýzy
Mikrokryštalická analýza
Reakcie, pri ktorých vznikajú zlúčeniny s charakteristickými tvarmi kryštálov, sa môžu použiť na detekciu katiónov a aniónov. Tvar a rýchlosť tvorby kryštálov sú ovplyvnené reakčnými podmienkami. Významnú úlohu v mikrokryštaloskopických reakciách zohráva rýchle odparovanie rozpúšťadla, čo vedie ku koncentrácii roztoku a následne k zvýšeniu citlivosti stanovenia iónov.
Pyrochemická analýza
Pri zahrievaní látok v plameni horáka možno pozorovať rôzne charakteristické javy: vyparovanie, topenie, zmenu farby, sfarbenie plameňa. Všetky tieto javy sa využívajú v kvalitatívnej analýze na predbežné testovanie látky. Niekedy je možné pomocou pyrochemických reakcií zvýšiť selektivita a citlivosť stanovenia. Pyrochemické reakcie Používa sa na analýzu minerálov v teréne.
Farbenie plameňom
Keď sa roztok kovovej soli zavádza do plameňa, dochádza k množstvu zložitých procesov: odparovanie, tvorba pevných aerosólov, disociácia, ionizácia, interakcia s kyslíkom, excitácia atómov, iónov a molekúl. Konečným výsledkom týchto procesov je analyticky využívaný efekt - žiara plameňa.
89. Metódy stanovenia kvantitatívneho zloženia zlúčenín

90. Základné fyzikálne veličiny
Fyzikálne množstvo – fyzikálna vlastnosť hmotného predmetu, fyzikálny jav, proces, ktorý možno kvantitatívne charakterizovať.
Hodnota fyzikálnej veličiny – číslo charakterizujúce túto fyzikálnu veličinu, označujúce mernú jednotku, na základe ktorej boli získané.
Sústava fyzikálnych jednotiek – súbor merných jednotiek fyzikálnych veličín, v ktorých je určitý počet takzvaných základných merných jednotiek a zvyšné merné jednotky možno vyjadriť prostredníctvom týchto základných jednotiek. SI (System International) – medzinárodná sústava jednotiek. SI je najpoužívanejší systém jednotiek na svete, a to ako v každodennom živote, tak aj vo vede a technike.
V sústave SI má každá základná veličina zodpovedajúcu jednotku: jednotka dĺžky– meter (m); časová jednotka– druhý (s); jednotka hmotnosti– kilogram (kg); Jednotky intenzita elektrického prúdu- ampér (A); jednotka teploty– kelvin (K); jednotka množstva látky– mol (mol); jednotka svietivosti- candela (cd)
Pri praktickom použití sa jednotky medzinárodného systému často ukážu ako príliš veľké alebo príliš malé, takže desiatkové násobky a čiastkové násobky možno vytvárať pomocou špeciálnych predpôn.
| zvuková doska | Áno | 10 1 | deci | d | 10 -1 |
| hekto | G | 10 2 | centi | s | 10 -2 |
| kilo | Komu | 10 3 | Milli | m | 10 -3 |
| mega | M | 10 6 | mikro | mk | 10 -6 |
| giga | G | 10 9 | nano | n | 10 -9 |
| tera | T | 10 12 | piko | P | 10 -12 |
| peta | P | 10 15 | femto | F | 10 -15 |
| exa | E | 10 18 | atto | A | 10 -18 |
91. Pojem fyzikálnych metód a ich klasifikácia
92. Využitie fyzikálnych metód v odbornom výskume
93. Pojem fyzikálnej veličiny „hustota“. Metódy stanovenia hustoty
Hustota - fyzikálna veličina rovnajúca sa pomeru hmotnosti tela k jeho objemu ( p = m/V). Na základe definície hustoty, jej rozmeru kg/m3 v sústave SI.
Hustota látky závisí od hmotnosť atómov, z ktorých pozostáva, a hustota zloženia atómov a molekúl v látke. Čím väčšia je hmotnosť atómov a čím bližšie sú k sebe, tým väčšia je hustota.
Merače hustoty používa sa na meranie hustoty kvapalín, plynov a pevných látok.
Hustota nehomogénnej hmoty - pomer hmotnosti a objemu, keď sa objem zmršťuje do bodu, v ktorom sa meria hustota. Pomer hustôt dvoch látok za určitých štandardných fyzikálnych podmienok sa nazýva relatívna hustota; pre kvapalné a pevné látky meria sa pri teplote t zvyčajne vo vzťahu k hustote destilovanej vody pri 4 °C, pre plyny– vo vzťahu k hustote suchého vzduchu alebo vodíka za normálnych podmienok ( T= 273 tis., p = 1,01 10 5 Pa).
Pre sypké a porézne pevné látky sa rozlišujú hustoty pravda (hmotnosť jednotky objemu hustého materiálu, ktorý neobsahuje póry), zdanlivá (hmotnosť jednotky objemu porézneho materiálu vyrobeného zo zŕn alebo granúl) a objemová (hmotnosť jednotky objemu vrstvy materiálu ).
94. Pojem fyzikálnej veličiny „hmotnosť“. Metódy určovania hmotnosti
Hmotnosť – skalárna fyzikálna veličina, jedna z hlavných charakteristík hmoty, určujúca jej zotrvačné a gravitačné vlastnosti. Existuje zotrvačná hmotnosť a gravitačná hmotnosť.
Do mechaniky sa zaviedol pojem hmotnosti I. Newton. V klasickej mechanike Newton hmotnosť je zahrnutá v definícii hybnosti (množstva pohybu) telesa: impulz Rúmerné rýchlosti tela V , p=mv (1). Faktor proporcionality – konštantná hodnota pre dané teleso m– a je tu telesná hmota. Ekvivalentná definícia hmotnosti sa získa z pohybovej rovnice klasickej mechaniky F=ma(2). Hmotnosť je tu koeficient úmernosti medzi silou pôsobiacou na teleso F a zrýchlenie tela ním spôsobené a. Hmotnosť určená vzťahmi (1) a (2) sa nazýva zotrvačná (zotrvačná) hmotnosť ; charakterizuje dynamické vlastnosti telesa, je mierou zotrvačnosti telesa: pri konštantnej sile čím väčšia je hmotnosť telesa, tým menšie zrýchlenie nadobúda, t.j. tým pomalšie sa mení stav jeho pohybu.
V teórii gravitácie Newton hmotnosť pôsobí ako zdroj gravitačného poľa. Každé teleso vytvára gravitačné pole úmerné hmotnosti telesa (a je ovplyvnené gravitačným poľom vytvoreným inými telesami, ktorého sila je tiež úmerná hmotnosti telies). Toto pole spôsobuje priťahovanie akéhokoľvek iného telesa k tomuto telesu silou určenou Newtonovým gravitačným zákonom: F = G* (m 1 *m 2 / R 2) - (3), kde R- vzdialenosť medzi telami, G je univerzálna gravitačná konštanta, a m 1 A m 2– masy priťahujúcich tiel.
Zo vzorca (3) je ľahké získať vzorec pre hmotnosť R telesnej hmotnosti m v gravitačnom poli Zeme: P = mg(4). Tu g = G*M/r2- tiažové zrýchlenie v tiažovom poli Zeme. Hmotnosť určená vzťahmi (3) a (4) sa nazýva gravitačná hmotnosť tela .
Váhy - prístroj na zisťovanie hmotnosti telies (váženia) hmotnosťou na ne pôsobiacou, pričom ju približne považujeme za rovnú gravitačnej sile. Uveďme si ako príklad meranie telesnej hmotnosti, ktoré meriame pomocou bežných rovnoramenných váh. Vplyvom gravitácie vznikajú sily. Hmotnosť tela spolu s týmito silami tlačí na jeden pohár a hmotnosť závaží na druhý. Výberom závaží dosiahneme rovnováhu, t.j. rovnosť týchto síl. To nám dáva právo povedať, že hmotnosť váženého telesa sa rovná hmotnosti závaží, za predpokladu, že gravitačná sila vo vzdialenosti medzi pohármi zostane rovnaká. Ako vidíte, na meranie hmotnosti sme museli previesť hmotnosti telesa a závažia na sily a na vzájomné porovnanie síl ich pôsobenie premeniť na mechanický pohyb pák váh.
Práca na kurze:
Metódy separácie a koncentrácie v elementárnej analýze
Úvod
Všeobecná charakteristika separačných metód
Extrakcia ako separačná metóda
Všeobecné charakteristiky koncentračných metód
Koprecipitácia ako koncentračná metóda
Záver
Bibliografia
Úvod
Vývoj analytickej chémie prebieha dvoma hlavnými spôsobmi: vývojom najselektívnejších metód na stanovenie jednotlivých látok a optimálnou kombináciou separačných a koncentračných metód s neselektívnymi metódami stanovenia v kombinovaných metódach analýzy. V tomto prípade selektivita metódy znamená schopnosť registrovať analytický signál zodpovedajúci látke, ktorá sa určuje, na pozadí, ktoré tvoria sprievodné nečistoty a matrica. Pojem kombinované je v úplnom súlade so sémantickým obsahom tohto slova: spojené spolu na dosiahnutie spoločného cieľa. V súlade s tým môžu existovať kombinované separačné metódy, ktorých cieľom je zlepšiť separáciu, a kombinované analytické metódy, ktoré poskytujú optimálnu kombináciu predbežnej separácie s konečným stanovením. Široké používanie kombinovaných metód analýzy, predovšetkým chromatografických, nemožno považovať len za dôsledok obmedzenej selektivity známych metód na priame stanovenie látok v objekte analýzy.
Okrem dôležitej úlohy separačných a koncentračných metód pre kombinované metódy analýzy majú separačné metódy samostatnú hodnotu pri riešení preparatívnych problémov. Analytici neustále potrebujú vysoko čisté látky: rozpúšťadlá, predovšetkým vodu, činidlá a nakoniec všetky látky, ktoré analyzujú. Úlohy prípravy štandardných vzoriek sú také rozmanité ako predmety analýzy. A nie vždy je možné použiť hotové vzorky a ich zložky požadovaného stupňa čistoty. Vo svojich prípravných záujmoch analytická chémia prichádza do úzkeho kontaktu s chemickou technológiou. Metódy separácie a koncentrácie vyvinuté analytikmi sú často implementované do technologických procesov bez toho, aby prešli zásadnými zmenami. V tomto prípade môžeme hovoriť ako o rozsiahlych extrakčných technológiách na výrobu vzácnych kovov, tak o procesoch vo farmaceutickom priemysle, v biochemickej výrobe, kde hranica medzi rozsahom laboratórneho experimentu a priemyselnou výrobou prakticky chýba.
Všeobecná charakteristika separačných metód
Separačnými metódami rozumieme súbor pre ne charakteristických chemických a fyzikálnych procesov a spôsobov ich realizácie. Samotný proces, napríklad separácia látok medzi dvoma kvapalnými fázami, ešte nie je separačnou metódou. V kombinácii so spôsobom implementácie, ktorý zabezpečuje prechod látok z jednej fázy do druhej v dôsledku ich rovnovážneho rozdelenia medzi fázami, sa takýto proces stane extrakciou av kombinácii s chromatografickou metódou - kvapalinovou chromatografiou.
Ťažkosti pri akomkoľvek pokuse o systematizáciu separačných metód spôsobujú kombinované metódy analýzy. Pod názvami „plynová“ a „kvapalná“ chromatografia sa skrývajú metódy chromatografickej separácie látok v plynnej a kvapalnej fáze, ako aj zodpovedajúce kombinované metódy.
Stále neexistuje všeobecne akceptovaná klasifikácia separačných a koncentračných medov. Pri spoločnom zvažovaní rôznych metód sa najčastejšie stretnete s ich jednoduchým vymenovaním. Alebo so zoskupením podľa niektorých formálnych kritérií mimo všeobecnej klasifikácie. Pri systematizácii separačných metód sa v najjednoduchšom prípade vychádza z toho, že metóda patrí do tej či onej oblasti vedy, ktorá ju zrodila: chemické, fyzikálno-chemické, fyzikálne metódy. Klasifikujme separačné metódy v nižšie uvedených tabuľkách.
Tabuľka 1. Separačné metódy založené na vytvorení novej fázy izolovanou látkou
Súhrnný stav fázy, v ktorej sa nachádza počiatočná zmes látok Súhrnný stav izolovanej fázy Pevné teleso Plyn Kvapalina Kvapalina Zrážanie, elektrolytické vylučovanie, mrazenie, kryštalizácia Destilácia, destilácia, rektifikácia - Plyn - Tuhá látka - Destilácia pri vysokej teplote pri interakcii s a plynné činidlo, sublimácia Selektívne rozpúšťanie
Metódy fázovej separácie zahŕňajú štyri skupiny a sú založené na:
2.rozdiely v distribúcii látok medzi fázami; .rozdiely v prenose hmoty, prejavujúce sa počas indukovaného prechodu látky z jednej fázy do druhej cez tretiu fázu, ktorá ich oddeľuje; .mechanizmy intrafázovej separácie. Pre prvú skupinu metód sú charakteristické agregačné stavy východiskovej zmesi látok a izolovanej fázy (tabuľka 1). Metódy druhej skupiny sú založené na všeobecných vzorcoch distribúcie látok medzi fázami a možno ich charakterizovať ich stavom agregácie a spôsobom uskutočňovania procesu medzifázovej distribúcie. Pre tretiu a štvrtú skupinu je charakteristickým znakom okrem stavu agregácie fáz aj povaha hnacích síl procesu. Význam separačných metód zahrnutých v prvej skupine pre analytickú chémiu nie je ani zďaleka nejednoznačný. Procesy vymrazovania kvapalnej aj plynnej fázy a selektívne rozpúšťanie tuhej fázy sa používajú pomerne zriedkavo. Zmrazovanie sa používa pri analýze plynov na oddelenie vlhkosti a na kryogénne koncentrovanie nečistôt s vyššou teplotou varu. Selektívne rozpúšťanie sa používa v dvoch variantoch: čiastočné alebo úplné rozpustenie matrice a selektívne rozpustenie fáz. Príkladom úplného rozpustenia matrice je rozpustenie ocelí a zliatin pri určovaní nekovových inklúzií: oxidy, karbidy, nitridy. Pre analytickú chémiu sú najdôležitejšie separačné metódy založené na rozdieloch v distribúcii látok medzi fázami: extrakcia, sorpcia, rôzne chromatografické metódy. Charakteristickým znakom separačných metód tejto skupiny je okrem fázového systému aj spôsob uskutočňovania procesu medzifázovej separácie (tabuľka 2) Tabuľka 2. Separačné metódy založené na rozdieloch v distribúcii látok medzi fázami Fázový systém Spôsob implementácie procesu medzifázovej separácie Jednotná rovnovážna distribúcia Viacnásobné opakovania procesu distribúcie zmena, adsorpcia, gélová permeácia, afinitná chromatografia Kvapalina-plynextrakciaplynuprebublávanieplyn-kvapalina a kvapalina-plynová chromatografia Kritická látka-tuhá látka (kvapalina)Superkritická tekutinová extrakciaSuperkritická tekutinová extrakcia chromatografia
Extrakcia ako separačná metóda
Zo separačných metód založených na jedinej rovnovážnej separácii látok má najväčší praktický význam extrakcia. Extrakcia je jednou z najspoľahlivejších, veľmi účinných a rozšírených metód na zahusťovanie a oddeľovanie látok. Výskum a aplikácia extrakcie je popredným, rýchlo sa rozvíjajúcim smerom v modernej chémii. Extrakcia sa týka tak procesu distribúcie látok medzi dve fázy, ako aj separačnej metódy založenej na tomto procese. V najvšeobecnejšom prípade môžeme uvažovať o fázových rovnováhách v systémoch kvapalina-kvapalina, kvapalina-plyn. Existuje široká škála kvapalných fáz: voda a vodné roztoky, organické rozpúšťadlá a roztoky iných organických zlúčenín v nich, roztavené soli a kovy, taveniny pevných organických zlúčenín za normálnych podmienok. Metóda extrakcie plynu (systém kvapalina-plyn a menej často systém pevná látka-plyn) má užší účel - na analýzu plynných a prchavých zlúčenín v kondenzovaných fázach a líši sa od konvenčnej extrakcie iba tým, že ako extrakčné činidlo sa používa plyn. , ktorý nezasahuje do analytického stanovenia plynných zlúčenín.nečistoty. Mnohé metódy blízke extrakcii, ako je papierová a stĺpcová deliaca chromatografia, sú založené na distribúcii látok medzi dve kvapalné fázy. Pri deliacej chromatografii je jedna z fáz, organická alebo vodná, fixovaná na inertnom nosiči, zatiaľ čo druhá je pohyblivá. Tým sa dosiahne viacnásobná výmena medzi fázami. Zvlášť dôležitá je extrakcia rôznych zlúčenín kovov z vodných roztokov do organických rozpúšťadiel, ktoré sú s nimi nemiešateľné. Extrakcia sa uskutočňuje 1) uvedením roztokov (kovových iónov a extrakčného činidla) do kontaktu (miešanie); 2) mechanická separácia fáz; 3) regenerácia extrakčného činidla. Oblasti použitia extrakcie sú veľmi rôznorodé. Extrakcia umožňuje oddeliť od bázy aj malé množstvá nečistôt, čo je dôležité najmä pri získavaní a analýze vysoko čistých materiálov, separácii rádioizotopov, čistení biologických materiálov atď. Extrakcia sa používa menej často na oddelenie bázy od stôp a spravidla iba v prípadoch, keď sa nedajú izolovať nečistoty. Makrokomponenty sa zvyčajne extrahujú vo forme komplexných halogenidových kyselín kovov (napríklad železo z roztokov HCl s dietyléterom) alebo koordinačných solvatačných solí. Mikronečistoty sa často extrahujú vo forme intrakomplexných zlúčenín, menej často - vo forme komplexných kovových kyselín. Extrakcia je účinná aj pri oddeľovaní zložiek s podobnými vlastnosťami, vrátane vysokovriacich látok a azeotropných zmesí. Extrakcia sa široko používa na zvýšenie citlivosti stanovení mnohými chemickými a fyzikálno-chemickými metódami analýzy. Extrakcia zohráva významnú úlohu pri štúdiu rovnováh v roztokoch, zložitých formovacích procesoch a vôbec pri štúdiu stavu látok v roztokoch. Výhody extrakcie, ako je všestrannosť, rýchlosť, jednoduchosť implementácie, rýchlosť, nízke prevádzkové teploty, dostupnosť, nedostatok zložitého vybavenia, relatívne malá (alebo dokonca absencia) koextrakcie a iné, robia extrakciu veľmi efektívnou metódou koncentrácie mikronečistôt a separačné látky. Doteraz boli vyvinuté metódy na extrakciu takmer všetkých prvkov a mnohých tried zlúčenín tak na preparatívne účely, ako aj v technológii, najmä v jadrovej technológii. Extrakciu možno použiť pre absolútnu aj relatívnu koncentráciu. Pre analýzu je dôležitejšia relatívna extrakčná koncentrácia, pri ktorej sa dosiahne obohatenie, t.j. pomer medzi makro- a mikrozložkami klesá. V praxi chemickej analýzy sa extrakcia používa buď len ako separačná metóda; izolovaný prvok sa v tomto prípade (v prípade potreby je extrakt premineralizovaný) stanovuje akoukoľvek konvenčnou metódou, prípadne v kombinácii s následným stanovením (extrakčne-fotometrická, extrakčne-polarografická a iné, tzv. kombinované metódy). Stanovenie požadovaného prvku sa môže uskutočniť vo vodnom aj organickom prostredí Fázový systém Hnacia sila procesu Chemický potenciálový gradient Elektrický potenciálový gradient Tlakový gradient Kvapalina-kvapalina-kvapalina Dialýza cez kvapalinové membrány Elektrodialýza cez kvapalinové membrány - Kvapalina-tuhá látka-kvapalina Dialýza Elektrodialýza, elektroosmózaUltrafiltrácia, reverzná osmóza, piezodialýza Kvapalina-tuhá látka-plynOdparovanie cez membránu - - Separácia plyn-tuhá látka-plyn difúziou - - Separačné metódy založené na viacnásobnom rovnovážnom rozdelení majú vždy zásadné obmedzenia v čistote izolovaných frakcií. Je zrejmé, že dobré oddelenie v tomto prípade možno dosiahnuť iba vtedy, ak existuje významný rozdiel vo vlastnostiach separovaných látok. Proces v oblasti týchto metód je úplne determinovaný tvorbou nových selektívnych sorbentov alebo extrakčných činidiel. Ale objavenie sa zásadne nových tried takýchto zlúčenín, ako sú organofosforové extrakčné činidlá korunové étery alebo chirálne sorbenty, je relatívne zriedkavým javom. Hľadanie spravidla vedie k potrebe získať čoraz zložitejšie a drahšie zlúčeniny a pozitívny efekt ich použitia neospravedlňuje náklady na vyhľadávanie. Na základe údajov uvedených v tabuľke. 2 klasifikácie metód na základe rozdielov v distribúcii látok medzi fázami možno vidieť ďalší spôsob zvýšenia účinnosti metód tejto skupiny, ktorý spočíva v zlepšení metód vykonávania procesov medzifázového distribúcie, pri prechode z jednotlivých procesov na viacstupňové a chromatografické. Môže sa zdať trochu zvláštne, že chromatografická metóda je klasifikovaná ako metóda na uskutočňovanie procesu medzifázovej distribúcie látok. Typicky sa chromatografické metódy zvažujú oddelene od iných separačných metód založených na rozdieloch v distribúcii látok medzi fázami. Početné definície chromatografie, navrhnuté v priebehu rokov, zdôrazňujú, že chromatografia je separačná metóda alebo proces vedúci k separácii látok. Nie je tu žiadny rozpor. Historicky vznikla chromatografia ako separačná metóda, ktorej podstatou bolo oddelenie zón jednotlivých látok pri prechode roztoku obsahujúceho ich zmes cez vrstvu pevného sorbentu. Keď uvažujeme o fyzikálno-chemických javoch, ktoré spôsobujú toto „rozpúšťanie“, je prirodzené hovoriť o chromatografii ako o procese prebiehajúcom v dvojfázovom systéme. Keď hovoríme o súbore metodických techník aplikovaných na takmer akýkoľvek dvojfázový systém, ktoré umožňujú výrazne zvýšiť separačné koeficienty dosiahnuté pri jedinej rovnovážnej distribúcii látok medzi fázami, môžeme povedať, že chromatografia je spôsob prenosu proces medzifázovej separácie. Chromatografia ako metóda uskutočňovania medzifázového procesu spočíva v relatívnom pohybe fáz v obmedzenom priestore za podmienok, keď jedna z nich je neustále v dispergovanom stave alebo vo forme filmu na povrchu stien ohraničujúcich tento priestor. K tomuto pohybu dochádza v stĺpci, v kapiláre, v tenkej vrstve. Jedna z fáz môže byť stacionárna alebo obe budú v pohybe. V každom prípade chromatografická metóda poskytuje viacnásobnú sekvenčnú redistribúciu látok medzi navzájom sa pohybujúce fázy, čo vedie k rozdielom v rýchlostiach pohybu zón jednotlivých látok v separačnom priestore a v prípade súčasného pohybu oboch fáz v rôznych smeroch na rozdiely v smere pohybu zón. A samotnou separačnou metódou bude aplikácia jedného z možných prejavov chromatografickej metódy implementácie procesu medzifázovej distribúcie na konkrétny dvojfázový systém. Navrhovaná interpretácia pojmu „chromatografia“ sa zdá byť nevyhnutná pre pochopenie všeobecnosti metód chromatografickej separácie, ktoré sú základom najbežnejších chromatografických metód analýzy súčasnosti. Záujem o chromatografické metódy je determinovaný predovšetkým tým, že teoreticky nemajú žiadne obmedzenia na separačné koeficienty látok, bez ohľadu na to, aké malé rozdiely v distribučných koeficientoch pre ne môžu byť. Toto je kvalitatívny skok, ktorý pochádza z prechodu od metód založených na jedinom rovnovážnom rozdelení k chromatografickým. V metódach separácie látok založených na rozdieloch v medzifázovej distribúcii vždy existujú obmedzenia prenosu hmoty. Z jednej fázy do druhej nemôže prejsť viac látok, ako vyplýva z distribučného koeficientu, ktorého hodnota spravidla klesá so zvyšujúcim sa množstvom látky vo fázovom systéme. Prechod na viacstupňové a chromatografické metódy umožňuje zlepšenie separácie, no zavádza ešte prísnejšie obmedzenia na množstvo látok, ktoré sa majú separovať. Pre chromatografické metódy sa teda nevyhnutnou podmienkou stáva nezávislosť koeficientu KD od koncentrácie, teda požiadavka na linearitu izotermy medzifázového rozdelenia. Preto na riešenie problémov, ktoré vyžadujú zvýšenie prenosu hmoty bez zvýšenia objemu separačnej fázy, je najsľubnejšia skupina metód založená na indukovanom medzifázovom prenose hmoty. Hovoríme o procesoch, v ktorých sa separácia uskutočňuje pod vplyvom neustále pôsobiacej hnacej sily. Vo všeobecnosti realizačná schéma takýchto procesov zahŕňa prenos látky z jednej fázy do druhej cez tretiu fázu, ktorá ich oddeľuje. čo je prepážka, membrána. Odtiaľ pochádza názov tejto skupiny separačných metód – membránové metódy. V konkrétnom prípade sú známe pokusy realizovať indukovaný prenos v rámci dvojfázového systému - proces elektrickej extrakcie. Ale keďže metóda nie je široko používaná a jej mechanizmus je opísaný v jednej z etáp všeobecnej schémy procesu extrakčnej membrány, nezaslúži si osobitnú pozornosť. Klasifikácia podľa typu membrány je poctou histórii vývoja membránových metód, pretože ich vznik bol vo väčšine prípadov iniciovaný vytvorením selektívne priepustných materiálov. Až v posledných rokoch sa prejavuje trend cieleného hľadania membrán, ktoré spĺňajú požiadavky konkrétnej metódy membránovej separácie. Na základe definície metód membránovej separácie ako procesov indikovaného prenosu látky z jednej fázy do druhej prostredníctvom tretej fázy, ktorá ich oddeľuje, sa za ich hlavné klasifikačné znaky považujú trónny systém fáz a hnacia sila procesu (tabuľka 3). Keďže hlavnou výhodou membránovej schémy na uskutočnenie separačného procesu je zvýšenie prestupu hmoty látky cez separačnú fázu, membránové metódy prirodzene spadajú predovšetkým do sféry záujmu chemickej technológie. Našlo sa však už množstvo zaujímavých oblastí aplikácie membránových metód v chemickej analýze, ale nemožno vylúčiť ani obojstranne obohacujúcu výmenu myšlienok medzi chemickou technológiou a analytickou chémiou v budúcnosti. Nakoniec zostáva možnosť separácie látok v dôsledku rozdielov vo vlastnostiach ich iónov, atómov alebo molekúl, prejavujúcich sa v rámci jedného homogénneho systému pod vplyvom elektrických, magnetických, gravitačných, tepelných polí alebo odstredivých síl. Zároveň nie je vylúčená možnosť fázových premien pri prechode východiskovej zmesi látok do stavu agregácie, v ktorej dochádza k separácii, alebo pri separácii frakcií jej jednotlivých zložiek. Separačný efekt sa dosahuje v dôsledku rôznych priestorových pohybov látok v rámci fázy, v ktorej dochádza k ich separácii. Rozdiely v rýchlosti priestorového pohybu iónov, atómov alebo molekúl sa prejavia v závislosti od ich hmotnosti, veľkosti, náboja, energie interakcie častíc s iónmi a molekulami tvoriacimi prostredie, v ktorom dochádza k separácii. Relatívna úloha určitých faktorov pri dosahovaní konečného separačného efektu zase závisí od charakteru síl, ktoré na ne pôsobia.Najzrejmejším prípadom je elektroforetická alebo, ako sa niekedy nazýva, elektromigračná separácia iónov v roztokoch v dôsledku rôzne rýchlosti ich pohybu v elektrickej vôli. Najdôležitejšími faktormi sú veľkosť a náboj iónu. Rozdiely v hmotnosti a náboji sú najvýraznejšie, keď sú ionizované častice vystavené zrýchľovaciemu elektrickému poľu a vychyľovaciemu magnetickému poľu. Tento spôsob ovplyvňovania systému je základom metódy separácie hmoty. Pri separácii pod vplyvom odstredivých síl – ultracentrifugácii – je určujúcim faktorom hmotnosť molekúl. Tabuľka 4. Metódy vnútrofázové separácie Súhrnný stav fáz, v ktorých dochádza k separácii Typ síl spôsobujúcich priestorový pohyb iónov, atómov alebo molekúl Elektrické pole Elektrické a magnetické pole Odstredivá sila alebo gravitačné pole Kvapalina Elektroforéza (elektromigácia) - ultracentrifugácia Plynová elektroforéza Hmotová separácia ultracentrifugácia V dôsledku toho môže byť ktorýkoľvek zo známych spôsobov intrafázovej separácie charakterizovaný agregačným stavom fázy, v ktorej dochádza k separácii, a typom síl spôsobujúcich priestorový pohyb iónov, atómov alebo molekúl. Metódy vnútrofázové separácie sa vo všeobecnosti vyznačujú komplexnými hardvérovými riešeniami a uskutočniteľnosť ich použitia v analytickej chémii je opodstatnená úmerne schopnostiam, ktoré iné metódy nemajú. Najjednoduchším technickým prevedením je metóda elektroforetickej (elektromigračnej) separácie iónov v roztoku, ktorá si zachováva určité oblasti použitia v analytickej chémii. Hmotnostná separácia ako separačná metóda je zaujímavá predovšetkým tým, že je základom jednej z najpoužívanejších metód chemickej analýzy - hmotnostnej spektrometrie. Tu došlo k ešte užšiemu spojeniu separačnej metódy a metód konečného stanovenia ako v prípade chromatografických metód analýzy. Pri popise hmotnostnej spektrometrickej metódy sa zvyčajne ani neuvádza, že ide o jednu z kombinovaných metód analýzy. Zložitosť zariadenia a vysoká spotreba energie pri metóde separácie hmoty sú kompenzované jeho univerzálnosťou a prakticky neobmedzenou separačnou kapacitou. Všeobecné charakteristiky koncentračných metód
Stanovenie mikronečistôt je naliehavou úlohou vzhľadom na zvýšené požiadavky na čistotu materiálov a potrebu analytického monitorovania životného prostredia. Na stanovenie stopových množstiev sa používajú iba metódy, ktoré umožňujú detekciu nečistôt s hmotnosťou 10 -7-10-8g a niekedy až 10 -14d) Najdôležitejšie sú fyzikálne metódy analýzy: atómová adsorpcia, neutrónová aktivácia, röntgenová fluorescencia a niektoré ďalšie. Hlavné úlohy pri určovaní makrokomponentov: 1.použitie veľmi malých porcií alebo objemov vzoriek s významným obsahom stanovovaných zložiek; 2.Analýza vzoriek veľkej hmotnosti alebo objemu na stanovenie obsahu stopových množstiev látok. Na vyriešenie prvého problému sú okrem uvedených fyzikálnych metód analýzy vhodné metódy ultramikroanalýzy vrátane ultramikrochemickej analýzy. Ide o súbor techník na používanie špeciálnych zariadení na prácu s ultramalými objemami roztokov. Na vyriešenie druhého problému sa ako predbežná operácia používa koncentrácia. Je potrebné v prípadoch, keď je potrebné zvýšiť koncentrácie mikrozložiek pre následnú analýzu alebo oddeliť stopové množstvá zložiek analytu od hlavných alebo iných mikrozložiek. Pri absolútnej koncentrácii sa mikrokomponenty prenesú z väčšieho objemu do menšieho. Ako vyplýva z definície, koncentrácia je vždy spojená so separáciou a redistribúciou látok do rôznych fáz, preto sa na zahusťovanie používajú všetky metódy vhodné na separáciu. Najbežnejšie metódy sú uvedené v tabuľke. 5. pri výbere metódy koncentrácie sa riadia povahou objektu a jeho chemickým zložením, následným spôsobom rozboru, trvaním všetkých operácií, dostupnosťou všetkých potrebných zariadení atď. Tabuľka 5. Koncentračné metódy pre stopovú analýzu Metóda Charakteristika a výhody Nevýhody Extrakcia Umožňuje koncentrovať ako nečistoty skupiny látok, tak aj jednotlivé látky. Metóda je univerzálna, jednoducho navrhovateľná; Použitie drahých činidiel; Spoluzrážanie Umožňuje koncentráciu látok; Dlhotrvajúci, menej univerzálny, nízka selektivita; Iónomeničová chromatografia; Používa sa na výmenu hlavnej zložky zmesi za H +(OH -) alebo na zahusťovanie mikrokomponentov z veľkých objemov roztokov. Úplná separácia je dosiahnutá pri nízkych hodnotách distribučných koeficientov. Selektivita je nízka, straty a kontaminácia sú možné v dôsledku sorpčných procesov, proces je náročný na prácu Destilácia Používa sa na koncentrovanie vysoko prchavých nečistôt s ich kondenzáciou na malom povrchu. Nevyžaduje ďalšie činidlá a rozpúšťadlá Aplikácia je obmedzená na určité triedy látok.
Koprecipitácia ako koncentračná metóda
V poslednej dobe sa koprecipitácia, jedna z najúčinnejších a dlhodobo známych metód na koncentrovanie stopových množstiev rôznych prvkov, stala obzvlášť dôležitou pre analytické účely. Koprecipitácia je typ distribúcie, t.j. distribúcie mikrozložky spôsobenej uvoľnením zásobníka do tuhej fázy. Inými slovami, predstavuje súčasný prechod mikro- na makrokomponenty v tvoriacej sa pevnej fáze zásobníka. Koprecipitácia zahŕňa zachytávanie nečistôt počas rastu častíc kolektora (vnášaných do systému ako novovzniknuté). Počas Ostwaldovho zrenia sedimentu, ako aj pri štruktúrnom a morfologickom zlepšení častíc tuhej fázy. Ako kolektory sa používajú hydroxidy kovov (železo, hliník a pod.), sulfidy (CdS, HgS), fosforečnany (Ca3(PO4)2 atď.), sírany (BaSO4 atď.) a iné anorganické zlúčeniny. Existujú dve široké triedy znečistenia: Koprecipitácia, kedy sa hlavná látka a nečistota ukladajú spolu. Skutočnosť, že dve látky sa zrážajú súčasne, neznamená koprecipitáciu. Ak sa teda napríklad stopy hydroxidu berýlia kvantitatívne vyzrážajú veľkým množstvom hydroxidu hlinitého v podmienkach, keď sú oba nerozpustné, teda z ich nasýtených roztokov, potom by sa malo hovoriť o spoluzrážaní, a nie o koprecipitácii ( zrážanie konjugátu); Post-depozícia je prechod nečistôt do sedimentu nie počas jeho tvorby, ale po ňom. Najprv sa uvoľní čistá hlavná zrazenina a potom nečistota. Post-precipitácia sa zvyčajne vyskytuje v presýtenom roztoku. Stopy zinku (II), india sa tak pri dlhodobom kontakte ich roztokov so zrazeninou sulfidov kovov menia na zrazeninu. Keď sa nanáša jedna tuhá fáza, rozlišujú sa tieto prípady koprecipitácie: Tvorba chemickej zlúčeniny. Hrubé zloženie tuhej fázy sa líši od zloženia každej z jej zložiek, ale miestne zloženie je rovnaké. Tvorba tuhého roztoku. Zmena hrubého zloženia tuhej fázy so zmenou koncentrácie zložiek vo východiskovej zmesi indikuje tvorbu tuhého roztoku. Pevná fáza, ktorá je výsledkom tohto typu koprecipitácie, sa niekedy nazýva zlúčenina rôzneho zloženia. K tvorbe tuhých roztokov dochádza v dôsledku molekulárnych procesov, ktoré možno považovať za kvázichemické výmenné alebo adičné reakcie. Všeobecnosť molekulárneho mechanizmu tvorby je dôležitým argumentom v prospech spojenia všetkých prípadov koprecipitácie s tvorbou tuhých roztokov v jednej podtriede. Táto podtrieda môže byť rozdelená do dvoch typov v závislosti od toho, či je tuhý roztok kryštalický alebo amorfný. Súbežné zrážanie s tvorbou kryštalickej tuhej fázy sa zvyčajne nazýva spoločná kryštalizácia. Tvorba tuhej fázy s nečistotou oddelenou na defektoch. Hrubé zloženie tuhej fázy v tomto prípade závisí od zloženia počiatočnej zmesi a miestne zloženie nie je rovnaké. Existujú dva typy segregácie: A) Pri ich raste prechádzajú do objemu častíc sedimentu pri ich raste iba makrozložky východiskovej zmesi alebo produkty ich interakcie a mikrozložka je rastúcimi časticami vytláčaná nabok, hromadiaca sa v blízkosti fázového rozhrania (episegregácia). Tento typ je spojený so zachytávaním nečistôt povrchom rastúcich častíc sedimentu; b) mikrokomponent je lokalizovaný v objeme tuhej fázy (endosegregácia), v blízkosti dislokácií (dislokačná endosegregácia), na interkryštalických hraniciach (interkryštalická endosegregácia) alebo sa nachádza v izolovaných inklúziách maternicového média (okluzívna endosegregácia). Pri koprecipitácii za účasti viacerých pevných fáz sa rozlišuje koprecipitácia za účasti oddeliteľných a neoddeliteľných pevných fáz. Ak proces koprecipitácie prebieha buď iba na povrchu tuhej fázy, alebo aj vo vnútri, potom sa rozlišujú dva typy koprecipitácie: adsorpcia - ukladanie nečistôt na povrch častíc; oklúzia - ukladanie nečistoty v primárnych časticiach prostredníctvom akéhokoľvek možného mechanizmu. Fenomén koprecipitácie je široko používaný v analytickej chémii ako jednoduchý a účinný spôsob extrakcie stopových prvkov z vysoko zriedených roztokov, v ktorých sa nedosiahne produkt rozpustnosti zrazeniny. Záver Metódy separácie a koncentrácie sa zvyknú vnímať ako niečo, čo dopĺňa analytickú chémiu, rozširuje jej možnosti, ale nie ako jej základnú jadro. Na druhej strane, ako už bolo uvedené v úvode, jeden z dvoch hlavných smerov vo vývoji analytickej chémie je a priori zameraný na obmedzenú kombináciu metód separácie a stanovenia látok v objektoch analýzy. Bibliografia
1.Moskvin L.N., Tsaritsina L.G. Metódy separácie a koncentrácie v analytickej chémii. - L., „Chémia“, 1991. - 256 s. 2.Skorokhod O.R. Chemická analýza: Základy metód na zahusťovanie a oddeľovanie látok. - Mn., "Vydavateľstvo BSU", 1980. - 272 s. .Posypaiko V.I. a iné Chemické metódy analýzy: Učebnica. manuál pre chemických technológov. univerzity / Posypaiko V.I., Kozyreva N.A., Logacheva Yu.P. - M., „Vyššie. škola“, 1989. - 448 s.Podobné práce ako - Metódy separácie a koncentrácie pri analýze prvkov
Separačné a koncentračné metódy sa používajú na oddelenie zložitých viaczložkových zmesí, izoláciu zložky analytu zo zmesi a zvýšenie koncentrácie analyzovanej zložky vo vzorke. Tieto metódy zahŕňajú: extrakciu, separáciu a koncentráciu zrážaním, odparovaním, spopolňovaním a zónovým tavením. Tieto metódy sú správnejšie klasifikované ako fyzikálno-chemické metódy, pretože sú založené na takých vlastnostiach látok, ako je rozpustnosť, prchavosť, topenie, kryštalizácia.
Potreba oddelenia a koncentrácie pri vykonávaní odborného výskumu môže byť spôsobená najmä týmito faktormi:
- koncentrácia stanovovanej zložky je pod detekčným limitom metódy;
- testovaná vzorka obsahuje zložky, ktoré rušia stanovenie.
Extrakcia - proces extrakcie jednotlivých zložiek komplexnej zmesi pomocou rozpúšťadla. Pri práci s pevnými vzorkami (jemne mletým práškom) sa využívajú rôzne rozpustnosti jednotlivých zložiek zmesi a pri extrakcii z roztoku rôzne rozloženia zložiek zmesi v dvoch nemiešateľných kvapalinách.
Tieto metódy sa široko používajú pri štúdiu forenzných predmetov, a to ako na predbežný výskum, tak na prípravu na následnú analýzu takých predmetov, ako sú písacie potreby, papier, farby a laky, strelný prach, vlákna, identifikačné značky, polymérne materiály, drogy a lieky, ropa. produkty a palivá a mazivá, pôdy a minerály.
Zrážky. Spôsoby izolácie a koncentrácie precipitáciou - založené na izolácii zložiek zo zmesi vo forme ťažko rozpustnej zlúčeniny alebo koprecipitácii na ťažko rozpustnej zrazenine anorganickej, organickej alebo zmiešanej zlúčeniny.
Odparovanie je proces oddeľovania a čistenia látok, pri ktorom kvapalná alebo tuhá látka po zahriatí prechádza do plynného skupenstva (vyparuje sa zo zmesi) a potom po ochladení kondenzuje, pričom opäť vytvára kvapalnú alebo niekedy tuhú fázu.
Existujú metódy: destilácia, frakčné odparovanie (destilácia), sublimácia.
Destilácia alebo jednoduché odparovanie – jednostupňový proces oddeľovania a koncentrovania látok.
Destilácia alebo frakčné odparovanie na základe rozdielnej prchavosti látok. K separácii a koncentrácii zložiek zmesi dochádza v dôsledku rozdielu ich teplôt varu a vyparovania jednotlivých zložiek pri rôznych teplotách v rôznych časoch.
Sublimácia (sublimácia) – Ide o prechod látky z pevného do plynného skupenstva a jeho následné vyzrážanie v tuhej forme (obchádzanie kvapalnej fázy). Na sublimáciu mikromnožstiev látok sa často používa metóda „studeného prsta“, pri ktorej sa stopová zložka kondenzuje na chladenej tyčinke umiestnenej vo vnútri uzavretej nádoby priamo nad zohriatou vzorkou; v prípade potreby sa systém evakuuje
Spôsoby spopolňovania– ide o koncentračné metódy, pri ktorých dochádza k mineralizácii predmetov analýzy – organických a organokovových zlúčenín, živočíšnych a rastlinných materiálov, pôd pre následnú elementárnu analýzu.
Používajú sa na prípravu predmetov na kriminalistickú technickú expertízu dokumentov, forenznú biologickú expertízu, skúmanie látok, materiálov a výrobkov z nich vyrobených, na elementárnu analýzu chemickými a spektrálnymi metódami. Papier rovnakého druhu je možné odlíšiť farbou zvyškov popola a približným určením typu plniva. Mineralizácia liečiv sa používa na približné stanovenie liečivej látky podľa druhu zvyškov popola.
Zónové tavenie je metóda čistenia tuhých žiaruvzdorných látok, založená na redistribúcii zložiek zmesi v tavenine (medzi kontaktom roztavenej kvapalnej a pevnej fázy).
Podmienkou použitia metódy zónového tavenia je tepelná stabilita látky pri teplote tavenia a jej schopnosť kryštalizovať. Neprítomnosť rozpúšťadiel počas procesu čistenia prakticky eliminuje stratu látky, ktorá je možná v dôsledku jej neúplného oddelenia z roztoku.
Elektrochemické separačné metódy sú založené na izolácii analytu na inertnej elektróde v elementárnom stave alebo vo forme nerozpustnej zrazeniny, ktorá sa vyzráža pri prechode jednosmerného elektrického prúdu cez analyzovaný roztok.
Teória a prax elektrochemických separačných metód je podrobne popísaná v kap. VI.
V súčasnosti sa na separáciu zlúčenín väčšiny chemických prvkov používajú elektrochemické metódy, ktoré sa ukázali ako veľmi vhodné, pretože nevyžadujú vnášanie cudzích látok do analyzovaného roztoku. Rôznymi metódami elektrochemického vylučovania pomocou platinových alebo iných elektród a ortuťovej katódy, ako aj vnútornou elektrolýzou (pozri kapitolu VI, § 5) je možné oddeliť katióny hliníka, titánu, zirkónu, vanádu, uránu od katiónov chrómu. , železo, kobalt, nikel, zinok, meď, striebro, kadmium, germánium, molybdén, cín, bizmut a ďalšie prvky. Pri analýze neželezných kovov, ich zliatin a rúd je tiež možné oddeliť nečistoty od hlavných zložiek.
Separácia komplexnej zmesi pozostávajúcej z rôznych elektrolyticky nanesených iónov sa dosiahne buď výberom vhodného elektrolytu alebo uskutočnením elektrolýzy s automatickým riadením elektródového potenciálu, pri ktorom sa elektrolytické nanášanie uskutočňuje.
Depozícia na ortuťovej katóde. Špeciálny druh! elektrolytická separácia je nanášanie na ortuťovú katódu. V tomto prípade sa kovy pod vplyvom elektrického prúdu uvoľňujú na ortuť za vzniku amalgámov. Výsledkom je, že k izolácii a separácii mnohých kovov dochádza rýchlo a kvantitatívne. Niektoré kovy (napríklad ), ktoré sa neuvoľňujú na pevnej katóde, sa kvantitatívne uvoľňujú počas elektrolýzy na ortuťovej katóde. Na ortuťovej katóde sa však neukladá množstvo kovov (napríklad).
Elektrolýza s ortuťovou katódou sa vykonáva v špeciálnych zariadeniach (obr. 95). Na tento účel sa do nádoby, v ktorej sa uskutočňuje elektrolýza, pridá asi 200 g kovovej ortuti, naleje sa analyzovaný roztok a uskutoční sa elektrolýza pri prúdovej hustote asi 2,5 g. Anóda je zosilnená na povrchu roztoku. Počas procesu elektrolýzy sa ortuť mieša. Na konci elektrolýzy by mala vzorka roztoku negatívne reagovať na oddelené prvky.
Bez prerušenia prúdu sa roztok vypustí z ortuti a ortuť sa premyje vodou. Premývacia voda sa pridá do hlavného roztoku. Výsledný roztok bez prvkov izolovaných na ortuťovej katóde sa analyzuje. Ak je potrebné v ňom uložené kovy extrahovať z ortuti, amalgám sa rozpustí v kyselinách alebo sa ortuť oddestiluje.
Pomocou ortuťovej katódy môžete oddeliť:
a) hliník zo železa, zinku, medi;
b) titán z india, rénia, molybdénu, germánia;
c) vanád z molybdénu;
d) zlúčeniny fosforu a arzénu zo všetkých prvkov uvoľnených na ortuťovej katóde (železo, zinok, kobalt, nikel, chróm, striebro, meď, kadmium, ortuť, cín, platina, zlato atď.).
Napríklad metóda na kvantitatívne stanovenie hliníka v prítomnosti iónov železa a iných prvkov, založená na separácii železa elektrolýzou na ortuťovej katóde, je nasledovná. Najprv sa železo izoluje z roztoku síranu na ortuťovej katóde; spolu so železom sa uvoľňujú ďalšie prvky: zinok, chróm, nikel, kobalt atď.V roztoku zostávajú ióny hliníka, berýlia, titánu, fosforu atď.. Potom sa obvyklým spôsobom stanovia ióny hliníka, ktoré sa vyzrážajú z filtrátu s hydroxychinolínom alebo kupferónovým amoniakom alebo roztokom slabej kyseliny octovej. Titán sa vyzráža v kyslom roztoku s cupferónom.
Elektrochemické metódy možno použiť nielen na separáciu a izoláciu prvkov, ale aj na zahusťovanie analytov.
Tento druh koncentrácie (akumulácie) prvku stanovovaného na stacionárnej kvapke ortuti prebieha metódou amalgámovej polarografie. Podstata metódy spočíva v tom, že elektrolýzou sa určitý čas pri potenciáli medzného prúdu stanovovaného kovu koncentruje vo forme amalgámu zo zriedeného roztoku na stacionárnu kvapku ortuti, ktorá pôsobí ako ortuť. mikroelektróda. Potom sa pri lineárne sa meniacom napätí zaznamená anodická krivka rozpúšťania amalgámu. V tomto prípade sa na polarograme získajú anodické píky, ktorých poloha podľa potenciálu charakterizuje povahu látky a výška píku - koncentrácia nečistoty.
Metódu navrhol Barker a študovali Shein, Kemulya, A. G. Stromberg, E. N. Vinogradova, L. N. Vasilyeva, S. I. Sinyakova a ďalší Veľkú teoretickú a praktickú hodnotu pre amalgámovú polarografiu s predbežnou koncentráciou (akumuláciou) na Stacionárnu kvapku ortuti predstavuje práce M. T. Kozlovského v oblasti výskumu kovových amalgámov.

Ryža. 95. Ortuťová katóda.
Kombinácia elektrochemickej koncentrácie prvkov stanovovanej na stacionárnej kvapke ortuti s následnou anodickou polarizáciou vzniknutého amalgámu umožňuje zvýšiť citlivosť metódy o niekoľko rádov oproti klasickej polarografickej metóde. To má veľký praktický význam pre analýzu vysoko čistých kovov, chemických činidiel a polovodičových materiálov.
Existuje niekoľko možností koncentrácie mikronečistôt pomocou elektrochemickej (polarografickej) metódy. Ich všeobecným princípom je akumulácia determinovaných prvkov predbežnou elektrolýzou na stacionárnej elektróde.
Na účely elektrochemickej predkoncentrácie boli vyvinuté techniky amalgámovej polarografie na stanovenie nečistôt v zinku, hliníku, indiu, cíne, arzéne, gáliu, uránových soliach, chemicky čistých činidlách, biologických predmetoch, potravinách atď.
Odoslanie dobrej práce do databázy znalostí je jednoduché. Použite nižšie uvedený formulár
Študenti, postgraduálni študenti, mladí vedci, ktorí pri štúdiu a práci využívajú vedomostnú základňu, vám budú veľmi vďační.
1. Separačné a koncentračné metódy
Všeobecné informácie o separácii a koncentrácii
Separácia je operácia, ktorá umožňuje oddeliť zložky vzorky od seba.
Používa sa, ak niektoré zložky vzorky interferujú s určením alebo detekciou iných, t. j. keď analytická metóda nie je dostatočne selektívna a je potrebné vyhnúť sa prekrývaniu analytických signálov. V tomto prípade sú koncentrácie separovaných látok zvyčajne blízke.
Koncentrácia je operácia, ktorá umožňuje zvýšiť koncentráciu mikrokomponentu vzhľadom na hlavné zložky vzorky (matrice).
Používa sa, ak je koncentrácia mikrozložky nižšia ako detekčný limit Cmin, t. j. keď analytická metóda nie je dostatočne citlivá. Koncentrácie zložiek sa však značne líšia. Koncentrácia sa často kombinuje s oddelením.
Druhy koncentrácie.
1. Absolútna: mikrozložka sa prenesie z veľkého objemu alebo veľkej hmotnosti vzorky (Vpr alebo mpr) do menšieho objemu alebo menšej hmotnosti koncentrátu (Vconc alebo mconc). V dôsledku toho sa koncentrácia mikrokomponentu zvyšuje n-krát:
kde n je stupeň koncentrácie.
Čím menší je objem koncentrátu, tým väčší je stupeň koncentrácie. Napríklad 50 mg katiónovej živice absorbovalo germánium z 20 1 vodovodnej vody, potom sa germánium desorbovalo 5 ml kyseliny. V dôsledku toho bol stupeň koncentrácie germánia:
2. Relatívna (obohatenie): mikrozložka sa oddelí od makrozložky tak, že sa pomer ich koncentrácií zvýši. Napríklad v počiatočnej vzorke bol pomer koncentrácií mikro- a makrozložiek 1:1000 a po obohatení 1:10. Zvyčajne sa to dosiahne čiastočným odstránením matrice.
Separácia a koncentrácia majú veľa spoločného, na tieto účely sa používajú rovnaké metódy. Sú veľmi rôznorodé. Ďalej budú uvažované metódy separácie a koncentrácie, ktoré majú najväčší význam v analytickej chémii.
Klasifikácia separačných a koncentračných metód
Existuje mnoho klasifikácií separačných a koncentračných metód založených na rôznych charakteristikách. Pozrime sa na najdôležitejšie z nich.
1. Klasifikácia podľa charakteru procesu je uvedená na obr.
Ryža. 1 Klasifikácia separačných metód podľa charakteru procesu
Chemické metódy separácie a koncentrácie sú založené na výskyte chemickej reakcie, ktorá je sprevádzaná zrážaním produktu a uvoľňovaním plynu. Napríklad v organickej analýze je hlavnou metódou koncentrácie destilácia: počas tepelného rozkladu sa matrica oddestiluje vo forme CO2, H2O, N2 a v zostávajúcom popole možno určiť kovy.
Fyzikálnochemické metódy separácie a koncentrácie sú najčastejšie založené na selektívnej distribúcii látky medzi dve fázy. Napríklad v petrochemickom priemysle má chromatografia najväčší význam.
Fyzikálne metódy separácie a koncentrácie sú najčastejšie založené na zmene stavu agregácie látky.
2. Klasifikácia podľa fyzikálnej povahy dvoch fáz. Distribúcia látky sa môže uskutočniť medzi fázami, ktoré sú v rovnakom alebo rôznom stave agregácie: plynná (G), kvapalina (L), pevná látka (S). V súlade s tým sa rozlišujú nasledujúce metódy (obr.).
Ryža. 2 Klasifikácia separačných metód podľa charakteru fáz
V analytickej chémii majú najväčší význam metódy separácie a koncentrácie, ktoré sú založené na distribúcii látky medzi kvapalnú a pevnú fázu.
3. Klasifikácia podľa počtu elementárnych aktov (stupňov).
§ Jednostupňové metódy – založené na jedinej distribúcii látky medzi dve fázy. Separácia prebieha za statických podmienok.
§ Viacstupňové metódy – založené na viacnásobnej distribúcii látky medzi dve fázy. Existujú dve skupiny viacstupňových metód:
– opakovanie procesu jedinej distribúcie (napríklad opakovaná extrakcia). Separácia prebieha za statických podmienok;
– metódy založené na pohybe jednej fázy voči druhej (napríklad chromatografia). Separácia prebieha za dynamických podmienok
3. Klasifikácia podľa typu rovnováhy (obr.).
Ryža. 3 Klasifikácia separačných metód podľa typu rovnováhy
Termodynamické separačné metódy sú založené na rozdieloch v správaní látok v rovnovážnom stave. Najväčší význam majú v analytickej chémii.
Metódy kinetickej separácie sú založené na rozdieloch v správaní látok počas procesu vedúceho k rovnovážnemu stavu. Napríklad v biochemickom výskume má najväčší význam elektroforéza. Iné kinetické metódy sa používajú na separáciu častíc koloidných roztokov a roztokov zlúčenín s vysokou molekulovou hmotnosťou. V analytickej chémii sa tieto metódy používajú menej často.
Chromatografické metódy sú založené na termodynamickej aj kinetickej rovnováhe. Majú veľký význam v analytickej chémii, pretože umožňujú separáciu a súčasnú kvalitatívnu a kvantitatívnu analýzu viaczložkových zmesí.
Extrakcia ako metóda separácie a koncentrácie
Extrakcia je metóda separácie a koncentrácie založená na distribúcii látky medzi dve nemiešateľné kvapalné fázy (najčastejšie vodnú a organickú).
Na účely extrakčnej separácie sú vytvorené také podmienky, že jedna zložka úplne prejde do organickej fázy a druhá zostane vo vodnej fáze. Fázy sa potom oddelia pomocou oddeľovacieho lievika.
Za účelom absolútnej koncentrácie sa látka prenáša z väčšieho objemu vodného roztoku do menšieho objemu organickej fázy, v dôsledku čoho sa zvyšuje koncentrácia látky v organickom extrakte.
Za účelom relatívnej koncentrácie sú vytvorené podmienky, aby mikrozložka prešla do organickej fázy a väčšina makrozložky zostala vo vodnej fáze. V dôsledku toho sa v organickom extrakte zvyšuje pomer koncentrácií mikro- a makrozložiek v prospech mikrozložky.
Výhody extrakcie:
§ vysoká selektivita;
§ jednoduchosť implementácie (potrebný je len oddeľovací lievik);
§ nízka pracovná náročnosť;
§ rýchlosť (3-5 min);
§ extrakcia sa veľmi dobre kombinuje s metódami následného stanovenia, v dôsledku čoho vzniklo množstvo významných hybridných metód (extrakčne-fotometrická, extrakčno-spektrálna atď.).
Koprecipitácia ako metóda separácie a koncentrácie
Koprecipitácia je zachytenie mikrozložky zberačom sedimentov pri jeho vzniku a mikrozložka prechádza do sedimentu z nenasýteného roztoku (PS< ПР).
Ako kolektory sa používajú anorganické a organické zle rozpustné zlúčeniny s vyvinutým povrchom. Fázová separácia sa uskutočňuje filtráciou.
Súbežné zrážanie sa používa na tieto účely:
§ koncentrácia nečistôt ako veľmi účinná a jedna z najdôležitejších metód, ktorá umožňuje zvýšiť koncentráciu 10-20 tisíckrát;
§ odlučovanie nečistôt (menej často).
Sorpcia ako metóda separácie a koncentrácie
Sorpcia je absorpcia plynov alebo rozpustených látok pevnými alebo kvapalnými sorbentmi.
Ako sorbenty sa používajú aktívne uhlie, Al2O3, oxid kremičitý, zeolity, celulóza, prírodné a syntetické sorbenty s ionogénnymi a chelatačnými skupinami.
K absorpcii látok môže dôjsť na povrchu fázy (adsorpcia) alebo v objeme fázy (absorpcia). V analytickej chémii sa adsorpcia najčastejšie používa na účely:
§ separácia látok, ak sú vytvorené podmienky pre selektívnu absorpciu;
§ sústredenie (menej často).
Okrem toho je sorpcia v dynamických podmienkach základom pre najdôležitejšiu metódu separácie a analýzy - chromatografiu.
Výmena iónov
Výmena iónov je reverzibilný stechiometrický proces, ktorý sa vyskytuje na rozhraní medzi ionitom a roztokom elektrolytu.
Iónomeniče sú vysokomolekulárne polyelektrolyty rôznych štruktúr a zložení. koncentračný chemický sorpčný plyn
Hlavnou vlastnosťou iónomeničov je, že absorbujú katióny alebo anióny z roztoku, pričom do roztoku uvoľňujú ekvivalentný počet iónov s rovnakým znamienkom náboja.
Proces výmeny iónov je opísaný zákonom hromadného pôsobenia:
kde A a B sú ióny v roztoku a sú ióny vo fáze iónomeniča.
Táto rovnováha je charakterizovaná výmennou konštantou (K):
kde a je aktivita iónov.
Ak K > 1, potom má ión B väčšiu afinitu k iónomeniču; ak K< 1, то ион А обладает бульшим сродством к иониту; если же К? 1, то оба иона одинаково сорбируются ионитом.
Nasledujúce faktory ovplyvňujú priebeh iónovej výmeny:
1) povaha iónomeniča;
2) povaha iónu: čím väčší je pomer iónového náboja k polomeru hydratovaného iónu (z/r), tým väčšia je afinita k iónomeniču;
3) vlastnosti roztoku:
§ hodnota pH (pozri nasledujúce časti);
§ koncentrácia iónov: zo zriedených roztokov iónomenič sorbuje ióny s väčším nábojom a z koncentrovaných roztokov - s menším;
§ iónová sila roztoku: čím menšie m, tým lepšie sa ióny sorbujú.
Typy iónomeničov
Existuje veľké množstvo rôznych iónomeničov. Sú klasifikované podľa pôvodu a znaku náboja vymieňajúcich iónov.
V závislosti od pôvodu sa rozlišujú dve skupiny
iónomeniče:
1. Prírodné iónomeniče:
§ anorganické (íly, zeolity, apatity);
§ organické (celulóza).
2. Syntetické iónomeniče:
§ anorganické (permutity);
§ organické (materiály s vysokou molekulovou hmotnosťou).
V analytickej chémii sa najčastejšie používajú syntetické organické iónomeniče.
V závislosti od znamienka náboja výmenných iónov sa iónomeniče nazývajú takto:
1. Katiónomeniče - výmenné katióny, obsahujú kyslé skupiny:
§ -SO3H (silne kyslé katexy, výmena prebieha v širokom rozmedzí hodnôt pH);
§ -PO3H2 (stredne kyslé katexy, k výmene dochádza pri pH > 4);
§ -COOH, -OH (slabé kyslé katexy, výmena nastáva pri pH > 5).
2. Aniónomeniče - výmenné anióny, obsahujú základné skupiny:
§ kvartérne alkylamóniové skupiny (vysoko zásadité aniónomeniče, výmena prebieha v širokom rozmedzí hodnôt pH);
§ aminoskupiny a iminoskupiny (stredne a nízko zásadité aniónomeniče, k výmene dochádza pri pH< 8-9).
3. Amfolyty – vymieňajú si katióny aj anióny v závislosti od podmienok. Majú oba typy skupín - kyslé a zásadité.
Štruktúra syntetických organických iónomeničov. Reakcie výmeny iónov
Syntetické organické iónomeniče majú trojrozmernú štruktúru reťazca. Pozostávajú z matrice s vysokou molekulovou hmotnosťou (HM), v ktorej sú fixované ionogénne skupiny.
Napríklad pre vysoko zásaditý aniónový menič v chloridovej forme R-N(CH3)3Cl
Zloženie iónomeniča
|
stacionárny HM ión |
mobilný NM ión |
||
|
fixovaný ión |
protiión |
||
|
iónová skupina |
Matrica je zvyčajne kopolymér styrénu a divinylbenzénu (DVB), čo je sieťovacie činidlo: každá z jeho molekúl, ako mostík, spája 2 susedné lineárne polystyrénové reťazce.
Mobilné ióny s nízkou molekulovou hmotnosťou (LM), ktoré sú súčasťou ionogénnych skupín, sa podieľajú na výmene iónov.
Napríklad katexová reakcia zahŕňajúca silne kyslý katex vo vodíkovej forme je napísaná takto:
a aniónovo výmenná reakcia zahŕňajúca vysoko zásaditý aniónový menič vo forme chloridu
Základné fyzikálne a chemické vlastnosti iónomeničov
Ionity ako materiály majú mnoho fyzikálno-chemických a fyzikálno-mechanických vlastností. Z nich tri hlavné fyzikálne a chemické vlastnosti sú pre analytického chemika najdôležitejšie - vlhkosť, napučiavanie a výmenná kapacita.
Vlhkosť (W, %) charakterizuje schopnosť iónomeniča absorbovať vlhkosť zo vzduchu. Dá sa vypočítať na základe experimentálnych údajov:
kde mo a m sú hmotnosť iónomeniča pred a po sušení.
Typicky je vlhkosť iónomeničov v rozsahu 10-15%.
Napučiavanie charakterizuje stupeň zväčšenia objemu iónomeniča pri kontakte s vodou alebo iným rozpúšťadlom. Množstvo napučiavania závisí od stupňa zosieťovania vysokomolekulárnej iónomeničovej matrice (% DVB). V dôsledku opuchu dochádza k rýchlej výmene iónov. Dôvodom opuchu je prítomnosť polárnych ionogénnych skupín schopných hydratácie alebo solvatácie. Výmenná kapacita (EC) je najdôležitejšou kvantitatívnou charakteristikou iónomeniča. Charakterizuje schopnosť iónomeniča k iónovej výmene. Celková výmenná kapacita (TEC) daného iónomeniča je konštantná hodnota a je určená počtom fixovaných iónov v matrici iónomeniča. Závisí to od nasledujúcich faktorov: charakter iónomeniča;
§ hodnota pH roztoku;
§ definičné podmienky (statické alebo dynamické);
§ povaha vymeneného iónu;
§ polomer iónov (efekt sita).
Kapacita výmeny hmoty ukazuje, koľko milimolových ekvivalentov iónu - n(1/z ión) - dokáže vymeniť 1 gram suchého iónomeniča. Vypočíta sa pomocou vzorca:
Objemová výmenná kapacita ukazuje, koľko milimolových ekvivalentov iónu - n(1/z ión) - dokáže vymeniť 1 mililiter napučaného iónomeniča. Vypočíta sa pomocou vzorca:
V závislosti od podmienok určenia sa rozlišuje medzi statickou (SOE) a dynamickou (DOE) výmennou kapacitou a čo SOE? LAŇ.
Typy dynamickej výmennej kapacity:
§ pred prienikom absorbovaného iónu alebo pracovného (DOE) ukazuje, koľko iónov môže iónomenič absorbovať predtým, ako sa objavia v eluáte (prienik);
§ celkový (PDOE) - ukazuje, koľko iónov môže iónomenič absorbovať, kým sa ionogénne skupiny za daných podmienok úplne nenasýtia.
Rozdiel medzi hodnotami DOE a PDOE je znázornený na obrázku:
Uverejnené na http://www.allbest.ru/
Ryža. 4 Celková dynamická výmenná kapacita (TDEC) a kapacita pred prielomom (DEC)
Aplikácia iónomeničov v analytickej chémii
Iónomeniče sa v analytickej praxi používajú na riešenie nasledujúcich problémov.
§ Separácia látok. Iónová výmena je pohodlný a účinný spôsob oddeľovania látok. Napríklad s jeho pomocou je možné oddeliť párne prvky s podobnými chemickými vlastnosťami, ako sú lantanoidy.
§ Koncentrácia látok. Najprv sa veľký objem zriedeného roztoku nechá prejsť kolónou obsahujúcou iónomeničovú živicu. Potom sa sorbované ióny vymyjú z kolóny minimálnym množstvom vhodného eluentu.
§ Stanovenie „nepohodlných“ katiónov a aniónov. Často je potrebné analyzovať obsah takzvaných „nepohodlných“ iónov. Takéto ióny nemajú chemické analytické vlastnosti, ktoré by umožňovali ich ľahké stanovenie pomocou chemických alebo inštrumentálnych metód analýzy. Z katiónov sem patria ióny alkalických kovov (Na+, K+, atď.), aniónov - , atď. Stanovenie „nepohodlných“ katiónov je založené na prvom prechode vzorky cez kolónu s katexom vo vodíkovej forme a následná titrácia alkáliou:
Stanovenie „nevhodných“ aniónov je založené na predbežnom prechode vzorky cez kolónu s meničom aniónov vo forme hydroxidu a následnej titrácii uvoľnenej zásady kyselinou:
§ Získavanie deionizovanej vody. Voda sa postupne vedie cez kolónu s katexovou živicou vo vodíkovej forme a potom cez kolónu s aniónomeničovou živicou vo forme hydroxidu. V dôsledku toho sú všetky katióny a anióny zadržané iónomeničmi a získava sa voda, ktorá neobsahuje ióny.
Chromatografické metódy analýzy
Chromatografickú metódu analýzy prvýkrát použil ruský botanik M. S. Tsvet na analýzu chlorofylu. Názov metódy pochádza z gréckeho slova „chromatos“ - farba, hoci metóda vám umožňuje oddeliť akékoľvek zlúčeniny vrátane nezafarbených.
V súčasnosti je chromatografia jednou z najsľubnejších metód analýzy. Je široko používaný v rôznych priemyselných odvetviach a vedeckom výskume na analýzu zmesí plynných, kvapalných a pevných látok.
V petrochemickom a plynárenskom priemysle tvorí chromatografia 90 % všetkých vykonaných analýz. Plynová chromatografia sa používa v biológii a medicíne, drevospracujúcej technike, lesnej chémii a potravinárstve a ďalších oblastiach. Približne 30 % environmentálnych monitorovacích analýz (znečistenie ovzdušia, analýza odpadových vôd atď.) sa vykonáva pomocou metód plynovej chromatografie.
Podstata chromatografických metód analýzy
Chromatografia je dynamická metóda na separáciu a stanovenie látok, založená na viacnásobnom rozdelení zložiek medzi dve fázy – mobilnú a stacionárnu.
Látka vstupuje do vrstvy sorbentu spolu s prúdom mobilnej fázy. V tomto prípade sa látka sorbuje a potom sa pri kontakte s čerstvými časťami mobilnej fázy desorbuje. Pohyb mobilnej fázy prebieha nepretržite, takže k sorpcii a desorpcii látky dochádza nepretržite. V tomto prípade je časť látky v stacionárnej fáze v sorbovanom stave a časť je v mobilnej fáze a pohybuje sa s ňou. V dôsledku toho je rýchlosť pohybu látky menšia ako rýchlosť pohybu mobilnej fázy. Čím viac je látka sorbovaná, tým pomalšie sa pohybuje.
Ak sa chromatografuje zmes látok, potom je rýchlosť pohybu každej z nich odlišná v dôsledku rôznych afinit k sorbentu, v dôsledku čoho sa látky separujú: niektoré zložky sa oneskorujú na začiatku cesty, iné sa pohybujú ďalej.
Klasifikácia chromatografických metód analýzy
Chromatografické metódy analýzy sú také rozmanité, že neexistuje žiadna ich jednotná klasifikácia. Najčastejšie sa používa niekoľko klasifikácií, ktoré sú založené na nasledujúcich charakteristikách:
§ stav agregácie mobilnej a stacionárnej fázy;
§ mechanizmus interakcie látky so sorbentom;
§ technika analýzy (spôsob navrhovania procesu);
§ chromatografická metóda (metóda pohybu látky cez kolónu);
§ účel chromatografie.
Podľa stavu agregácie fáz sa rozlišuje plynová chromatografia (mobilná fáza - plyn alebo para) a kvapalinová chromatografia (mobilná fáza - kvapalina).
Podľa mechanizmu interakcie látky so sorbentom sa rozlišujú tieto typy chromatografie: adsorpcia, distribúcia, iónová výmena, sedimentácia, redox, komplexovanie atď.
IN závislosti od spôsobom registrácia proces odlíšiť stĺpovitý A rovinný chromatografia. IN stĺpovitý chromatografia proces oddelenie viesť V stĺpce, naplnené sorbent. Rovinný chromatografia zahŕňa V ja dva odrody: chromatografia na papier A tenká vrstva chromatografia na záznamy.
IN závislosti od spôsobom chromatografia odlíšiť nasledujúce druhy chromatografia:
§ eluent (vývoj) chromatografia;
§ represívne chromatografia;
§ čelné chromatografia.
Častejšie Vo všeobecnosti sa používa vývojová metóda chromatografie. Spočíva v tom, že sa do kontinuálneho toku mobilnej fázy (eluentu) zavádza zmes látok, ktoré sa lepšie sorbujú ako eluent. Keď sa eluent pohybuje kolónou so sorbovanými látkami, tieto sa pohybujú pozdĺž vrstvy sorbentu rôznymi rýchlosťami a nakoniec ju opúšťajú v oddelených zónach oddelených eluentom.
Podľa účelu chromatografického procesu sa rozlišujú: analytická chromatografia - nezávislá metóda separácie, kvalitatívna a kvantitatívna analýza látok; preparatívna chromatografia na izoláciu čistých látok zo zmesi.
Plynová chromatografia
Metóda plynovej chromatografie sa stala najrozšírenejšou, pretože jej teória a vybavenie boli najviac vyvinuté.
Plynová chromatografia je hybridná metóda, ktorá umožňuje súčasnú separáciu a stanovenie zložiek zmesi.
Ako mobilná fáza (nosný plyn) sa používajú plyny, ich zmesi alebo zlúčeniny, ktoré sú v podmienkach separácie v plynnom alebo parnom stave.
Ako stacionárna fáza sa používajú pevné sorbenty (plynová adsorpčná chromatografia) alebo kvapalina nanášaná v tenkej vrstve na povrch inertného nosiča (plynová kvapalinová chromatografia).
Výhody analytickej plynovej chromatografie:
§ schopnosť identifikovať a kvantifikovať jednotlivé zložky komplexných zmesí;
§ vysoká jasnosť oddelenia a expresivity;
§ schopnosť študovať mikrovzorky a automaticky zaznamenávať výsledky;
§ schopnosť analyzovať širokú škálu objektov – od ľahkých plynov až po vysokomolekulárne organické zlúčeniny;
Hlavné teoretické prístupy
Úlohou teórie chromatografie je stanoviť zákonitosti pohybu a rozmazania chromatografických zón. Najčastejšie sa na to používajú tieto prístupy:
§ teória teoretických platní;
§ kinetická teória.
Teória teoretických dosiek je založená na predpoklade, že stĺp je rozdelený na malé úseky - dosky. Ide o úzke vrstvy kolóny, v ktorých sa nastolí rovnováha v distribúcii látky medzi mobilnú a stacionárnu fázu.
Kinetická teória spája účinnosť separácie s procesmi difúzie látky v kolóne v dôsledku pohybu prúdu nosného plynu. Keď sa látka pohybuje pozdĺž kolóny, je buď v mobilnej fáze, alebo v stacionárnej fáze, t.j. chromatografický proces je stupňovitý. Čas, ktorý látka strávi v oboch fázach, určuje rýchlosť jej pohybu kolónou.
Parametre chromatografického vrcholu
Ryža. 5 Chromatogram zmesi troch látok
1. Retenčný čas (tR) je čas od okamihu vloženia analyzovanej vzorky do zaznamenania maxima chromatografického píku. Závisí od povahy látky a je kvalitatívnou charakteristikou.
2. Výška (h) alebo plocha (S) píku
S = ½ h. (4)
Výška a plocha píku závisí od množstva látky a ide o kvantitatívne charakteristiky.
Retenčný čas pozostáva z dvoch zložiek – z doby zotrvania látok v mobilnej fáze (tm) a z doby zotrvania v stacionárnej fáze (ts):
Schematický diagram plynového chromatografu a účel hlavných komponentov
Zariadenie 3 na vstrekovanie vzorky umožňuje zaviesť určité množstvo analyzovanej zmesi v plynnom stave do prúdu nosného plynu bezprostredne pred kolónou. Súčasťou je výparník a dávkovacie zariadenie.
Prúd nosného plynu zavedie analyzovanú vzorku do kolóny 5, kde sa zmes rozdelí na jednotlivé zložky.
Ryža. 6 Bloková schéma plynového chromatografu: 1 - valec s nosným plynom; 2 - jednotka na prípravu plynu; 3 - zariadenie na vstrekovanie vzoriek; 4 - termostat; 5 - chromatografická kolóna; 6 - detektor; 7 - zosilňovač; 8 - záznamník
Tie sa v zmesi s nosným plynom privádzajú do detektora 6, ktorý premieňa zodpovedajúce zmeny fyzikálnych alebo fyzikálno-chemických vlastností zmesi zložiek - nosného plynu v porovnaní s čistým nosným plynom na elektrický signál. Detektor s príslušným napájaním tvorí detekčný systém.
Požadované teplotné podmienky výparníka, kolóny a detektora sa dosiahnu ich umiestnením do zodpovedajúcich termostatov 4, riadených termostatom. Ak je potrebné počas analýzy zvýšiť teplotu kolóny, použite teplotný programátor. Termostaty a termostat s programátorom tvoria termostatický systém, ktorého súčasťou je aj zariadenie na meranie teploty.
Signál detektora, konvertovaný zosilňovačom 7, je zaznamenaný vo forme chromatogramu zapisovačom 8.
Často je v obvode zahrnutý elektronický integrátor alebo počítač na spracovanie údajov.
Podmienky pre chromatografickú analýzu
Pri chromatografickej analýze je potrebné zvoliť optimálne podmienky na separáciu analyzovaných zložiek. Spravidla sa pri ich určovaní riadia údajmi z literatúry. Na základe nich sa experimentálne vyberú:
§ stacionárna fáza v plyne a kvapaline alebo adsorbent v plynovej adsorpčnej chromatografii;
§ pevný inertný nosič v plyno-kvapalinovej chromatografii;
§ nosný plyn;
§ spotreba nosného plynu;
§ objem vzorky;
§ teplota kolóny.
Kvalitatívna analýza
Základné metódy identifikácie látok:
1. Metóda značky
Prvá verzia metódy je založená na skutočnosti, že za rovnakých podmienok sa experimentálne stanovujú a porovnávajú retenčné časy referenčnej (označenej) a analyzovanej látky. Rovnosť retenčných parametrov umožňuje identifikáciu látky.
Druhá verzia metódy označovania spočíva v tom, že referenčná zložka (etiketa), ktorej prítomnosť sa predpokladá v zmesi, sa zavedie do analyzovanej zmesi. Zvýšenie výšky zodpovedajúceho píku v porovnaní s výškou píku pred pridaním aditíva indikuje prítomnosť tejto zlúčeniny v zmesi.
2. Použitie literárnych hodnôt retenčných parametrov.
Kvantitatívna analýza
Kvantitatívna analýza je založená na závislosti plochy píku od množstva látky (v niektorých prípadoch sa používa výška píku).
Existujú rôzne spôsoby, ako určiť oblasť vrcholu:
§ podľa vzorca ako plocha trojuholníka;
§ pomocou planimetra;
§ váženie vyrezaných píkov (píky v chromatograme sa skopírujú na rovnomerný papier, vystrihnú sa a odvážia);
§ pomocou elektronického integrátora;
§ pomocou počítača.
Presnosť kvantitatívnej chromatografickej analýzy je do značnej miery určená výberom najracionálnejšej metódy na výpočet koncentrácie látok. Hlavné metódy sú:
§ absolútna metóda kalibrácie,
§ metóda vnútornej normalizácie,
§ metóda vnútorného štandardu.
Metóda absolútnej kalibrácie
Podstatou metódy je, že známe množstvá štandardnej látky sa zavedú do chromatografickej kolóny a stanovia sa plochy píkov.
Na základe získaných údajov sa zostrojí kalibračný graf. Potom sa analyzovaná zmes chromatografuje a obsah tejto zložky sa stanoví podľa grafu.
Na výpočet týchto koeficientov sa stanovia plochy píkov aspoň 10 štandardných zmesí s rôznym obsahom danej látky i. Potom použite vzorec.
ki = shi q / (S 100),
kde ki je absolútny korekčný faktor i-tej látky; ui je obsah i-tej zložky v štandardnej zmesi (%); S - oblasť vrcholu;
q je veľkosť vzorky (objem, cm3 - pre plyny, μL - pre kvapaliny alebo hmotnosť, μg - pre kvapaliny a tuhé látky).
Takto získané koeficienty sa spriemerujú. Potom sa testovaná zmes analyzuje a výsledok sa vypočíta pomocou vzorca
shi = ki S 100/q.
Metóda absolútnej kalibrácie je pomerne jednoduchá, ale nevyhnutnými podmienkami na jej použitie je presnosť a reprodukovateľnosť dávkovania vzorky, prísne dodržanie stálosti parametrov chromatografického režimu pri kalibrácii zariadenia a pri zisťovaní obsahu chromatografovanej látky.
Metóda absolútnej kalibrácie sa používa najmä pri určovaní jednej alebo viacerých zložiek zmesi, najmä pri použití chromatografu na reguláciu režimu technologického procesu na základe obsahu jednej alebo malého počtu látok vo výrobkoch. Táto metóda je hlavná na stanovenie stopových nečistôt.
Relatívne korekčné faktory
Vzhľadom na nízku presnosť dávkovania vzoriek bolo vyvinutých množstvo metód, pri ktorých sa veľkosť vzorky pri výpočtoch nepoužíva. Tieto metódy využívajú relatívne korekčné faktory. Zohľadňujú rozdiely v citlivosti použitého detektora na zložky analyzovanej vzorky a málo závisia od parametrov procesu. Zisťujú sa vopred pre každú zložku vzorky.
Na stanovenie relatívnych korekčných (kalibračných) koeficientov sa pripraví séria binárnych zmesí známeho zloženia a na základe výsledných chromatogramov sa vykonajú výpočty podľa vzorca
ki =(i /st)/(Si/Sst), (4)
Môžete použiť kalibračné zmesi z väčšieho počtu látok, presnosť stanovenia sa však môže znížiť.
Relatívne korekčné faktory sa používajú v metódach vnútornej normalizácie, vnútorného štandardu atď.
Metóda vnútornej normalizácie
Podstatou metódy je, že súčet plôch píkov všetkých zložiek zmesi sa berie ako 100 %.
Nevyhnutnou podmienkou použitia metódy je registrácia všetkých zložiek (chromatogram obsahuje oddelené píky všetkých zložiek zmesi).
Koncentrácia i-tej zložky sa vypočíta pomocou vzorca
i = ki Si 100/ У(ki Si).
Pri výpočte korekčných faktorov pomocou vzorca (4) pre túto metódu možno jednu zo zlúčenín obsiahnutých v skúmanej zmesi vybrať ako štandard. Kalibračný faktor pre štandardnú látku sa rovná 1.
Metóda vnútorného štandardu
Podstatou metódy je, že do analyzovanej zmesi sa zavedie určité množstvo štandardnej látky (porovnávacej látky).
i = ki Si 100 r/Sst..
kde ki je relatívny korekčný faktor i-tej zložky vypočítaný podľa vzorca (4); Si a sv. - plochy píkov i-tej zložky a vnútorného štandardu; r je pomer hmotnosti vnútorného štandardu k hmotnosti analyzovanej zmesi (bez štandardu): r = mst./mzmes.
Požiadavky na látku používanú ako vnútorný štandard:
§ nemal by byť súčasťou testovanej zmesi;
§ musí byť inertný voči zložkám analyzovanej zmesi a musí byť s nimi úplne miešateľný;
§ Pík štandardu musí byť dobre rozlíšený a umiestnený v tesnej blízkosti píkov stanovovaných zlúčenín.
Vnútorný štandard je vybraný zo zlúčenín, ktoré majú podobnú štruktúru a fyzikálno-chemické vlastnosti ako zložky analyzovanej zmesi. Relatívne korekčné faktory pre zložky zmesi sa určujú vo vzťahu k vnútornému štandardu.
Metóda sa používa tak, keď sú na chromatograme zaznamenané všetky zložky analyzovanej zmesi, ako aj v prípade neúplne identifikovaných zmesí. Hlavná ťažkosť spočíva vo výbere a presnom dávkovaní štandardnej látky.
Uverejnené na Allbest.ru
...Podobné dokumenty
Rozbor metód separácie látok ako súboru chemických a fyzikálnych procesov, ktoré sú pre ne charakteristické a spôsoby ich realizácie: extrakcia, membrána, intrafáza. Koprecipitácia je metóda koncentrácie stopových množstiev rôznych prvkov.
kurzová práca, pridané 16.10.2011
Všeobecné prístupy k syntéze technologických separačných schém. Viacrozmerná organizácia technologického separačného procesu. Metódy syntézy technologických separačných schém. Integrálno-hypotetická metóda. Produkty separácie. Chlórbenzén a dichlórbenzény.
práca, pridané 01.04.2009
Metódy kvalitatívnej analýzy látok. Magnetická separácia železa a síry a syntéza sulfidu železa. Flotácia, filtrácia a odparovanie zmesí. Využitie chromatografie ako metódy separácie a čistenia látok. Fyzikálne a chemické metódy analýzy.
abstrakt, pridaný 15.02.2016
Všeobecné prístupy k syntéze technologických separačných schém. Viacrozmerná organizácia technologického separačného procesu. Kritériá optimalizácie. Metódy syntézy technologických separačných schém. Metódy syntézy založené na heuristických pravidlách.
práca, pridané 01.04.2009
Fyzikálno-chemické vlastnosti kobaltu. Komplexné zlúčeniny zinku. Štúdium sorpčnej koncentrácie Co v prítomnosti zinku z chloridových roztokov v iónomeničovom zariadení. Technický výsledok, ktorý sa dosiahol pri realizácii vynálezu.
abstrakt, pridaný 14.10.2014
Sorbenty imobilizované látkami sú novou triedou účinných sorbentov. 8-hydroxychinolín a jeho analytické aplikácie. Chelatačné sorbenty s 8-hydroxychinolínovými skupinami. Štúdium koncentrácie Cu na aniónomeniči AV-17 a jej výsledky.
kurzová práca, pridané 27.09.2010
Chromatografickú metódu na separáciu a analýzu zložitých zmesí objavil ruský botanik M.S. Farba. Chromatografia je opakované opakovanie aktov sorpcie a desorpcie látky, keď sa pohybuje v toku mobilnej fázy pozdĺž stacionárneho sorbentu.
kurzová práca, pridané 13.03.2011
Spôsoby oddeľovania azeotropických a zeotropných zmesí. Azeotropická a heteroazeotropická rektifikácia. Extraktívna rektifikácia. Metódy syntézy technologických separačných schém. Niektoré vlastnosti, toxické účinky, príprava a použitie komponentov.
práca, pridané 01.04.2009
Rovnica chemickej reakcie metódou elektrón-ión. Stanovenie potenciálov okysličovadla a reduktora, smer procesu, termodynamické charakteristiky H, S, G. Elektronický vzorec prvkov o 2 a 4 kvantových číslach.
kurzová práca, pridané 25.11.2009
Tepelný účinok chemickej reakcie alebo zmena entalpie systému v dôsledku výskytu chemickej reakcie. Vplyv vonkajších podmienok na chemickú rovnováhu. Vplyv tlaku, koncentrácie a teploty na rovnovážnu polohu. Typy chemických väzieb.