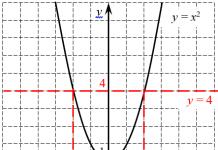
sistema de apoyo estatal
unidad de medida
TÍTULOS ESTÁNDAR PARA COCINAR
SOLUCIONES TAMPÓN -
NORMAS DE TRABAJO pH 2do y 3ª ALTA
Características técnicas y metrológicas
Métodos para su determinación.
|
Moscú |
Prefacio
Se establecen los objetivos, principios básicos y procedimiento básico para la realización de trabajos de normalización interestatal. GOST 1.0-92“Sistema interestatal de normalización. Disposiciones Básicas” y GOST 1.2-97“Sistema interestatal de normalización. Estándares interestatales, reglas y recomendaciones para la estandarización interestatal. La orden de desarrollo, adopción, aplicación, actualización y cancelación”
Sobre el estándar
1 DESARROLLADO por la Empresa Unitaria del Estado Federal "Instituto de Investigación de Mediciones de Ingeniería Física, Técnica y de Radio de Rusia" (FSUE "VNIIFTRI") de la Agencia Federal de Regulación Técnica y Metrología
2 INTRODUCIDO por la Agencia Federal de Regulación Técnica y Metrología
3 ADOPTADO por el Consejo Interestatal de Normalización, Metrología y Certificación (Acta No. 26 del 8 de diciembre de 2004)
|
Nombre abreviado del país según MK (ISO 3166) 004-97 |
Código de país según MK (ISO 3166) 004-97 |
Nombre abreviado del organismo nacional de normalización |
|
Azerbaiyán |
Estándar az |
|
|
Bielorrusia |
Estándar estatal de la República de Bielorrusia |
|
|
Kazajstán |
Estándar estatal de la República de Kazajstán |
|
|
Kirguistán |
Estándar kirguís |
|
|
Moldavia |
Moldavia-estándar |
|
|
La Federación Rusa |
agencia Federal para regulación técnica y metrología |
|
|
Tayikistán |
Estándar tayiko |
|
|
Uzbekistán |
Uzestándar |
4 Orden de la Agencia Federal de Regulación Técnica y Metrología del 15 de abril de 2005 No. 84-st estándar interestatal GOST 8.135-2004 entró en vigor directamente como norma nacional Federación Rusa desde el 1 de agosto de 2005
6 REVISIÓN. diciembre de 2007
La información sobre la entrada en vigor (terminación) de esta norma y sus modificaciones se publica en el índice "Estándares nacionales".
La información sobre los cambios a este estándar se publica en el índice (catálogo) "Estándares nacionales", y el texto de los cambios, en carteles informativos "Normas nacionales". En caso de revisión o cancelación de esta norma, la información pertinente se publicará en el índice de información "Normas Nacionales"
ESTÁNDAR INTERESTATAL
Fecha de introducción - 2005-08-01
1 área de uso
Esta norma se aplica a los títulos patrón, que son pesajes exactos de sustancias químicas en viales o ampollas, destinados a la preparación de soluciones tampón con determinados valores de pH, y establece características técnicas y metrológicas y métodos para su determinación.
2 Referencias normativas
Este estándar utiliza Referencias normativas a los siguientes estándares:
3.4 Los títulos estándar se realizan con cantidades pesadas de los productos químicos necesarios para la preparación de 0,25; Solución tampón 0,50 y 1 dm 3 . La masa nominal de una muestra de la sustancia requerida para preparar 1 dm 3 de una solución tampón se da en la tabla.
tabla 1
|
Sustancias químicas incluidas en el título estándar |
Peso nominal de la muestra m nombre incluido en el título estándar, para la preparación de 1 dm 3 de solución tampón 1, g |
Valor de pH nominal de la solución tampón a 25 °C 2) |
|
|
× 2H 2 O |
25,219 |
1,48 |
|
|
Tetraoxalato de potasio 2-agua KH 3 (C 2 O 4) 2× 2H 2 O |
12,610 |
1,65 |
|
|
hidrodiglicolato de sodio C 4 H 5 O 5 Na |
7,868 |
3,49 |
|
|
Hidrotartrato de potasio KNS 4 H 4 C 6 |
9,5 3) |
3,56 |
|
|
Hidroftalato de potasio KNS 8 H 4 O 4 |
10,120 |
4,01 |
|
|
Ácido acético CH 3 COOH Acetato de sodio CH 3 COONa |
6,010 8,000 |
4,64 |
|
|
Ácido acético CH 3 COOH Acetato de sodio CH 3 COONa |
0,600 0,820 |
4,71 |
|
|
Fosfato de piperazina C 4 H 10 N 2 H 3 PO 4 |
4,027 |
6,26 |
|
|
Fosfato de monohidrógeno de sodio Na2HPO4 |
3,3880 3,5330 |
6,86 |
|
|
Fosfato dihidrógeno de potasio KH 2 RO 4 Fosfato de monohidrógeno de sodio Na2HPO4 |
1,1790 4,3030 |
7,41 |
|
|
Fosfato dihidrógeno de potasio KH 2 RO 4 Fosfato de monohidrógeno de sodio Na2HPO4 |
1,3560 5,6564 |
7,43 |
|
|
Tris 4) (HOCH 2 ) 3 CNH 2 Tris 4) clorhidrato (HOCH 2) 3 CNH2HCl |
2,019 7,350 |
7,65 |
|
|
Tetraborato de sodio 10-acuoso Na 2 B 4 O 7 × 10H 2 O |
3,8064 |
9,18 |
|
|
Tetraborato de sodio 10-acuoso Na 2 B 4 O 7 × 10H 2 O |
19,012 |
9,18 |
|
|
carbonato de sodio Na2CO3 Ácido de carbonato de sodio NaHCO3 |
2,6428 2,0947 |
10,00 |
|
|
Hidróxido de calcio Ca (OH) 2 |
1,75 3) |
12,43 |
|
|
1) Para preparar una solución tampón con un volumen de 0,50 y 0,25 dm 3 , la masa de una muestra de la sustancia debe reducirse por un factor de 2 y 4, respectivamente. 2) La dependencia de los valores de pH de las soluciones tampón con la temperatura se indica en el apéndice. . 3) Muestra para preparar una solución saturada. 4) Tris-(hidroximetil)-aminometano. |
|||
3.5 Los pesos de las sustancias pesadas en títulos estándar deben corresponder a valores nominales con una tolerancia de no más del 0,2%. Los pesos de las sustancias pesadas en títulos estándar para la preparación de soluciones saturadas de hidrotartrato de potasio e hidróxido de calcio deben corresponder a los valores nominales con una tolerancia de no más del 1%.
3.6 Las soluciones tampón preparadas a partir de títulos estándar deben reproducir los valores de pH nominales que figuran en la tabla.
Las desviaciones permisibles del valor de pH nominal no deben ir más allá de:
± 0,01 pH - para soluciones tampón - patrones de trabajo de pH de la 2ª categoría;
± 0,03 pH - para soluciones tampón - patrones de trabajo de pH de la 3ª categoría.
3.7 Se permite producir títulos estándar en forma de porciones pesadas de polvos de productos químicos y en forma de sus soluciones acuosas (títulos estándar con ácido acético, solo en forma de soluciones acuosas), envasados en viales herméticamente sellados o sellados en ampollas de vidrio.
El agua destilada se utiliza para preparar soluciones acuosas. GOST 6709.
3.8 Requisitos para el envasado, embalaje, etiquetado y transporte de títulos estándar - según especificaciones para títulos estándar específicos.
3.9 La documentación operativa para títulos estándar debe contener la siguiente información:
Propósito: categoría (segunda o tercera) de estándares de pH de trabajo: soluciones tampón preparadas a partir de títulos estándar;
Valor de pH nominal de las soluciones tampón a 25 °С;
Volumen de soluciones amortiguadoras en decímetros cúbicos;
Metodología (instrucción) para la preparación de soluciones tampón a partir de títulos estándar, desarrollada de acuerdo con el apéndice de esta norma;
Título estándar de vida útil.
4 Métodos para caracterizar títulos estándar
4.1 Número de muestrasnortePara determinar las características de cada modificación, se seleccionan títulos estándar segúnGOST 3885 dependiendo del volumen del lote de títulos estándar de esta modificación, pero al menos tres muestras de títulos estándar en ampollas (para determinación de pH) y al menos seis muestras en viales (3 - para determinación de masa, 3 - para determinación de pH).
4.2 Los instrumentos de medición utilizados deben tener certificados de verificación (certificados) con un período de verificación válido.
4.3 Las mediciones se realizan en condiciones normales:
temperatura del aire ambiente, °С 20 ± 5;
humedad relativa del aire, % de 30 a 80;
presión atmosférica, kPa (mm Hg) de 84 a 106 (de 630 a 795).
4.4 El peso pesado del producto químico en el vial 1) se determina por la diferencia en el peso del vial pesado y el peso del vial vacío y limpio. Las mediciones del peso de la muestra y del peso del vial se realizan con un error de no más de 0,0005 g en una balanza analítica (clase de precisión no inferior a 2 según GOST 24104).
1) En una ampolla de vidrio, no se determina el peso de la muestra del título estándar.
4.4.1 Desviación D i,%, la masa de la muestra del valor nominal de la masa para cada una de las muestras está determinada por la fórmula
|
|
donde m nom- peso nominal de una muestra de una sustancia química que forma parte del título estándar (ver tabla);
i
yo- resultado de la medición de masai-ésima muestra ( i = 1 ... norte), GRAMO.
4.4.2 Si para al menos una de las muestras el valor D iserá más del 0,2% (y para títulos estándar para la preparación de soluciones tampón saturadas, más del 1%), entonces se rechaza el lote de títulos estándar de esta modificación.
4.5.1 El valor de pH de la solución tampón: el estándar de pH de trabajo de la 2ª categoría, preparado a partir del título estándar, se determina utilizando el estándar de pH de trabajo de la 1ª categoría ( GOST 8.120) a una temperatura de soluciones tampón (25 ± 0,5) °C de acuerdo con los métodos para realizar mediciones de pH incluidos en regulaciones patrón de trabajo de pH de la 1ª categoría.
4.5.1.1 Desviación del pH del valor nominal ( pH) i, determinado por la fórmula
|
(DpH) i= | pH nom - pH i | , |
donde i- número de muestra del título estándar;
pH nom - valor de pH nominal de la solución tampón según la tabla;
pH yo - Resultado de la medición del valor de pHi-ésima muestra ( i = 1 ... norte).
4.5.1.2 Si el valor ( pH) ipara cada una de las soluciones tampón no más de 0,01 pH, entonces los títulos estándar de este lote se consideran adecuados para la preparación de un estándar de trabajo de pH de la 2ª categoría.
Si valor (D pH ) ipara cada una de las soluciones tampón no más de 0,03 pH, entonces los títulos estándar de este lote se consideran adecuados para la preparación de un estándar de trabajo de pH de la 3ra categoría.
(DpH) i
4.5.4 El valor de pH de la solución tampón: el pH estándar de trabajo de la 3.ª categoría, preparado a partir del título estándar, está determinado por el medidor de pH de referencia de la 2.ª categoría ( GOST 8.120) de acuerdo con el manual de instrucciones del medidor de pH a una temperatura de soluciones tampón (25 ± 0,5) °C.
4.5.2.1 Desviación del pH del valor nominal ( pH) i determinado por .
4.5.2.2 Si el valor ( pH) ipara cada una de las soluciones tampón no más de 0,03 pH, entonces los títulos estándar de este lote se consideran adecuados para la preparación de un estándar de trabajo de pH de la 3ra categoría.
Si para al menos una de las soluciones amortiguadoras(DpH) iserá más de 0,03 pH, entonces las mediciones se repiten en el doble de muestras.
Los resultados de las mediciones repetidas son definitivos. Si los resultados son negativos, se rechaza el lote de títulos estándar.
Anexo A
(obligatorio)
Las sustancias químicas para títulos estándar se obtienen mediante purificación adicional de reactivos químicos con una calificación de al menos grado analítico. Los reactivos químicos de los grados o.p. y ch.p. se pueden utilizar sin purificación adicional. Sin embargo, el criterio último de su idoneidad para los títulos estándar es el valor de pH de las soluciones tampón preparadas a partir de los títulos estándar. Para purificar sustancias, es necesario utilizar agua destilada (en adelante, agua) con una conductividad eléctrica específica de no más de 5× 10 -4 cm × m -1 a una temperatura de 20°C según GOST 6709.
A.1 Tetraoxalato de potasio 2-agua KH 3 (C 2 O 4) 2× El 2H 2 O se purifica por doble recristalización a partir de soluciones acuosas a una temperatura de 50 °C. Secar en horno con ventilación natural a temperatura (55± 5) °С a masa constante.
A.2 Hidrodiglicolato de sodio (oxidiacetato) C 4 H 5 O 5 Na secado a 110°C hasta peso constante. Si no se dispone de un reactivo químico, se obtiene hidrodiglicolato de sodio mediante la semineutralización del ácido correspondiente con hidróxido de sodio. Después de la cristalización, los cristales se filtran en un filtro de vidrio poroso.
A.3 Hidrotartrato de potasio (tartrato de potasio) KNS 4 H 4 O 6 se purifica por doble recristalización en soluciones acuosas; secado en horno a una temperatura (110± 5) °С a masa constante.
A.4 Hidroftalato de potasio (ácido de ftalato de potasio) El KNS 8 H 4 O 4 se purifica mediante doble recristalización en soluciones acuosas calientes con la adición de carbonato de potasio durante la primera recristalización. Los cristales precipitados se filtran a una temperatura no inferior a 36 °C. Secar en estufa con ventilación natural a una temperatura de (110± 5) °С a masa constante.
A.5 Ácido acético CH 3 COOH ( GOST 18270) se limpia de una de las siguientes maneras:
a) destilación con la adición de una pequeña cantidad de acetato de sodio anhidro;
b) congelación fraccionada doble (luego del final del proceso de cristalización, se elimina el exceso de la fase líquida).
A.6 Acetato de sodio 3-acuoso (acetato de sodio) CH 3 COONa × 3H2O ( GOST 199) se purifica por doble recristalización en soluciones acuosas calientes, seguido de calcinación de la sal a una temperatura de (120± 3) °С a masa constante.
A.7 Fosfato de piperazina C 4 H 10 N 2 H 3 PO 4 × El H 2 O se sintetiza a partir de piperazina y ácido fosfórico ( GOST 6552), purificado por triple recristalización en soluciones alcohólicas. Se seca sobre gel de sílice en la oscuridad en un desecador hasta peso constante.
A.8 Fosfato de potasio monosustituido (fosfato dihidrógeno de potasio) KH 2 PO 4 ( GOST 4198) se purifica por doble recristalización en una mezcla de agua y etanol con una relación volumétrica de 1:1 y posterior secado en estufa a una temperatura de (110± 5) °С a masa constante.
A.9 Fosfato de sodio disustituido 12-acuoso (monohidrogenofosfato de sodio) Na2HPO4 (anhidro) se obtiene a partir de 12-sal acuosa Na 2 HPO 4 × 12H 2 O ( GOST 4172) recristalización tres veces a partir de soluciones acuosas calientes. Secar (deshidratar) en estufa con ventilación natural por etapas en las siguientes modalidades:
En (30 ± 5) °С - hasta masa constante
A (50 ± 5) °С - » » »
A (120 ± 5)°С - » » »
A.10 Tris-(hidroximetil)-aminometano ( HOCH 2 ) 3 CNH 2 secado a 80°C en estufa hasta peso constante.
A.11 Clorhidrato de tris-(hidroximetil)-aminometano ( HOCH 2 ) 3 CNH 2 HCl secado a 40°C en estufa hasta peso constante.
A.12 Tetraborato de sodio 10-acuoso Na 2 B 4 O 7 × 10H 2 O ( GOST 4199) se purifica por triple recristalización en soluciones acuosas a una temperatura de (50± 5) ºC. Secar a temperatura ambiente durante dos o tres días. La preparación final del tetraborato de sodio se lleva a cabo manteniendo la sal en un vaso de vidrio de grafito (cuarzo, platino o fluoroplástico) en un desecador sobre una solución saturada de una mezcla de cloruro de sodio y sacarosa o una solución saturada KBr a temperatura ambiente hasta peso constante.
A.13 Carbonato de sodio Na 2CO3 (GOST 83) se purifica por triple recristalización en soluciones acuosas, seguido de secado en estufa a una temperatura de (275± 5) °С a masa constante.
A.14 Carbonato de sodio NaHCO3 (GOST 4201) se purifica por triple recristalización en soluciones acuosas con dióxido de carbono burbujeante.
A.15 El hidróxido de calcio Ca (OH) 2 se obtiene calcinando carbonato de calcio CaCO 3 ( GOST 4530) a una temperatura (1000± 10) ° C durante 1 hora.El óxido de calcio CaO resultante se enfría al aire a temperatura ambiente y lentamente, en pequeñas porciones, se vierte agua con agitación constante hasta obtener una suspensión. La suspensión se calienta hasta ebullición, se enfría y se filtra a través de un filtro de vidrio, luego se retira del filtro, se seca en un desecador al vacío hasta peso constante y se muele hasta obtener un polvo fino. Almacenado en un desecador.
Anexo B
(referencia)
|
Número de modificación del título estándar |
Sustancias químicas incluidas en el título estándar (modificaciones según tabla) |
pH de soluciones tampón a temperatura, °C |
|||||||||||||
|
Tetraoxalato de potasio 2-acuoso |
1,48 |
1,48 |
1,48 |
1,49 |
1,49 |
1,50 |
1,51 |
1,52 |
1,53 |
1,53 |
|||||
|
Tetraoxalato de potasio 2-acuoso |
1,64 |
1,64 |
1,64 |
1,65 |
1,65 |
1,65 |
1,65 |
1,65 |
1,66 |
1,67 |
1,69 |
1,72 |
|||
|
hidrodiglicolato de sodio |
3,47 |
3,47 |
3,48 |
3,48 |
3,49 |
3,50 |
3,52 |
3,53 |
3,56 |
3,60 |
|||||
|
hidrogenotartrato de potasio |
3,56 |
3,55 |
3,54 |
3,54 |
3,54 |
3,55 |
3,57 |
3,60 |
3,63 |
||||||
|
hidroftalato de potasio |
4,00 |
4,00 |
4,00 |
4,00 |
4,00 |
4,01 |
4,01 |
4,02 |
4,03 |
4,05 |
4,08 |
4,12 |
4,16 |
4,21 |
|
|
4,66 |
4,66 |
4,65 |
4,65 |
4,65 |
4,64 |
4,64 |
4,65 |
4,65 |
4,66 |
4,68 |
4,71 |
4,75 |
4,80 |
||
|
Ácido acético + acetato de sodio |
4,73 |
4,72 |
4,72 |
4,71 |
4,71 |
4,71 |
4,72 |
4,72 |
4,73 |
4,74 |
4,77 |
4,80 |
4,84 |
4,88 |
|
|
Fosfato de piperazina |
6,48 |
6,42 |
6,36 |
6,31 |
6,26 |
6,21 |
6,14 |
6,12 |
6,03 |
5,95 |
|||||
|
6,96 |
6,94 |
6,91 |
6,89 |
6,87 |
6,86 |
6,84 |
6,83 |
6,82 |
6,81 |
6,82 |
6,83 |
6,85 |
6,90 |
||
|
Monohidrogenofosfato de sodio + dihidrogenofosfato de potasio |
7,51 |
7,48 |
7,46 |
7,44 |
7,42 |
7,41 |
7,39 |
7,37 |
|||||||
|
Monohidrogenofosfato de sodio + dihidrogenofosfato de potasio |
7,51 |
7,49 |
7,47 |
7,45 |
7,43 |
7,41 |
7,40 |
||||||||
|
Clorhidrato de Tris + Tris |
8,40 |
8,24 |
8,08 |
7,93 |
7,79 |
7,65 |
7,51 |
7,33 |
7,26 |
7,02 |
6,79 |
||||
|
Tetraborato sódico |
9,48 |
9,41 |
9,35 |
9,29 |
9,23 |
9,18 |
9,13 |
9,07 |
9,05 |
8,98 |
8,93 |
8,90 |
8,88 |
8,84 |
|
|
Tetraborato sódico |
9,45 |
9,39 |
9,33 |
9,28 |
9,23 |
9,18 |
9,14 |
9,09 |
9,07 |
9,01 |
8,97 |
8,93 |
9,91 |
8,90 |
|
|
Carbonato de sodio agrio + carbonato de sodio |
10,27 |
10,21 |
10,15 |
10,10 |
10,05 |
10,00 |
9,95 |
9,89 |
9,87 |
9,80 |
9,75 |
9,73 |
9,73 |
9,75 |
|
|
hidróxido de calcio |
13,36 |
13,16 |
12,97 |
12,78 |
12,60 |
Nota - Para preparar soluciones con un valor de pH > 6, se debe hervir agua destilada y enfriarla a una temperatura de 25 - 30 °C. Al preparar la cristalería, no utilice detergentes sintéticos. B.1.1 El título estándar se transfiere a un matraz volumétrico de segunda clase de acuerdo con GOST 1770(en lo sucesivo, el matraz). B.1.2 Retire el vial (ampolla) del paquete. B.1.3 Enjuagar la superficie del vial (ampolla) con agua y secar con papel filtro. B.1.4 Insertar un embudo en el matraz, abrir el vial (ampolla) de acuerdo con las instrucciones del fabricante, permitir que el contenido se vierta por completo en el matraz, enjuagar el vial (ampolla) desde el interior con agua hasta eliminar completamente la sustancia de las superficies, agua de lavado vertida en un matraz. B.1.5 Llene el matraz con agua hasta aproximadamente las dos terceras partes de su volumen, agítelo hasta que el contenido se disuelva por completo (excepto las soluciones saturadas de hidrogenotartrato de potasio e hidróxido de calcio). B.1.6 Llene el matraz con agua sin agregar agua hasta la marca de 5 - 10 cm 3. El matraz se termostatiza durante 30 minutos en un termostato de agua a una temperatura de 20 °C (los matraces con soluciones saturadas de hidrotartrato de potasio e hidróxido de calcio se llenan completamente con agua y se termostatizan durante al menos 4 horas a una temperatura de 25 °C y 20 °C, respectivamente, agitando periódicamente la suspensión en el matraz mediante agitación). B.1.7 Diluir el volumen de la solución en el matraz con agua hasta la marca, tapar y mezclar bien el contenido. En muestras tomadas de soluciones saturadas de hidrotartrato de potasio e hidróxido de calcio, el precipitado se elimina por filtración o decantación. EN 2 Almacenamiento de estándares de pH de trabajo B.2.1 Los estándares de pH de trabajo se almacenan en un recipiente de vidrio o plástico (polietileno) bien cerrado en un lugar oscuro a una temperatura que no exceda los 25 °C. La vida útil de los patrones de trabajo es de 1 mes desde el momento de la preparación, con excepción de las soluciones saturadas de hidrotartrato de potasio e hidróxido de calcio, que se preparan inmediatamente antes de medir el pH y que no están sujetas a almacenamiento. | |||||||||
Los objetivos del estudio del tema:
- resultados de la asignatura: el estudio de los conceptos de "disociación electrolítica", "grado disociación electrolítica”, “electrolito”, desarrollo de conocimientos sobre el valor de pH, desarrollo de habilidades en el trabajo con sustancias basadas en el cumplimiento de las normas de seguridad;
- resultados de metasujetos: la formación de habilidades para realizar un experimento utilizando equipos digitales(obtención de datos experimentales), procesamiento y presentación de los resultados;
- resultados personales: la formación de habilidades para realizar investigaciones educativas a partir de la puesta en marcha de un experimento de laboratorio.
La viabilidad de utilizar el proyecto "pH y temperatura".
1. El trabajo en el proyecto contribuye a la formación de interés en el estudio del tema teórico "Teoría de la disociación electrolítica", que es difícil para una edad determinada (13-14 años). EN este caso Mediante la determinación del pH, los alumnos establecen la relación entre el grado de disociación del ácido y la temperatura de la solución. Trabajar con una solución de soda es propedéutico en el grado 8 y le permite volver a los resultados del proyecto en el grado 9 ( actividades extracurriculares), Grado 11 ( curso general) al estudiar la hidrólisis de sales.
2. Disponibilidad de reactivos (ácido cítrico, bicarbonato de sodio) y equipo (en ausencia de sensores de pH digitales, se puede utilizar papel indicador) para la investigación.
3. La confiabilidad de la metodología experimental asegura el buen desarrollo del trabajo, garantizado contra interrupciones y fallas metodológicas.
4. Seguridad del experimento.
sección instrumental
Equipo:
1) sensor de pH digital o medidor de pH de laboratorio, papeles tornasol u otro indicador de acidez;
2) termómetro de alcohol (de 0 a 50 0С) o sensor de temperatura digital;
3) ácido cítrico (1 cucharadita);
4) bebiendo soda(1 cucharadita);
5) agua destilada (300 ml);
6) recipiente para un baño de agua (olla o recipiente de aluminio o esmalte), puede enfriar las soluciones con un chorro agua fría o nieve, y calentado con agua caliente;
7) vasos de precipitados químicos con tapa esmerilada con una capacidad de 50-100 ml (3 uds.).
Lección número 1. Formulación del problema
Plan de estudios:
1. Discusión de los conceptos "disociación electrolítica", "grado de disociación electrolítica", "electrolito".
2. Planteado del problema. Planificación de un experimento instrumental.
Contenido de la actividad
Actividad del profesor
1. Organiza una discusión de los conceptos de "disociación electrolítica", "grado de disociación electrolítica", "electrolito". Preguntas:
¿Qué son los electrolitos?
- ¿Cuál es el grado de disociación electrolítica?
- ¿Cuál es la forma de escribir la ecuación de disociación de electrolitos fuertes (por ejemplo, ácido sulfúrico, sulfato de aluminio) y débiles (por ejemplo, ácido acético)?
- ¿Cómo afecta la concentración de la solución al grado de disociación?
La respuesta se puede discutir usando el ejemplo de soluciones diluidas y concentradas de ácido acético. Si es posible determinar la conductividad eléctrica, es posible demostrar la diferente conductividad eléctrica de la esencia de vinagre y el vinagre de mesa.
Percibir nueva información sobre el tema Desarrollo de ideas sobre el grado de disociación, que se forman en lecciones de química Cognitivo
Evaluar la integridad de la comprensión del tema La capacidad de analizar la comprensión del problema Normativa
Actividad del profesor
2. Organiza la planificación y preparación del experimento instrumental:
- familiarización con la información del proyecto "pH y temperatura";
- discusión del propósito del proyecto, hipótesis;
- organización de grupos de trabajo (tres grupos);
- preparación del equipo
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
Perciben información sobre normas de seguridad al trabajar con ácidos (ácido cítrico) Desarrollan el concepto de la necesidad de cumplir con las normas de seguridad Cognitivas
Aclarar lo que queda incomprensible La capacidad de formular una pregunta sobre el tema Comunicativo
Evaluar la integridad de la comprensión de la metodología de trabajo en el proyecto Capacidad de analizar la comprensión del problema Normativa
Lección número 2. Realización de un experimento
Plan de estudios:
1. Preparación para el funcionamiento de sensores digitales de pH y temperatura.
2. Realización de un estudio de la dependencia del pH con la temperatura:
1er grupo: medición de pH de solución de ácido cítrico a 10 0С, 25 0С, 40 0С;
2do grupo: medir el pH de una solución de bicarbonato de sodio a 10 0С, 25 0С, 40 0С;
3er grupo: medición de pH de agua destilada a 10 0С, 25 0С, 40 0С.
3. Análisis primario de los resultados obtenidos. Rellenar los cuestionarios del proyecto GlobalLab.
Actividad del profesor
1. Organiza lugares de trabajo para cada grupo de estudiantes:
- explica cómo enfriar las soluciones y luego calentarlas gradualmente y tomar medidas de temperatura y pH;
- responde a las preguntas de los estudiantes
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
Percibir información según el método de trabajo Desarrollo de ideas sobre el funcionamiento de los sensores digitales Cognitivo
Aclarar lo que queda incomprensible La capacidad de formular una pregunta sobre el tema Comunicativo
Evaluar la integridad de la comprensión del trabajo en el proyecto La capacidad de analizar la comprensión del problema Normativa
Actividad del profesor
2. Organiza el trabajo de los alumnos en grupos. El profesor controla el progreso del trabajo en grupos, responde posibles preguntas de los estudiantes, supervisa la finalización de la tabla de resultados de investigación en el pizarrón.
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
1. Conecte los sensores digitales a la PC.
2. Preparar soluciones:
1er grupo - ácido cítrico;
2do grupo - bicarbonato de sodio;
3er grupo - agua destilada.
3. Enfriar las soluciones y medir el pH a 10°C.
4. Calentar gradualmente las soluciones y medir el pH a 25°C y 40°C.
5. Los resultados de la medición se ingresan en tabla general, que se dibuja en la pizarra (conveniente para la discusión) Formación de habilidades para realizar investigación instrumental Cognitivo
Trabajo en grupo Cooperación educativa en grupo Comunicativa
Trabajar sobre un problema común, evaluando el ritmo y la exhaustividad del trabajo realizado La capacidad de analizar sus acciones y ajustarlas en función de trabajo conjunto toda la clase Normativa
Actividad del profesor
3. Organiza el análisis primario de los resultados de la investigación. Organiza el trabajo de los alumnos para rellenar los cuestionarios del proyecto GlobalLab “pH y temperatura”
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
Familiarizarse con los resultados del trabajo de otros grupos Formación de ideas sobre la dependencia del pH de la temperatura Cognitivo
Hacer preguntas a representantes de otros grupos Cooperación educativa con compañeros de clase. Desarrollo discurso oral Comunicativo
Analizar los resultados del trabajo, llenar el cuestionario del proyecto Capacidad de analizar sus acciones y presentar los resultados de su trabajo Normativa
Lección número 3. Análisis y presentación de los resultados
Contenido de la actividad
1. Presentación de resultados: actuaciones de los alumnos.
2. Discusión de los hallazgos que son significativos para los participantes del proyecto que utilizan sensores de pH digitales.
Actividad del profesor
1. Organiza actuaciones de estudiantes. Admite altavoces. Hace una conclusión sobre el trabajo en el proyecto, agradece a todos los participantes
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
Presentar los resultados de sus actividades, escuchar los discursos de los compañeros Formación de ideas sobre la forma de presentación de los resultados del proyecto Cognitivo
Participar en la discusión de discursos Cooperación educativa con compañeros de clase. Desarrollo del habla oral Comunicativo
Analizar los resultados de su trabajo, comentar las declaraciones de los compañeros. La capacidad de analizar los resultados de sus actividades y el trabajo de otras personas. Normativa.
Actividad del profesor
2. Organiza una discusión sobre el tema, que se presenta en el proyecto “¿Cómo se comportará el pH de la solución si se enfría o se calienta? ¿Por qué los científicos intentan medir el pH a la misma temperatura y qué conclusión deberían sacar de esto los participantes del proyecto GlobalLab?
Organiza una discusión de los resultados confirmando o refutando la hipótesis del proyecto “Cuando cambia la temperatura de las soluciones, cambia la constante de disociación de los ácidos y álcalis disueltos y, en consecuencia, el valor del pH”
Acciones a tomar Métodos formados de actividad Actividades de los estudiantes
Discutir la relación entre el pH de la solución y la temperatura Desarrollo de ideas sobre el grado de disociación electrolítica Cognitivo
Expresar sus pensamientos sobre la hipótesis del proyecto y formular una conclusión Colaboración educativa con los compañeros. Desarrollo del habla oral Comunicativo
Evaluar la hipótesis del proyecto en base a los resultados obtenidos Capacidad para evaluar la hipótesis en base a los resultados ya obtenidos y formular una conclusión Normativa
En un momento, mi primer acuario marino fue una obra maestra. Era un acuario de vidrio de 20 galones, pegado adhesivo de silicona. El sistema de filtración consistió en filtros neumáticos de arena. Mi tarea era apoyar a dos de sus habitantes (Bew Gregory el pez damisela - Stegastes leucostictus- y anémonas de mar condilactis) lo más satisfecho posible (lo que, dada mi falta de experiencia y recursos limitados, significaba mantenerlos con vida). Una tarea difícil para un niño de 9 años, era 1964. Mi mentora, la Sra. Perry de Cobb Pets, me aconsejó que revisara Gravedad específica agua y pH. La gravedad específica fue bastante fácil (simplemente coloque un hidrómetro en el acuario y haga una marca en un cierto nivel al agregar agua dulce), pero con el pH todo fue algo más complicado. Este parámetro se probó agregando un líquido coloreado a la botella de muestra. agua de acuario. Como por arte de magia, se cambió el color de la muestra de agua y luego se comparó utilizando una tabla de comparación que consiste en una serie de cuadrados de colores. En mi primera prueba, necesitaba agregar bicarbonato de sodio para elevar el pH. Obedientemente, lo hice, sin cambios. Continué el proceso hasta haber agregado todo el paquete de bicarbonato de sodio.
Nunca sabré qué causó la muerte de mi pez y mi anémona, pero el incidente ocurrió inmediatamente después del episodio descrito. Además de que todo terminó muy triste para mis mascotas, la situación se volvió devastadora para mí. Todo mi trabajo, por el que cobraba un dólar a la semana, se fue a la basura. Para colmo, fui responsable de la muerte de los habitantes. Los enterré en la orilla cubierta de helechos del arroyo que fluía en nuestro patio. Ahora creo que el reactivo líquido ha caducado, por lo tanto, los resultados fueron incorrectos. Fue una lección muy instructiva.
La situación no ha cambiado mucho a lo largo de los años. Falta de conocimiento de la importancia de este parámetro clave y cómo verificar los indicadores, falta de interpretación correcta y Medidas necesarias puede y tendrá consecuencias desastrosas. Lo que ha cambiado significativamente es la disponibilidad en el mercado y la asequibilidad de los métodos e instrumentos de medición de pH. En este artículo, veremos algunos de ellos, comparando sus ventajas y desventajas.
determinación del pH
El pH es una evaluación de la naturaleza ácida o alcalina de una sustancia, expresada en una escala de 0 a 14, donde 0 es muy ácido y 14 es muy alcalino. Ambiente neutro (no ácido ni alcalino) - indicador 7 en esta escala. Los iones de hidrógeno predominan en valores de pH ácidos, mientras que los iones de hidróxido dominan en condiciones alcalinas.Figura 1. La escala de pH es logarítmica y representa el grado de actividad de los iones de hidrógeno.
Dependiendo de la fuente, pH significa "potencial de hidrógeno" o término francés"pouvoir hydrogène", que significa "energía de hidrógeno".
Importancia de medir el pH
El pH es una característica de los líquidos (en nuestro caso) que afecta a su composición química, en particular, la solubilidad nutrientes(bueno, si no nos pasamos). Un pH bajo puede hacer que los metales pesados potencialmente tóxicos se vuelvan solubles. El pH afecta la actividad enzimática (tienen un rango de pH preferido). Un pH alto es capaz de disolver las membranas lipídicas de las células. En organismos acuáticos también hay un rango de pH preferido. En la Tabla 1 se presenta una breve descripción de los valores de pH en varios entornos (de interés para los acuaristas).| fuente de pH | pH |
|---|---|
| Río Río Negro | 5.1 |
| Agua de lluvia | 5.6 |
| Río Amazonas (agua ligera) | 6.9 |
| Agua potable | 7 |
| Agua de mar | 8.2 |
| Lago Tanganica (superficie) | 9 |
medición de pH
Hay varias formas de determinar el pH. Cada uno de ellos tiene sus propias ventajas y desventajas. Vamos a empezar con el más barato.Papel de tornasol
El tornasol es un material obtenido de los líquenes (el nombre proviene de la palabra nórdica antigua litmosi, que significa "pintura" y "musgo/liquen"). Este derivado del tornasol cambia de color de manera predecible cuando se expone a diferentes niveles de pH. Esta sensibilidad hace que el tornasol sea una forma fácil y económica de determinar el pH. El papel tornasol es un papel al que se le han agregado estos tintes solubles en agua, y el cambio de color causado al sumergir el papel tornasol en una muestra de agua indica un ambiente ácido o alcalino. El rango operativo de medición de pH es de aproximadamente 5 - 8. La prueba de cambio de color debe realizarse bajo iluminación de espectro completo.

Figura 2. El papel tornasol es una forma económica pero aproximada de medir el pH.
Ventajas: económico (alrededor de 5 US). Rápido, fácil de usar.
Desventajas: Da cifras aproximadas. El resultado se ve afectado por el color de la muestra de agua, agentes reductores y agentes oxidantes. Interpretar los resultados requiere una visión aguda. La vida útil del reactivo es limitada.
Colorantes indicadores
Hay muy pocos indicadores de pH de este tipo. Puedes comprarlos en forma de polvo o líquido. Por lo general, se usan en análisis que involucran titulación. A continuación se detallan las características de algunos de ellos:
Fenolftaleína: Un indicador ácido/alcalino que se vuelve incoloro en un ambiente ácido y rosa-rojo en un ambiente alcalino. Rango de medición ~8,3 a 10.
Naranja de metilo (heliantina, colorante azoico ácido): cambia de color de amarillo a rojo con un pH de alrededor de 3,7.
Meta-Cresol Violet: Naranja-amarillo a 7.4 y cambia de color a violeta a mayor altos índices pH (hasta alrededor de 8.8.)
Azul de bromotimol: azul a 7,5, verdoso a ~6,2 - 6,8 y amarillo a alrededor de 6.
Indicador Versátil: Combina múltiples indicadores para permitir la evaluación de una amplia gama de pH.

Figura 3. Esta prueba de pH de API utiliza meta-cresol violeta como indicador.
Es deseable evaluar el cambio de color con luz natural sobre un fondo blanco.
Beneficios: Relativamente económico (~$10 US.) Algunos tintes se pueden usar para otras pruebas (por ejemplo, alcalinidad) sin usar un electrodo de pH cuando se usa un reactivo.
Desventajas: Igual que papel de tornasol. Los tintes individuales tienen un rango de pH limitado. Los resultados pueden verse afectados por la turbidez y/o el color del líquido de prueba. La comparación debe llevarse a cabo sobre un fondo blanco con iluminación de espectro completo. Los reactivos tienen una vida útil limitada: debe haber una marca en la fecha de vencimiento.
electrodos de pH
Sé que es difícil de imaginar para los acuaristas principiantes, pero hace 30 años los acuaristas fuera de Europa apenas escuchaban sobre el uso de electrodos de pH. La situación cambió en la década de 1980 cuando empresa alemana(Dupla GmbH) comenzó a exportar equipos avanzados a Norteamérica. Hoy en día, los medidores de pH se utilizan en todas partes. La disponibilidad de dispositivos y la competencia entre los fabricantes contribuyeron a que el precio se volviera bastante asequible.
El electrodo de pH es un sensor selectivo de iones de hidrógeno (H+). Los electrodos de pH en realidad usan dos electrodos, una sonda (electrodo indicador) y un electrodo de referencia. Por regla general, estos dos electrodos se encuentran en una sola carcasa ("cuerpo") del electrodo. Al final del cuerpo del electrodo, la sonda tiene una fina capa de vidrio sensible al hidrógeno. El voltaje de la sonda varía según la actividad de los iones de hidrógeno (el voltaje aumenta en un ambiente ácido y disminuye en un ambiente alcalino). El electrodo de control proporciona presión constante, que usamos para determinar la diferencia con la sonda. La respuesta total de mV se envía a un instrumento de medición (medidor) donde se convierte en un valor de pH.
Estructura y terminología del sensor
Para comprender cómo funciona un electrodo de pH, es necesario comprender algunos de los términos que se utilizan tanto para describir su diseño como otros.
Carcasa (cuerpo del electrodo): un tubo hueco que contiene las partes activas del electrodo de pH. El cuerpo puede estar hecho de vidrio o de un plástico químicamente resistente como la poliesterimida.
Amortiguador: En nuestro caso, solucion estandar, que muestra un pH ácido, neutro o alcalino, se utiliza para calibrar el medidor de pH. Para facilitar la identificación, algunas soluciones tampón están codificadas por colores.
Calibración: El proceso de verificar o ajustar la calibración de un instrumento analítico.
Conexión (unión, soldadura): Combinación de dos partes; en este caso, el material de prueba y la solución interna de control. Las conexiones se hacen de varios materiales; Los materiales deben ser porosos para permitir el paso de la solución de control. Típicamente, se utilizan cerámica, tela y similares. Hay electrodos con conexiones de uno, dos y anillos.
Frita: Vidrio o cerámica parcialmente fundido, a veces utilizado como junta.
ATC: Compensación automática de temperatura. Dado que el pH de una solución depende de la temperatura, ATC corrige los efectos de la temperatura. ATC requiere un sensor de temperatura, que se puede integrar en el electrodo cerca del bulbo de vidrio.
Electrodo de referencia: un electrodo que proporciona un voltaje constante conocido; generalmente hecho de alambre de cloro-plata y lleno de un electrolito tampón.
Sonda: Alambre de cloro-plata en un tubo con un bulbo de vidrio sensible al pH en el extremo.


Figura 4 Detalles internos electrodo de pH.
Para mayor claridad, no se muestra la cubierta protectora (tapa) que rodea el frágil matraz de vidrio.
Algunos electrodos de pH tienen una conexión lateral
Hay varios tipos de electrodos. Algunos electrodos, generalmente más antiguos (raramente vistos ahora en mi experiencia) consisten en dos carcasas separadas. Actualmente, la mayoría de los electrodos son sensores combinados, donde el ánodo y el cátodo se ubican por separado en una sola carcasa. La forma del bulbo de vidrio a menudo determina lo que medirá el electrodo. Los matraces esféricos, con su gran superficie, son muy adecuados para mediciones multipropósito (universales) en entornos acuáticos. Los matraces cónicos son capaces de penetrar materiales semisólidos (como carne y otros alimentos) y suelo. Se pueden usar "frascos" de vidrio plano para medir el pH diferentes tipos cuero, etc Algunos electrodos son reutilizables, mientras que otros no, están llenos de geles químicos. Algunos electrodos tienen conexiones y sondas extraíbles (reemplazables).
Una breve descripción de los medidores de pH
Nuestra reseña está dedicada a los medidores de pH fabricados por Instrumentos Hanna(Woonsocket, Rhode Island, EE. UU.) Hanna ha estado en el mercado desde 1978 y hoy ofrece más de 3000 variantes de productos a sus clientes en todo el mundo. Algunos de los productos de la empresa son de interés para los acuaristas.Todos los medidores de pH de Hanna que aparecen en esta revisión se suministran con un tampón de calibración, una solución de limpieza de electrodos y un estuche. Comencemos nuestra revisión con:
Comprobador de pH (HI98103)

Figura 5. Comprobador de pH asequible de Hanna Instruments.
El medidor de pH básico HI98103 Checker® será una valiosa adición a la caja de herramientas de muchos acuaristas. El dispositivo ofrece 0,1 unidades de pH. resolución a un precio asequible. Precio pagable Esto se debe a que el instrumento solo ofrece dos puntos de calibración (pH 4,01 y 7,01 o 7,01 y 10,01) sin compensación automática de temperatura (ATC) ni capacidad de medición de temperatura. Debido a que generalmente se recomienda que los puntos de calibración reflejen el pH esperado, este dispositivo es más adecuado para sistemas de agua dulce que imitan ambientes ácidos, como los biotopos amazónicos (a pesar de que ciertamente es capaz de medir valores de pH que son típicos de los arrecifes). y sistemas con cíclidos africanos, aunque con menos precisión debido a solo dos puntos de calibración). El electrodo es reemplazable y la conexión es de papel.Rango: 0 a 14 unidades
Resolución: 0,1 unidades
Precisión: ±0,2 unidades
Puntos de calibración (graduación): Dos; pH 4,01, 7,01 o 10,01
Compensación automática de temperatura: No
Medición/pantalla de temperatura: ninguna
Sonda reemplazable: Sí
Diámetro del electrodo: 8 mm (~5/16")
Tamaño de LCD: 3/8" (~10 mm)
Batería: 1-CR2032; recurso aproximadamente 1000 h.
pHep pH y sensor de temperatura(HI98107)

Figura 6. Dispositivo pHep con tampones de calibración en su estuche.
El probador de pH y temperatura pHep HI98107 es una versión más moderna del comprobador de pH (descrito anteriormente). Además de determinar el pH en el rango de casi cualquier acuario, desde el biotopo amazónico hasta el arrecife, el dispositivo también mide la temperatura con compensación automática de temperatura (ATC). El dispositivo incluye dos tampones de calibración (4.01 y 7.01) con un disponible tercero - (10.01, que se recomienda para acuarios de arrecife). La conexión está hecha de papel. El electrodo no es reemplazable.Rango: 0 a 14 unidades
Resolución: 0,1 unidades
Precisión: ±0,1 unidades
Puntos de calibración: tres; pH 4.01, 7.01 y 10.01 (4.01 y 10.01 presentados)
Sensor reemplazable: Sí
Tamaño de la pantalla LCD: 0,3125" o ~8 mm
Batería: 1-CR2032; aproximadamente 800 horas.
Sensor de temperatura y pH a prueba de agua pHep5 (HI98128)
Figura 7. pHep ofrece muchas funciones: medición de pH y temperatura, ATC; ¡Y flota en la superficie del agua!
El medidor de pH HI98128 pHep 5 es el medidor de pH de bolsillo más avanzado de Hanna. El dispositivo ofrece una resolución de 0,01 unidades. con una precisión de ±0,05 y compensación automática de temperatura. El dispositivo es resistente al agua y flota en la superficie del agua. El dispositivo ofrece un enfoque flexible para dimensiones importantes, porque capaz de reconocer 5 tampones de calibración diferentes.Rango: -2 a 16 unidades
Resolución: 0,01 unidades
Precisión: ±0,05u
Puntos de calibración: Dos opciones: 4.01, 7.01, 10.01 o 6.86, 9.18.
Compensación automática de temperatura: Sí
Pantalla de temperatura: Sí, se puede configurar °F o °C, con una precisión de ±0,5 °C.
Sonda reemplazable: Sí
Tamaño de LCD: 0,3125" o ~8 mm (tamaño de carácter)
Batería: baterías de 4-1.5v; aproximadamente 300 h.
Medidor de pH de campo inalámbrico HALO (HI12302)

Figura 8. Posiblemente el electrodo de pH más avanzado del mercado, el electrodo inalámbrico HALO.
El medidor de pH de campo Halo HI12302 es un medidor interesante que ofrece muchas posibilidades. En primer lugar, es un electrodo de pH inalámbrico que se puede controlar a través de Bluetooth desde dispositivos Android o iOS. Incluso los usuarios inseguros no deberían preocuparse. En mi experiencia, la configuración es increíblemente fácil. Abrí el sitio web de Hanna Instruments, seguí el enlace de HALO y descargué la aplicación para mi teléfono inteligente. Una vez que se instaló la aplicación (descarga gratuita, toma alrededor de 2 minutos), abrí la aplicación y el software reconoció mi electrodo de pH HALO. A continuación, lo único que se requiere es seleccionar los íconos apropiados para calibrar el electrodo, mostrar datos gráficos, ver datos del sensor, etc. Creo sinceramente que no podría ser más fácil. El software mide el pH y la temperatura cada segundo. El registro de datos proporciona la identificación del electrodo, la fecha de calibración, los puntos de calibración, la curva de calibración, la fecha y hora de la medición, el pH, la temperatura, los milivoltios, etc. (Ver Figuras 9-11).Las opciones de sonda incluyen esférica (universal y acuática), cónica (para productos, semisólidos, suelo, etc.) y punta plana (para cuero, papel, etc.) Carcasa de plástico HALO hecha de polieterimida (PEI) aprobada para contacto con productos alimenticios e inmune a cualquier cosa que pueda usar el frigorífico (a menos que esté completamente "fuera del circuito" y dosifique aromáticos y/o solventes parcialmente halogenados en su sistema).
Rango: 0 a 14 unidades
Resolución: configurable por el usuario: 0.1, 0.01 o .001 unidades.
Precisión: ±0,005 unidades
Puntos de calibración: siete; pH 1,68, 4,01, 6,86, 7,01, 91,8, 10,01 y 12,45.
Compensación automática de temperatura: Sí
Sonda de repuesto: ninguna
Diámetro del electrodo: 12 mm (~1/2")
Registro de datos: Sí
Batería: batería de litio, 500 h.

Figura 10. En el modo de registro de datos, las lecturas de pH obtenidas con el electrodo HALO se pueden ver en forma tabular o...

Figura 11. ... en forma de gráfico. Las notas son posibles y los datos se pueden transferir a hojas de cálculo de Excel.
Puede verificar si su teléfono o tableta es compatible con HALO aquí: http://hannainst.com/halo
Más información detallada Puede encontrar información sobre los productos de Hanna Instruments aquí: http://hannainst.com
Todas las sondas y electrodos Hanna vienen con una garantía de 6 meses.
Otras Consideraciones
Ahora te hablaré brevemente de otros aspectos que debes tener en cuenta a la hora de comprar un medidor o electrodo de pH.Conectores (adaptadores)
Los dispositivos de pH con electrodos separados deben conectarse al instrumento mediante un conector (excepto cuando se trata de dispositivos con conexión inalámbrica, como Hanna HALO). Y aunque el aspecto parece insignificante, puede tener consecuencias a largo plazo y posiblemente costosas. . Algunos fabricantes utilizan conectores especializados para garantizar el uso continuo y la compra de sus electrodos. El más común es el conector rápido Bayonet Neill-Concelman (BNC). El conector estadounidense es menos común. Algunos dispositivos fabricados en Europa utilizan el conector S7.
Conexiones
La unión en el electrodo de pH es el punto de intersección (encuentro) de dos mundos: la solución interna del sensor y la muestra bajo prueba. Hay términos especializados que se utilizan para describir compuestos, su estructura y geometría. Como se discutió, las conexiones permiten que la solución de control del electrodo ingrese a la solución de prueba. En este sentido, están sujetos a contaminación, colmatación, especialmente en el caso de muestras aceitosas, o muestras con alto contenido proteína o suspensiones (soluciones con una suspensión). Algunos electrodos utilizan una conexión de tejido. Los electrodos más caros usan poroso materiales cerámicos. Algunas conexiones están hechas de plástico PTFE (politetrafluoroetileno) y están diseñadas para su uso en entornos hostiles, incluidos entornos con alto contenido de hidrocarburos. Las juntas de PTFE a veces son bastante grandes y se asemejan a un anillo alrededor de un bulbo de vidrio (las juntas de cerámica suelen ser pequeñas, de solo 1 mm de diámetro). Cualquier conexión puede contaminarse.
Afortunadamente, para los acuaristas de arrecife, las sondas de pH universales con conexiones de tela o cerámica están bien.
Limpieza de electrodos de pH
Siempre vale la pena recordar que los electrodos son dispositivos para investigación científica y requieren un cuidado adecuado. Y aunque la caja de plástico es bastante duradera, la bombilla de vidrio es muy frágil: un manejo descuidado puede provocar que se rompa. Los electrodos que se usan ocasionalmente no requieren una limpieza frecuente; sin embargo, si su electrodo está permanentemente sumergido en "sopa orgánica" (como en algunos acuarios), se recomienda a los acuaristas que limpien el electrodo con regularidad. Sucede que la sonda está cubierta con incrustaciones biológicas y proteínas. La alimentación (y las fallas catastróficas de las bombas sumergibles) agregan grasas al agua del acuario, lo que también contribuye al ensuciamiento del electrodo. Afortunadamente, las soluciones de limpieza ayudan a mantener la funcionalidad de los electrodos. Siga las instrucciones del fabricante. No frote el electrodo; siempre séquelo para evitar descargas estáticas.
Electrodos de gel rellenables y no rellenables
Algunos electrodos se pueden rellenar con soluciones especialmente formuladas, mientras que otros electrodos se rellenan con gel. En general, los sensores de gel son más lentos para responder a los cambios de pH. La mayoría de los sensores diseñados para uso en acuarios están llenos de gel.
Calibración
La calibración correcta del electrodo de pH es condición necesaria para obtener resultados precisos. El proceso se simplifica si el instrumento ofrece compensación automática de temperatura (ATC). Las figuras 12 a 14 muestran ejemplos del efecto de la temperatura en un estándar de calibración (referencia).

Figura 12. Efecto de la temperatura en el tampón de hidroftalato de potasio 4.01.

Figura 13. Efecto de la temperatura sobre el pH del tampón de dihidrogenofosfato de potasio/dihidrogenofosfato (6.865). Afortunadamente, las calibraciones de temperatura ambiente son bastante precisas si se utiliza un instrumento que no sea ATC.

Figura 14. El pH de este tampón (bicarbonato de sodio/carbonato de sodio) puede verse afectado por la temperatura (otro caso para usar un dispositivo ATC). El dióxido de carbono de la atmósfera ataca la solución con el tiempo.
La calibración adecuada de un electrodo de pH requiere un poco de paciencia y atención a los detalles. Los transductores nuevos deben hidratarse adecuadamente (consulte las instrucciones de su instrumento). A pesar de que es posible una calibración de un solo punto, es deseable realizar una calibración de 2 puntos (entre los cuales debería estar el pH esperado). Para acuarios de arrecife, utilice los tampones 7.01 y 9 o 10. Tenga en cuenta que algunos instrumentos pueden reconocer automáticamente los tampones y, por lo tanto, requieren el uso de soluciones especiales. Antes de la calibración, verifique que el electrodo no esté dañado (especialmente el bulbo de vidrio). No debe haber bioincrustaciones en el bulbo de vidrio. Si está disponible, use una solución de limpieza recomendada por el fabricante. En limpieza adecuada se eliminará la bioincrustación, la grasa, la contaminación por proteínas, etc. El electrodo, si es recargable, debe llenarse con una solución recomendada por el fabricante. Cuando el electrodo esté limpio y en buenas condiciones, colóquelo en la primera solución de calibración. Asegúrese de que el bulbo de vidrio del electrodo y la conexión estén completamente sumergidos en la solución de calibración (utilizo un vaso de precipitados de 30 mm donde 7 mm de tampón son suficientes para la calibración). Revuelva la solución vigorosamente con el electrodo (si no hay un agitador magnético disponible) y espere hasta que la temperatura del electrodo y la solución sean iguales. Ingrese el valor en la memoria del instrumento (por lo general, se debe presionar el botón cuando el instrumento está en modo de calibración). Enjuague el electrodo con agua destilada y séquelo con una toalla de papel (preferiblemente toallitas de laboratorio como Kimwipes). NUNCA limpie los electrodos con papel; se puede crear electricidad estática y afectar la calibración y, por lo tanto, las lecturas. En el caso de un solo punto de calibración, el proceso está completo. En el caso de 2 o 3 puntos de calibración, se debe repetir el procedimiento. Al medir el pH de una muestra de agua, revuelva la solución manualmente o con un agitador y deje tiempo para la compensación de temperatura. En la práctica de laboratorio, se recomienda registrar el pH y la temperatura.
Envejecimiento de tampones de calibración
Como ocurre con la mayoría de los productos químicos, los amortiguadores de pH se deterioran con el tiempo. Algunos amortiguadores se fabrican para que sean resistentes al cambio y tengan una larga vida útil (varios años). Elija tampones que tengan fecha de caducidad en el envase. La vida útil de las soluciones amortiguadoras de carbonato es generalmente más corta que la de las soluciones amortiguadoras alcalinas o ácidas debido a la exposición a dióxido de carbono. Los tampones que hayan estado en contacto con el electrodo durante la calibración deben desecharse. Si nota que el tampón se está enmoheciendo (generalmente alrededor de 4 tampones), deséchelo. No utilice tampones para corregir el pH de su acuario.
Almacenamiento de electrodos de pH
Almacene los sensores de pH correctamente. Lo más importante es que el bulbo de vidrio debe permanecer hidratado. En segundo lugar, la solución madre no debe permitir la ósmosis entre la propia solución y la solución interna/gel de electrodo. Además, debe contener un componente antimicrobiano que evite la aparición de moho y ensuciamiento.
Los tampones de calibración de pH, las soluciones madre y los accesorios necesarios se pueden encontrar aquí: http://hannainst.com/ph-solutions
Recursos y blogs de pH de Hanna Instruments
1.2. Guías y listas de verificación de electrodos de pH
3. Los 10 principales errores en las mediciones de pH
4.
Antes de usar los electrodos por primera vez, deben calibrarse. Para ello, existen soluciones de calibración especiales que se tamponan a valores de pH específicos. La amortiguación funciona de tal manera que la entrada de una pequeña cantidad de agua cuando el electrodo está sumergido no interfiere con la calibración. El significado de calibración es ajustar el error del electrodo asociado a la fabricación y uso a ciertos valores. En este caso, se deben considerar dos errores: la desviación del punto cero y la "inclinación" del error.
Ambos errores conducen a un error de medición total. Por lo tanto, se debe realizar una calibración de dos puntos para que se puedan corregir ambos errores de medición.
Error de punto cero. La figura anterior muestra la curva de medición y la curva de referencia. En este ejemplo, la curva de medición obviamente se desvía de la curva de referencia a pH 7, es decir en el punto neutro, arreglamos el error evidente del punto cero, que debe ser eliminado. Los electrodos se introducen primero en la solución de calibración de pH 7. Es importante que la membrana de vidrio y el diafragma estén al menos sumergidos en la solución. En nuestro ejemplo, el valor medido se encuentra por encima del requerido, por lo tanto, se desvía del valor nominal. En el potenciómetro de resistencia variable, el valor medido se ajusta al valor correcto. Toda la curva de medición se desplaza paralelamente por el error del punto cero, de modo que pasa exactamente por el punto neutro. De este modo, el dispositivo de medición se establece en el punto cero y está listo para su uso.
Para calibrar los electrodos de pH, primero se debe establecer un punto cero.
Error de pendiente. Después de la calibración del punto cero, obtenemos la situación representada en la figura adyacente. El cero se determina exactamente, pero el valor medido todavía tiene un error significativo porque aún no se ha determinado el punto de pendiente. Ahora se selecciona una solución de calibración cuyo valor de pH es diferente de 7. La mayoría de las soluciones tampón se usan en el rango de pH de 4 a 9. El electrodo se sumerge en una segunda solución tampón y usando un potenciómetro, la desviación de la pendiente del valor nominal (estándar) se encuentra el valor. Y solo ahora la curva de medición coincide con la curva requerida; el instrumento está calibrado.

Si se establece el punto cero, se debe establecer el segundo valor relativo, la pendiente.
El efecto de la temperatura. Los cambios en los valores de pH están influenciados por la temperatura del agua. Sin embargo, no está claro si la compensación de temperatura es necesaria en nuestros instrumentos de medición. La tabla adjunta muestra los valores de pH en función de la temperatura, con el instrumento calibrado a 20 °C. Cabe señalar que para las temperaturas y los valores de pH que nos interesan, el error de medición debido a las desviaciones de temperatura se limita al segundo decimal. Por lo tanto, tal error de medición para los acuaristas no tiene importancia práctica y no se requiere compensación de temperatura. Junto con las desviaciones de naturaleza puramente de medición basadas en diferentes voltajes en los electrodos, se deben tener en cuenta las desviaciones de temperatura de las soluciones calibradas, que se dan en la tabla adyacente.
Vemos aquí que estas desviaciones son relativamente pequeñas y no superan el ±2%.
Desviación de los valores de pH medidos en función de la temperatura
| valor pH | ||||||
| 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 ºC | 3,78 | 4,85 | 5,93 | 7,00 | 8,07 | 9,15 |
| 5°C | 3,84 | 4,89 | 5,95 | 7,00 | 8,05 | 9,11 |
| 10°C | 3,89 | 4,93 | 5,96 | 7,00 | 8,04 | 9,07 |
| 15°C | 3,95 | 4,97 | 5,98 | 7,00 | 8,02 | 9,03 |
| 20°C | 4,00 | 5,00 | 6,00 | 7,00 | 8,00 | 9,00 |
| 25°C | 4,05 | 5,03 | 6,02 | 7,00 | 7,98 | 8,97 |
| 30°C | 4,10 | 5,07 | 6,03 | 7,00 | 7,97 | 8,93 |
| 35°C | 4,15 | 5,10 | 6,05 | 7,00 | 7,95 | 8,90 |
Dependencia de la temperatura de las soluciones tampón
| Temperatura °С | valor pH | Desviación % | valor pH | Desviación % | valor pH | Desviación % |
| 5 | 4,01 | 0,25 | 7,07 | 1,00 | 9,39 | 1,84 |
| 10 | 4,00 | 0,00 | 7,05 | 0,71 | 9,33 | 1,19 |
| 15 | 4,00 | 0,00 | 7,03 | 0,43 | 9,27 | 0,54 |
| 20 | 4,00 | 0,00 | 7,00 | 0,00 | 9,22 | 0,00 |
| 25 | 4,01 | 0,25 | 7,00 | 0,00 | 9,18 | -0,43 |
| 30 | 4,01 | 0,25 | 6,97 | -0,43 | 9,14 | -0,87 |
| 35 | 4,02 | 0,50 | 6,96 | -0,57 | 9,10 | -1,30 |
El control. Como control, se recomienda sumergir nuevamente los electrodos en una solución tampón a pH 7 y verificar si los valores convergen. Si el valor de pH del electrodo es consistente con instrumento de medición, se puede utilizar para medir muestras de agua. Si hay reclamos personales de precisión, la calibración debe repetirse en plazos. Como recomendación, se pueden sugerir de una a dos semanas. Al calibrar los electrodos de pH, también se debe prestar atención a la rapidez con la que el valor de pH del instrumento se acerca al valor de pH de la solución tampón.