Indicador de hidrógeno (factor de pH) es una medida de la actividad de los iones de hidrógeno en una solución, cuantificando su acidez. Cuando el pH no está en el nivel óptimo, las plantas comienzan a perder la capacidad de absorber algunos de los elementos necesarios para un crecimiento saludable. Para todas las plantas hay un nivel de pH específico que le permite lograr máximos resultados al crecer La mayoría de las plantas prefieren un medio de cultivo ligeramente ácido (entre 5,5 y 6,5).
Indicador de hidrógeno en fórmulas
En soluciones muy diluidas, el pH es equivalente a la concentración de iones de hidrógeno. Igual en módulo y de signo opuesto al logaritmo decimal de la actividad de los iones de hidrógeno, expresada en moles por litro:
pH = -lg
En condiciones estándar, el valor de pH se encuentra entre 0 y 14. En agua limpia, a pH neutro, la concentración de H + es igual a la concentración de OH - y es de 1·10 -7 mol por litro. Máximo significado posible El pH se define como la suma de pH y pOH y es igual a 14.
Contrariamente a la creencia popular, el pH puede variar no solo en el rango de 0 a 14, sino que también puede ir más allá de estos límites. Por ejemplo, a una concentración de iones de hidrógeno = 10 −15 mol/l, pH = 15, a una concentración de iones de hidróxido de 10 mol/l pOH = −1.
¡Es importante entender! La escala de pH es logarítmica, lo que significa que cada unidad de cambio equivale a un cambio de diez veces en la concentración de iones de hidrógeno. En otras palabras, una solución de pH 6 es diez veces más ácida que una solución de pH 7, y una solución de pH 5 será diez veces más ácida que una solución de pH 6 y cien veces más ácida que una solución de pH 7. Esto significa que cuando estás ajustando el pH de tu solución nutritiva y necesitas cambiar el pH en dos puntos (por ejemplo, de 7,5 a 5,5) debes usar diez veces más ajustador de pH que si solo cambiaras el pH en un punto (de 7,5 a 5,5). 6.5). ).
Métodos para determinar el valor de pH
Varios métodos son ampliamente utilizados para determinar el valor de pH de las soluciones. El valor de pH puede aproximarse utilizando indicadores, medirse con precisión con un medidor de pH o determinarse analíticamente realizando una titulación ácido-base.
Indicadores ácido-base
Para una estimación aproximada de la concentración de iones de hidrógeno, los indicadores ácido-base son ampliamente utilizados: sustancias colorantes orgánicas, cuyo color depende del pH del medio. Los indicadores más famosos incluyen tornasol, fenolftaleína, naranja de metilo (metil naranja) y otros. Los indicadores pueden existir en dos formas de diferentes colores, ya sea ácidas o básicas. El cambio de color de cada indicador ocurre en su rango de acidez, generalmente 1-2 unidades.
indicador universal
 Para ampliar el rango de trabajo de la medición del pH, se utiliza el llamado indicador universal, que es una mezcla de varios indicadores. El indicador universal cambia constantemente de color de rojo a amarillo, verde, azul a púrpura cuando se mueve de una región ácida a una básica.
Para ampliar el rango de trabajo de la medición del pH, se utiliza el llamado indicador universal, que es una mezcla de varios indicadores. El indicador universal cambia constantemente de color de rojo a amarillo, verde, azul a púrpura cuando se mueve de una región ácida a una básica.
Las soluciones de tales mezclas: los "indicadores universales" generalmente se impregnan con tiras de "papel indicador", con las que puede determinar rápidamente (con una precisión de unidades de pH, o incluso décimas de pH) la acidez de las soluciones acuosas en estudio. Para una determinación más precisa, el color del papel indicador obtenido al aplicar una gota de solución se compara inmediatamente con la escala de colores de referencia, cuya forma se muestra en las imágenes.

La determinación del pH por el método del indicador es difícil para soluciones turbias o coloreadas.
Dado que los valores de pH óptimos para las soluciones de nutrientes en hidroponía tienen un rango muy estrecho (generalmente de 5,5 a 6,5), también se utilizan otras combinaciones de indicadores. Entonces, por ejemplo, el nuestro tiene un rango de trabajo y una escala de 4.0 a 8.0, lo que hace que esta prueba sea más precisa que el papel indicador universal.

medidor de pH
 El uso de un dispositivo especial, un medidor de pH, le permite medir el pH en un rango más amplio y con mayor precisión (hasta 0,01 unidades de pH) que con indicadores universales. El método es conveniente y alta precisión, especialmente después de calibrar el electrodo indicador en el rango de pH seleccionado. Le permite medir el pH de soluciones opacas y coloreadas y, por lo tanto, es muy utilizado.
El uso de un dispositivo especial, un medidor de pH, le permite medir el pH en un rango más amplio y con mayor precisión (hasta 0,01 unidades de pH) que con indicadores universales. El método es conveniente y alta precisión, especialmente después de calibrar el electrodo indicador en el rango de pH seleccionado. Le permite medir el pH de soluciones opacas y coloreadas y, por lo tanto, es muy utilizado.

Método analítico volumétrico
El método volumétrico analítico, la titulación ácido-base, también brinda resultados precisos para determinar la acidez de las soluciones. Se agrega gota a gota una solución de concentración conocida (valorante) a la solución de prueba. Cuando se mezclan, reacción química. El punto de equivalencia, el momento en que el valorante es exactamente suficiente para completar completamente la reacción, se fija mediante un indicador. Además, conociendo la concentración y el volumen de la solución valorante añadida, se calcula la acidez de la solución.
Efecto de la temperatura en los valores de pH
 El valor de pH puede cambiar en un amplio rango a medida que cambia la temperatura. Así, una solución 0,001 molar de NaOH a 20°C tiene pH=11,73, ya 30°C pH=10,83. El efecto de la temperatura sobre los valores de pH se explica por la diferente disociación de los iones de hidrógeno (H+) y no es un error experimental. El efecto de la temperatura no puede ser compensado por la electrónica del medidor de pH.
El valor de pH puede cambiar en un amplio rango a medida que cambia la temperatura. Así, una solución 0,001 molar de NaOH a 20°C tiene pH=11,73, ya 30°C pH=10,83. El efecto de la temperatura sobre los valores de pH se explica por la diferente disociación de los iones de hidrógeno (H+) y no es un error experimental. El efecto de la temperatura no puede ser compensado por la electrónica del medidor de pH.
Ajuste del pH de la solución nutritiva
Acidificación de la solución nutritiva
La solución nutritiva generalmente necesita ser acidificada. La absorción de iones por parte de las plantas provoca una alcalinización gradual de la solución. Cualquier solución que tenga un pH de 7 o superior necesitará ajustarse con mayor frecuencia al pH óptimo. Se pueden usar varios ácidos para acidificar la solución nutritiva. Muy a menudo, se usa ácido sulfúrico o fosfórico. Una mejor solución para las soluciones hidropónicas son los aditivos amortiguadores como y. Estos productos no solo llevan los valores de pH al nivel óptimo, sino que también estabilizan los valores durante un largo período.
Al ajustar el pH con ácidos y álcalis, se deben usar guantes de goma para evitar quemaduras en la piel. Un químico experimentado maneja hábilmente el ácido sulfúrico concentrado, agrega ácido al agua gota a gota. Pero como hidroponista principiante, probablemente sea mejor pedirle a un químico experimentado que prepare una solución de ácido sulfúrico al 25 %. Mientras se agrega el ácido, se agita la solución y se determina su pH. haber aprendido cantidad aproximadaácido sulfúrico, en el futuro se puede agregar desde un cilindro graduado.
El ácido sulfúrico debe agregarse en pequeñas porciones para no acidificar demasiado la solución, que luego debe alcalinizarse nuevamente. Para un trabajador sin experiencia, la acidificación y la alcalinización pueden continuar indefinidamente. Además de perder tiempo y reactivos, dicha regulación desequilibra la solución nutritiva debido a la acumulación de iones que las plantas no necesitan.
Alcalinización de la solución nutritiva
Las soluciones demasiado ácidas se alcalinizan con hidróxido de sodio (hidróxido de sodio). Como su nombre lo indica, es cáustico por lo que se deben usar guantes de goma. Se recomienda comprar sodio cáustico en forma de pastillas. En las tiendas productos químicos para el hogar El sodio cáustico se puede comprar como limpiapipas, como Mole. Disolver una pastilla en 0,5 litros de agua y verter gradualmente la solución alcalina en la solución nutritiva con agitación constante, controlando frecuentemente su pH. Ningún cálculo matemático puede calcular cuánto ácido o álcali se necesita agregar en tal o cual caso.
Si desea cultivar varios cultivos en una paleta, debe seleccionarlos de modo que no solo coincidan su pH óptimo, sino también las necesidades de otros factores de crecimiento. Por ejemplo, los narcisos amarillos y los crisantemos necesitan un pH de 6,8 pero un régimen de humedad diferente, por lo que no se pueden cultivar en el mismo palé. Si les da a los narcisos tanta humedad como a los crisantemos, los bulbos de los narcisos se pudrirán. En experimentos, el ruibarbo alcanzó su máximo desarrollo a pH 6,5, pero podía crecer incluso a pH 3,5. La avena, que prefiere un pH de alrededor de 6, produce buenos rendimientos incluso a un pH de 4 si se aumenta considerablemente la cantidad de nitrógeno en la solución nutritiva. Las patatas crecen en un rango de pH bastante amplio, pero crecen mejor a un pH de 5,5. Por debajo de este pH también se obtienen altos rendimientos tubérculos, pero adquieren sabor agrio. Para recibir rendimientos máximos Alta calidad, necesita ajustar con precisión el pH de las soluciones de nutrientes.
Antes de usar los electrodos por primera vez, deben calibrarse. Para ello, existen soluciones de calibración especiales que se tamponan a valores de pH específicos. La amortiguación funciona de tal manera que la entrada de una pequeña cantidad de agua cuando el electrodo está sumergido no interfiere con la calibración. El significado de calibración es ajustar el error del electrodo asociado a la fabricación y uso a ciertos valores. En este caso, se deben considerar dos errores: la desviación del punto cero y la "inclinación" del error.
Ambos errores conducen a un error de medición total. Por lo tanto, se debe realizar una calibración de dos puntos para que se puedan corregir ambos errores de medición.
Error de punto cero. La figura anterior muestra la curva de medición y la curva de referencia. En este ejemplo, la curva de medición obviamente se desvía de la curva de referencia a pH 7, es decir en el punto neutro, arreglamos el error evidente del punto cero, que debe ser eliminado. Los electrodos se introducen primero en la solución de calibración de pH 7. Es importante que al menos la membrana de vidrio y el diafragma estén sumergidos en la solución. En nuestro ejemplo, el valor medido se encuentra por encima del requerido, por lo tanto, se desvía del valor nominal. En el potenciómetro de resistencia variable, el valor medido se ajusta al valor correcto. Toda la curva de medición se desplaza paralelamente por el error del punto cero, de modo que pasa exactamente por el punto neutro. Por lo tanto, dispositivo de medición puesto a cero y listo para usar.
Para calibrar los electrodos de pH, primero se debe establecer un punto cero.
Error de pendiente. Después de la calibración del punto cero, obtenemos la situación representada en la figura adyacente. El cero se determina exactamente, pero el valor medido todavía tiene un error significativo porque aún no se ha determinado el punto de pendiente. Ahora se selecciona una solución de calibración cuyo valor de pH es diferente de 7. La mayoría de las soluciones tampón se usan en el rango de pH de 4 a 9. El electrodo se sumerge en una segunda solución tampón y usando un potenciómetro, la desviación de la pendiente del valor nominal (estándar) se encuentra el valor. Y solo ahora la curva de medición coincide con la curva requerida; el instrumento está calibrado.

Si se establece el punto cero, se debe establecer el segundo valor relativo, la pendiente.
El efecto de la temperatura. Los cambios en los valores de pH están influenciados por la temperatura del agua. Sin embargo, no está claro si la compensación de temperatura es necesaria en nuestros instrumentos de medición. La tabla adjunta muestra los valores de pH en función de la temperatura, con el instrumento calibrado a 20 °C. Cabe señalar que para las temperaturas y los valores de pH que nos interesan, el error de medición debido a las desviaciones de temperatura se limita al segundo decimal. Por lo tanto, tal error de medición para los acuaristas no tiene importancia práctica y no se requiere compensación de temperatura. Junto con las desviaciones de naturaleza puramente de medición basadas en diferentes voltajes en los electrodos, se deben tener en cuenta las desviaciones de temperatura de las soluciones calibradas, que se dan en la tabla adyacente.
Vemos aquí que estas desviaciones son relativamente pequeñas y no superan el ±2%.
Desviación de los valores de pH medidos en función de la temperatura
| valor pH | ||||||
| 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 ºC | 3,78 | 4,85 | 5,93 | 7,00 | 8,07 | 9,15 |
| 5°C | 3,84 | 4,89 | 5,95 | 7,00 | 8,05 | 9,11 |
| 10°C | 3,89 | 4,93 | 5,96 | 7,00 | 8,04 | 9,07 |
| 15°C | 3,95 | 4,97 | 5,98 | 7,00 | 8,02 | 9,03 |
| 20°C | 4,00 | 5,00 | 6,00 | 7,00 | 8,00 | 9,00 |
| 25°C | 4,05 | 5,03 | 6,02 | 7,00 | 7,98 | 8,97 |
| 30°C | 4,10 | 5,07 | 6,03 | 7,00 | 7,97 | 8,93 |
| 35°C | 4,15 | 5,10 | 6,05 | 7,00 | 7,95 | 8,90 |
Dependencia de la temperatura de las soluciones tampón
| Temperatura °C | valor pH | Desviación % | valor pH | Desviación % | valor pH | Desviación % |
| 5 | 4,01 | 0,25 | 7,07 | 1,00 | 9,39 | 1,84 |
| 10 | 4,00 | 0,00 | 7,05 | 0,71 | 9,33 | 1,19 |
| 15 | 4,00 | 0,00 | 7,03 | 0,43 | 9,27 | 0,54 |
| 20 | 4,00 | 0,00 | 7,00 | 0,00 | 9,22 | 0,00 |
| 25 | 4,01 | 0,25 | 7,00 | 0,00 | 9,18 | -0,43 |
| 30 | 4,01 | 0,25 | 6,97 | -0,43 | 9,14 | -0,87 |
| 35 | 4,02 | 0,50 | 6,96 | -0,57 | 9,10 | -1,30 |
El control. Como control, se recomienda sumergir nuevamente los electrodos en una solución tampón a pH 7 y verificar si los valores convergen. Si el valor de pH del electrodo es consistente con el dispositivo de medición, se puede usar para medir muestras de agua. Si hay reclamos personales de precisión, la calibración debe repetirse en plazos. Como recomendación, se pueden sugerir de una a dos semanas. Al calibrar los electrodos de pH, también se debe prestar atención a la rapidez con la que el valor de pH del instrumento se acerca al valor de pH de la solución tampón.
Los artículos de esta sección se pueden descargar en formato Word (texto y cifras) y en formato Excel (texto, cifras, fragmentos de trabajo de cálculos)
Sin embargo, si aún no le gusta usar las imágenes discutidas en la lección anterior, puede ofrecer programas cortos que funcionan en el rango de NaCl = 0--500 µg/kg y t = 10--50 °C con una extrapolación error de hasta 2 µg/kg en términos de sodio, que es mucho menor que el error de la medición en sí. Encontrará estos programas en el archivo Fragment.xls, tienen la siguiente forma tabular:
NaCl en contacto con el aire:
Si el contenido en el aire de la habitación dióxido de carbono más que aceptado en el cálculo, entonces se sobrestimará la concentración de NaCl calculada a partir de estos fragmentos.
Ahora sobre la calidad de nuestros datos. Mantenga siempre la información original. Si registró las lecturas del dispositivo (conductividad eléctrica o pH), anote la temperatura de la solución medida. Para el pH, indique si el compensador de temperatura se activó durante la medición y, en general, consulte las instrucciones del dispositivo, qué hace cuando la temperatura de la muestra se desvía de la temperatura estándar. Cuando determine el pH, la conductividad o la alcalinidad hidratada de una muestra, especialmente en una muestra con un alto contenido inicial de dióxido de carbono, tenga en cuenta que su muestra ya no es la misma que era en el momento en que se tomó. Una cantidad desconocida de dióxido de carbono ya pasó de la muestra al aire o viceversa.
De alguna manera llamaron desde Vinnitsa y preguntaron cómo ajustar el pH según la temperatura. Solo esto puede y no debe hacerse en el objeto. En cualquier caso, registre el pH inicial y la temperatura de la muestra y proporcione una columna separada para el valor de pH corregido.
Ahora sobre cómo ajustar el pH. me temo que en vista general incluso cien hombres sabios no responderán a esta pregunta "simple". Así es, por ejemplo, la dependencia del pH de la temperatura para agua absolutamente pura.

Lo mismo, pero en contacto con el aire:


Pero la corrección de pH por temperatura para estos dos gráficos resultó ser la misma:

La transición del pHt medido al pH en t=25 °C para estos gráficos se puede realizar mediante la fórmula:

Un enfoque más riguroso sería tomar no 1 y 3 mg/l de dióxido de carbono libre, sino 1 y 3 mg/l de dióxido de carbono total (no disociado y disociado). Encontrará este fragmento, si lo desea, en la Hoja 4, pero los resultados de este fragmento no diferirán significativamente de los que se dan en esta Hoja.
Tenga en cuenta que los fragmentos de dióxido de carbono se dan en relación con aguas donde, además de dióxido de carbono, no hay álcalis ni ácidos y, en particular, no hay amoníaco. Esto sucede solo en algunas centrales térmicas con calderas de media presión.
Los electrodos de pH no son sistemas ideales. Ellos quizás tengan longitud diferente, imperfecto forma geometrica, alteraciones en la composición del electrolito interno, etc. Todo esto afecta a sus características y, al mismo tiempo, esto es bastante normal, ya que en cualquier producción existen ciertas tolerancias. Por lo tanto, cada medidor de pH necesita una calibración que ayude al medidor a establecer la relación entre la señal del electrodo y el valor de pH de la solución.
¡La calibración es un momento muy crucial! Hay que ser consciente de la imposibilidad de medir el pH con mayor precisión que los patrones utilizados. Por ejemplo, si desea trabajar con una precisión de 0,01 pN, debe ejecutar siguientes condiciones: el error total del medidor de pH y el electrodo no debe exceder 0,005 pH y la calibración debe realizarse con especial atención a las soluciones tampón especiales de alta precisión. No puede comprar tales soluciones, porque no están almacenadas. Deberán prepararse de forma independiente, utilizando reactivos especialmente preparados y agua.
Si no puede preparar un tampón con una precisión de +/- 0,005 pH, tendrá que contentarse con soluciones tampón de marca, cuya precisión está garantizada a un nivel de +/- 0,02 pH. Cuando se calibra de acuerdo con dichos estándares, el error total no excederá de 0,04 - 0,03 pH, siempre que el error del instrumento esté en el nivel de 0,01 pH. Esta es la práctica más común y no encontrará un solo método o GOST que requiera mantener el pH con una precisión superior a 0,05 pH. Las únicas excepciones son algunas industrias farmacéuticas y especializadas.
Los electrodos de pH modernos suelen estar combinados, es decir, el electrodo de pH y el electrodo de referencia están ubicados en la misma carcasa. Además de la facilidad de uso, esto proporciona una respuesta más rápida y un error general más bajo.
El punto isoeléctrico de dichos electrodos está a pH=7 (0 mV). Por lo tanto, el instrumento debe calibrarse primero con un tampón de pH neutro (p. ej., 6,86 o 7,01). El segundo punto debe elegirse a una distancia de aproximadamente 3 unidades de pH, es decir pH = 4 o 10. Si el instrumento está calibrado con solo dos tampones, entonces la elección del segundo punto depende del rango en el que trabaja principalmente. Si se trata de soluciones alcalinas, use un tampón con pH = 10, si es ácido, con pH = 4. Esto se debe a alguna diferencia en las pendientes de las líneas rectas de calibración en las regiones ácidas y alcalinas. No habrá problemas si su instrumento se puede calibrar con tres o más puntos. En este caso, el orden de calibración no es importante, ya que el medidor de pH lo controla por sí solo.
En los modelos económicos de medidores de pH (HI8314, Piccolo, Checker), se proporcionan dos tornillos para la calibración: uno para configurar el punto isoeléctrico (referencia) (pH7), el otro para ajustar la pendiente (pH4 / 10). Muy a menudo, cuando se usan, se confunden y surge una situación en la que la posición mutua de los tornillos no permite la calibración. En este caso, antes de la calibración, ambos tornillos deben colocarse en la posición media (1/2 vuelta para Piccolo y 15-16 vueltas para otros modelos desde la posición extrema).
La mayoría modelos perfectos Los medidores de pH tienen los llamados. Soporte GLP, que, además de la fecha de la última calibración, le permite evaluar el estado del electrodo en función de la relación de la pendiente de la curva de calibración con el valor teórico (59,16 a 25C) en %. Si el dispositivo no es compatible con GLP, pero tiene un modo de medición de mV, la pendiente se puede calcular de forma independiente midiendo el valor de mV en el tampón pH=7 y pH=4.
Por ejemplo:
pH7 = -10 mV
pH4 = +150 mV
pendiente = 150 - (-10) / 59,2x3 = 90,1%
95 - 102% - el electrodo funciona correctamente,
92 - 95% - el electrodo necesita ser limpiado,
menos del 92%: es necesario cambiar el electrolito o reemplazar el electrodo.
Problema de compensación de temperatura, compensación automática de temperatura
El problema de la compensación de los cambios de temperatura es uno de los más importantes y más difíciles de resolver en pH-metría. El error de medición ocurre por tres razones: la ecuación de Nernst incluye la temperatura; Las concentraciones de equilibrio de iones de hidrógeno en el tampón y las muestras varían con la temperatura; Las características del electrodo de pH dependen de la temperatura. 1. Según la ecuación de Nernst, la pendiente teórica de la curva de calibración cambia con la temperatura. Si el dispositivo no tiene en cuenta este cambio, entonces se agrega al error de medición un error en promedio igual a 0.003 рН por cada grado Celsius y cada unidad de pH desde el punto isopotencial.Por ejemplo: el instrumento está calibrado con buffer pH=7 a 25C.
Muestra con pH=5 a 20C, error = 0.003 x 5 x 2 = 0.03
Muestra con pH=2,5 a 2C, error = 0,003 x 23 x 4,5 = 0,31
Muestra con pH=12 a 80C, error = 0.003 x 55 x 5 = 0.82
|
temperatura |
valor pH |
||||
Lo que necesita saber sobre la compensación de temperatura
1. La compensación automática de temperatura en pH-metría significa que solo se tiene en cuenta la temperatura incluida en la ecuación de Nernst.
2. Si quieres saber valor exacto El pH de la muestra está a 25C, la única solución real es medirlo a 25C.
En un momento, mi primer acuario marino fue una obra maestra. Era un acuario de vidrio de 20 galones, pegado adhesivo de silicona. El sistema de filtración consistió en filtros neumáticos de arena. Mi tarea era apoyar a dos de sus habitantes (Bew Gregory el pez damisela - Stegastes leucostictus- y anémonas de mar condilactis) lo más satisfecho posible (lo que, dada mi falta de experiencia y recursos limitados, significaba mantenerlos con vida). Tarea difícil para un niño de 9 años, era 1964. Mi mentora, la Sra. Perry de Cobb Pets, me aconsejó que revisara Gravedad específica agua y pH. La gravedad específica fue bastante fácil (simplemente coloque un hidrómetro en el acuario y haga una marca en un cierto nivel al agregar agua dulce), pero con el pH todo fue algo más complicado. Este parámetro se probó agregando un líquido coloreado a la botella de muestra. agua de acuario. Como por arte de magia, se cambió el color de la muestra de agua y luego se comparó utilizando una tabla de comparación que consiste en una serie de cuadrados de colores. De acuerdo con los resultados de mi primera prueba, necesitaba agregar bicarbonato para elevar el nivel de pH. Obedientemente, lo hice, sin cambios. Continué el proceso hasta haber agregado todo el paquete de bicarbonato de sodio.
Nunca sabré qué causó la muerte de mi pez y mi anémona, pero el incidente ocurrió inmediatamente después del episodio descrito. Además de que todo terminó muy triste para mis mascotas, la situación se volvió devastadora para mí. Todo mi trabajo, por el que cobraba un dólar a la semana, se fue a la basura. Para colmo, fui responsable de la muerte de los habitantes. Los enterré en la orilla cubierta de helechos del arroyo que fluía en nuestro patio. Ahora creo que el reactivo líquido ha caducado, por lo tanto, los resultados fueron incorrectos. Fue una lección muy instructiva.
La situación no ha cambiado mucho a lo largo de los años. Falta de conocimiento de la importancia de este parámetro clave y cómo verificar los indicadores, falta de interpretación correcta y Medidas necesarias puede y tendrá consecuencias desastrosas. Lo que ha cambiado significativamente es la disponibilidad en el mercado y la asequibilidad de los métodos e instrumentos de medición de pH. En este artículo, veremos algunos de ellos, comparando sus ventajas y desventajas.
determinación del pH
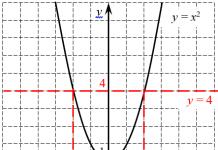
El pH es una evaluación de la naturaleza ácida o alcalina de una sustancia, expresada en una escala de 0 a 14, donde 0 es muy ácido y 14 es muy alcalino. Ambiente neutro (no ácido ni alcalino) - indicador 7 en esta escala. Los iones de hidrógeno predominan en valores de pH ácidos, mientras que los iones de hidróxido dominan en condiciones alcalinas.Figura 1. La escala de pH es logarítmica y representa el grado de actividad de los iones de hidrógeno.
Dependiendo de la fuente, pH significa "potencial de hidrógeno" o el término francés "pouvoir hydrogène" que significa "energía de hidrógeno".
Importancia de medir el pH
El pH es una característica de los líquidos (en nuestro caso) que afecta a su composición química, en concreto, la solubilidad de los nutrientes (bueno, si no nos vamos demasiado lejos). Un pH bajo puede hacer que los metales pesados potencialmente tóxicos se vuelvan solubles. El pH afecta la actividad enzimática (tienen un rango de pH preferido). Un pH alto es capaz de disolver las membranas lipídicas de las células. En organismos acuáticos también hay un rango de pH preferido. Breve reseña Los valores de pH en varios ambientes (de interés para los acuaristas) se presentan en la Tabla 1.| fuente de pH | pH |
|---|---|
| Río Río Negro | 5.1 |
| Agua de lluvia | 5.6 |
| Río Amazonas (agua ligera) | 6.9 |
| Agua potable | 7 |
| Agua de mar | 8.2 |
| Lago Tanganica (superficie) | 9 |
medición de pH
Hay varias formas de determinar el pH. Cada uno de ellos tiene sus propias ventajas y desventajas. Vamos a empezar con el más barato.Papel de tornasol
El tornasol es un material obtenido de los líquenes (el nombre proviene de la palabra nórdica antigua litmosi, que significa "pintura" y "musgo/liquen"). Este derivado del tornasol cambia de color de manera predecible cuando se expone a diferentes niveles de pH. Esta sensibilidad hace que el tornasol sea una forma fácil y económica de determinar el pH. El papel tornasol es un papel al que se le han agregado estos tintes solubles en agua, y el cambio de color causado al sumergir el papel tornasol en una muestra de agua indica un ambiente ácido o alcalino. El rango operativo para las mediciones de pH es de aproximadamente 5 a 8. La prueba de cambio de color debe realizarse con iluminación de espectro completo.

Figura 2. El papel tornasol es una forma económica pero aproximada de medir el pH.
Ventajas: económico (alrededor de 5 US). Rápido, fácil de usar.
Desventajas: Da cifras aproximadas. El resultado se ve afectado por el color de la muestra de agua, agentes reductores y agentes oxidantes. Interpretar los resultados requiere una visión aguda. La vida útil del reactivo es limitada.
Colorantes indicadores
Hay muy pocos indicadores de pH de este tipo. Puedes comprarlos en forma de polvo o líquido. Por lo general, se usan en análisis que involucran titulación. A continuación se detallan las características de algunos de ellos:
Fenolftaleína: Un indicador ácido/alcalino que se vuelve incoloro en un ambiente ácido y rosa-rojo en un ambiente alcalino. Rango de medición ~8,3 a 10.
Naranja de metilo (heliantina, colorante azoico ácido): cambia de color de amarillo a rojo con un pH de alrededor de 3,7.
Meta-Cresol Violet: Naranja-amarillo a 7.4 y cambia de color a violeta a mayor altos índices pH (hasta alrededor de 8.8.)
Azul de bromotimol: azul a 7,5, verdoso a ~6,2 - 6,8 y amarillo a alrededor de 6.
Indicador Versátil: Combina múltiples indicadores para permitir la evaluación de una amplia gama de pH.

Figura 3. Esta prueba de pH de API utiliza meta-cresol violeta como indicador.
Es deseable evaluar el cambio de color con luz natural sobre un fondo blanco.
Beneficios: Relativamente económico (~$10 USD) Algunos colorantes se pueden usar para otras pruebas (p. ej., alcalinidad) sin usar un electrodo de pH cuando se usa un reactivo.
Desventajas: Igual que papel de tornasol. Los tintes individuales tienen un rango de pH limitado. Los resultados pueden verse afectados por la turbidez y/o el color del líquido de prueba. La comparación debe llevarse a cabo sobre un fondo blanco con iluminación de espectro completo. Los reactivos tienen una vida útil limitada: debe haber una marca en la fecha de vencimiento.
electrodos de pH
Sé que es difícil de imaginar para los acuaristas principiantes, pero hace 30 años los acuaristas fuera de Europa apenas escuchaban sobre el uso de electrodos de pH. La situación cambió en la década de 1980 cuando empresa alemana(Dupla GmbH) comenzó a exportar equipos avanzados a Norteamérica. Hoy en día, los medidores de pH se utilizan en todas partes. La disponibilidad de dispositivos y la competencia entre los fabricantes contribuyeron a que el precio se volviera bastante asequible.
El electrodo de pH es un sensor selectivo de iones de hidrógeno (H+). Los electrodos de pH en realidad usan dos electrodos, una sonda (electrodo indicador) y un electrodo de referencia. Por regla general, estos dos electrodos se encuentran en una sola carcasa ("cuerpo") del electrodo. Al final del cuerpo del electrodo, la sonda tiene una fina capa de vidrio sensible al hidrógeno. El voltaje de la sonda varía según la actividad de los iones de hidrógeno (el voltaje aumenta en un ambiente ácido y disminuye en un ambiente alcalino). El electrodo de referencia proporciona un voltaje constante, que usamos para determinar la diferencia con la sonda. La respuesta total de mV se envía a un instrumento de medición (medidor) donde se convierte en un valor de pH.
Estructura y terminología del sensor
Para comprender cómo funciona un electrodo de pH, es necesario comprender algunos de los términos que se utilizan tanto para describir su diseño como otros.
Carcasa (cuerpo del electrodo): un tubo hueco que contiene las partes activas del electrodo de pH. El cuerpo puede estar hecho de vidrio o de un plástico químicamente resistente como la poliesterimida.
Amortiguador: En nuestro caso, solucion estandar, que muestra un pH ácido, neutro o alcalino, se utiliza para calibrar el medidor de pH. Para facilitar la identificación, algunas soluciones tampón están codificadas por colores.
Calibración: El proceso de verificar o ajustar la calibración de un instrumento analítico.
Conexión (unión, soldadura): Combinación de dos partes; en este caso, material de prueba y solución interna de control. Las conexiones se hacen de varios materiales; Los materiales deben ser porosos para permitir el paso de la solución de control. Típicamente, se utilizan cerámica, tela y similares. Hay electrodos con conexiones de uno, dos y anillos.
Frita: Vidrio o cerámica parcialmente fundido, a veces utilizado como junta.
ATC: Compensación automática de temperatura. Dado que el pH de una solución depende de la temperatura, ATC corrige los efectos de la temperatura. ATC requiere un sensor de temperatura, que se puede integrar en el electrodo cerca del bulbo de vidrio.
Electrodo de referencia: un electrodo que proporciona un voltaje constante conocido; generalmente hecho de alambre de cloro-plata y lleno de un electrolito tampón.
Sonda: Alambre de cloro-plata en un tubo con un bulbo de vidrio sensible al pH en el extremo.


Figura 4 Detalles internos electrodo de pH.
Para mayor claridad, no se muestra la cubierta protectora (tapa) que rodea el frágil matraz de vidrio.
Algunos electrodos de pH tienen una conexión lateral
Hay varios tipos de electrodos. Algunos electrodos, generalmente más antiguos (raramente vistos ahora en mi experiencia) consisten en dos carcasas separadas. Actualmente, la mayoría de los electrodos son sensores combinados, donde el ánodo y el cátodo se ubican por separado en una sola carcasa. La forma del bulbo de vidrio a menudo determina lo que medirá el electrodo. Los matraces esféricos, con su gran superficie, son muy adecuados para mediciones multipropósito (universales) en entornos acuáticos. Los matraces cónicos son capaces de penetrar materiales semisólidos (como carne y otros alimentos) y suelo. Se pueden usar "frascos" de vidrio plano para medir el pH diferentes tipos cuero, etc Algunos electrodos son reutilizables, mientras que otros no, están llenos de geles químicos. Algunos electrodos tienen conexiones y sondas extraíbles (reemplazables).
Una breve descripción de los medidores de pH
Nuestra revisión se centra en los medidores de pH fabricados por Hanna Instruments (Woonsocket, Rhode Island, EE. UU.). Hanna ha estado en el mercado desde 1978 y hoy ofrece más de 3000 variantes de productos a sus clientes en todo el mundo. Algunos de los productos de la empresa son de interés para los acuaristas.Todos los medidores de pH de Hanna que aparecen en esta revisión se suministran con un tampón de calibración, una solución de limpieza de electrodos y un estuche. Comencemos nuestra revisión con:
Comprobador de pH (HI98103)

Figura 5. Comprobador de pH asequible de Hanna Instruments.
El medidor de pH básico HI98103 Checker® será una valiosa adición a la caja de herramientas de muchos acuaristas. El dispositivo ofrece 0,1 unidades de pH. resolución a un precio asequible. Precio pagable debido a que el instrumento solo ofrece dos puntos de calibración (pH 4.01 y 7.01 o 7.01 y 10.01) sin compensación automática de temperatura (ATC) o la capacidad de medir la temperatura. Debido a que generalmente se recomienda que los puntos de calibración reflejen el pH esperado, este dispositivo es más adecuado para sistemas de agua dulce que imitan ambientes ácidos, como los biotopos amazónicos (a pesar de que ciertamente es capaz de medir valores de pH que son típicos de los arrecifes). y sistemas con cíclidos africanos, aunque con menos precisión debido a solo dos puntos de calibración). El electrodo es reemplazable y la conexión es de papel.Rango: 0 a 14 unidades
Resolución: 0,1 unidades
Precisión: ±0,2 unidades
Puntos de calibración (graduación): Dos; pH 4,01, 7,01 o 10,01
Compensación automática de temperatura: No
Medición/pantalla de temperatura: ninguna
Sonda reemplazable: Sí
Diámetro del electrodo: 8 mm (~5/16")
Tamaño de LCD: 3/8" (~10 mm)
Batería: 1-CR2032; recurso aproximadamente 1000 h.
pHep pH y sensor de temperatura(HI98107)

Figura 6. Dispositivo pHep con tampones de calibración en su estuche.
El probador de pH y temperatura pHep HI98107 es una versión más moderna del comprobador de pH (descrito anteriormente). Además de determinar el pH en el rango de casi cualquier acuario, desde el biotopo amazónico hasta el arrecife, el dispositivo también mide la temperatura con compensación automática de temperatura (ATC). El dispositivo incluye dos tampones de calibración (4.01 y 7.01) con un disponible tercero - (10.01, que se recomienda para acuarios de arrecife). La conexión está hecha de papel. El electrodo no es reemplazable.Rango: 0 a 14 unidades
Resolución: 0,1 unidades
Precisión: ±0,1 unidades
Puntos de calibración: tres; pH 4.01, 7.01 y 10.01 (4.01 y 10.01 presentados)
Sensor reemplazable: Sí
Tamaño de la pantalla LCD: 0,3125" o ~8 mm
Batería: 1-CR2032; aproximadamente 800 horas.
Sensor de temperatura y pH a prueba de agua pHep5 (HI98128)
Figura 7. pHep ofrece muchas funciones: medición de pH y temperatura, ATC; ¡Y flota en la superficie del agua!
El medidor de pH HI98128 pHep 5 es el medidor de pH de bolsillo más avanzado de Hanna. El dispositivo ofrece una resolución de 0,01 unidades. con una precisión de ±0,05 y compensación automática de temperatura. El dispositivo es resistente al agua y flota en la superficie del agua. El dispositivo ofrece un enfoque flexible para dimensiones importantes, porque capaz de reconocer 5 tampones de calibración diferentes.Rango: -2 a 16 unidades
Resolución: 0,01 unidades
Precisión: ±0,05u
Puntos de calibración: Dos opciones: 4.01, 7.01, 10.01 o 6.86, 9.18.
Compensación automática de temperatura: Sí
Pantalla de temperatura: Sí, se puede configurar °F o °C, con una precisión de ±0,5 °C.
Sonda reemplazable: Sí
Tamaño de LCD: 0,3125" o ~8 mm (tamaño de carácter)
Batería: baterías de 4-1.5v; aproximadamente 300 h.
Medidor de pH de campo inalámbrico HALO (HI12302)

Figura 8. Posiblemente el electrodo de pH más avanzado del mercado, el electrodo inalámbrico HALO.
El medidor de pH de campo Halo HI12302 es un medidor interesante que ofrece muchas posibilidades. En primer lugar, es un electrodo de pH inalámbrico que se puede controlar a través de Bluetooth desde dispositivos Android o iOS. Incluso los usuarios inseguros no deberían preocuparse. En mi experiencia, la configuración es increíblemente fácil. Abrí el sitio web de Hanna Instruments, seguí el enlace de HALO y descargué la aplicación para mi teléfono inteligente. Una vez que se instaló la aplicación (descarga gratuita, toma alrededor de 2 minutos), abrí la aplicación y el software reconoció mi electrodo de pH HALO. A continuación, todo lo que se requiere es seleccionar los íconos apropiados para la calibración de electrodos, mostrar datos gráficos, ver datos de sensores, etc. Creo sinceramente que no podría ser más fácil. El software mide el pH y la temperatura cada segundo. El registro de datos proporciona la identificación del electrodo, la fecha de calibración, los puntos de calibración, la curva de calibración, la fecha y hora de la medición, el pH, la temperatura, los milivoltios, etc. (Ver Figuras 9-11).Las opciones de sonda incluyen esférica (universal y acuática), cónica (para productos, semisólidos, suelo, etc.) y punta plana (para cuero, papel, etc.) Carcasa de plástico HALO hecha de polieterimida (PEI) aprobada para contacto con productos alimenticios e inmune a cualquier cosa que pueda usar el frigorífico (a menos que esté completamente "fuera del circuito" y dosifique aromáticos y/o solventes parcialmente halogenados en su sistema).
Rango: 0 a 14 unidades
Resolución: configurable por el usuario: 0.1, 0.01 o .001 unidades.
Precisión: ±0,005 unidades
Puntos de calibración: siete; pH 1,68, 4,01, 6,86, 7,01, 91,8, 10,01 y 12,45.
Compensación automática de temperatura: Sí
Sonda de repuesto: ninguna
Diámetro del electrodo: 12 mm (~1/2")
Registro de datos: Sí
Batería: batería de litio, 500 h.

Figura 10. En el modo de registro de datos, las lecturas de pH obtenidas con el electrodo HALO se pueden ver en forma tabular o...

Figura 11. ... en forma de gráfico. Las notas son posibles y los datos se pueden transferir a hojas de cálculo de Excel.
Puede verificar si su teléfono o tableta es compatible con HALO aquí: http://hannainst.com/halo
Puede encontrar más información sobre los productos de Hanna Instruments aquí: http://hannainst.com
Todas las sondas y electrodos Hanna vienen con una garantía de 6 meses.
Otras Consideraciones
Ahora te hablaré brevemente de otros aspectos que debes tener en cuenta a la hora de comprar un medidor o electrodo de pH.Conectores (adaptadores)
Los dispositivos de pH con electrodos separados deben conectarse al instrumento mediante un conector (excepto cuando se trata de dispositivos con conexión inalámbrica, como Hanna HALO). Y aunque el aspecto parece insignificante, puede tener consecuencias a largo plazo y posiblemente costosas. . Algunos fabricantes utilizan conectores especializados para garantizar el uso continuo y la compra de sus electrodos. El más común es el conector rápido Bayonet Neill-Concelman (BNC). El conector estadounidense es menos común. Algunos dispositivos fabricados en Europa utilizan el conector S7.
Conexiones
La unión en el electrodo de pH es el punto de intersección (encuentro) de dos mundos: la solución interna del sensor y la muestra bajo prueba. Hay términos especializados que se utilizan para describir compuestos, su estructura y geometría. Como se discutió, las conexiones permiten que la solución de control del electrodo ingrese a la solución de prueba. En este sentido, están sujetos a contaminación, colmatación, especialmente en el caso de muestras aceitosas, o muestras con alto contenido proteína o suspensiones (soluciones con una suspensión). Algunos electrodos utilizan una conexión de tejido. Los electrodos más caros usan poroso materiales cerámicos. Algunas conexiones están hechas de plástico PTFE (politetrafluoroetileno) y están diseñadas para su uso en entornos hostiles, incluidos entornos con alto contenido de hidrocarburos. Las juntas de PTFE a veces son bastante grandes y se asemejan a un anillo alrededor de un bulbo de vidrio (las juntas de cerámica suelen ser pequeñas, de solo 1 mm de diámetro). Cualquier conexión puede contaminarse.
Afortunadamente, para los acuaristas de arrecife, las sondas de pH universales con conexiones de tela o cerámica están bien.
Limpieza de electrodos de pH
Siempre vale la pena recordar que los electrodos son dispositivos para investigación científica y requieren un cuidado adecuado. Y aunque el cuerpo de plástico es bastante duradero, la bombilla de vidrio es muy frágil: un manejo descuidado puede provocar que se rompa. Los electrodos que se usan ocasionalmente no requieren una limpieza frecuente; sin embargo, si su electrodo está permanentemente sumergido en "sopa orgánica" (como en algunos acuarios), se recomienda a los acuaristas que limpien el electrodo con regularidad. Sucede que la sonda está cubierta con incrustaciones biológicas y proteínas. La alimentación (y las fallas catastróficas de las bombas sumergibles) agregan grasas al agua del acuario, lo que también contribuye al ensuciamiento del electrodo. Afortunadamente, las soluciones de limpieza ayudan a mantener la funcionalidad de los electrodos. Siga las instrucciones del fabricante. No frote el electrodo; siempre séquelo para evitar descargas estáticas.
Electrodos de gel rellenables y no rellenables
Algunos electrodos se pueden rellenar con soluciones especialmente formuladas, mientras que otros electrodos se rellenan con gel. En general, los sensores de gel son más lentos para responder a los cambios de pH. La mayoría de los sensores diseñados para uso en acuarios están llenos de gel.
Calibración
La calibración correcta del electrodo de pH es condición necesaria para obtener resultados precisos. El proceso se simplifica si el instrumento ofrece compensación automática de temperatura (ATC). Las figuras 12 a 14 muestran ejemplos del efecto de la temperatura en un estándar de calibración (referencia).

Figura 12. Efecto de la temperatura en el tampón de hidroftalato de potasio 4.01.

Figura 13. Efecto de la temperatura sobre el pH del tampón de dihidrogenofosfato de potasio/dihidrogenofosfato (6.865). Afortunadamente, las calibraciones de temperatura ambiente son bastante precisas si se utiliza un instrumento que no sea ATC.

Figura 14. El pH de este tampón (bicarbonato de sodio/carbonato de sodio) puede verse afectado por la temperatura (otro caso para usar un dispositivo ATC). El dióxido de carbono de la atmósfera ataca la solución con el tiempo.
La calibración adecuada de un electrodo de pH requiere un poco de paciencia y atención a los detalles. Los transductores nuevos deben hidratarse adecuadamente (consulte las instrucciones de su instrumento). A pesar de que es posible una calibración de un solo punto, es deseable realizar una calibración de 2 puntos (entre los cuales debería estar el pH esperado). Para acuarios de arrecife, use los tampones 7.01 y 9 o 10. Tenga en cuenta que algunos instrumentos pueden reconocer automáticamente los tampones y, por lo tanto, requieren el uso de soluciones especiales. Antes de la calibración, verifique que el electrodo no esté dañado (especialmente el bulbo de vidrio). No debe haber bioincrustaciones en el bulbo de vidrio. Si está disponible, use una solución de limpieza recomendada por el fabricante. En limpieza adecuada se eliminará la bioincrustación, la grasa, la contaminación por proteínas, etc. El electrodo, si es recargable, debe llenarse con una solución recomendada por el fabricante. Cuando el electrodo esté limpio y en buenas condiciones, colóquelo en la primera solución de calibración. Asegúrese de que el bulbo de vidrio del electrodo y la conexión estén completamente sumergidos en la solución de calibración (utilizo un vaso de precipitados de 30 mm donde 7 mm de tampón son suficientes para la calibración). Revuelva la solución vigorosamente con el electrodo (si no hay un agitador magnético disponible) y espere hasta que la temperatura del electrodo y la solución sean iguales. Ingrese el valor en la memoria del instrumento (por lo general, se debe presionar el botón cuando el instrumento está en modo de calibración). Enjuague el electrodo con agua destilada y séquelo con una toalla de papel (preferiblemente toallitas de laboratorio como Kimwipes). NUNCA limpie los electrodos con papel; se puede crear electricidad estática y afectar la calibración y, por lo tanto, las lecturas. En el caso de un solo punto de calibración, el proceso está completo. En el caso de 2 o 3 puntos de calibración, se debe repetir el procedimiento. Al medir el pH de una muestra de agua, revuelva la solución manualmente o con un agitador y deje tiempo para la compensación de temperatura. En la práctica de laboratorio, se recomienda registrar el pH y la temperatura.
Envejecimiento de tampones de calibración
Como ocurre con la mayoría de los productos químicos, los amortiguadores de pH se deterioran con el tiempo. Algunos amortiguadores se fabrican para que sean resistentes al cambio y tengan una larga vida útil (varios años). Elija tampones que tengan fecha de caducidad en el envase. La vida útil de los tampones de carbonato es generalmente más corta que la de los tampones alcalinos o ácidos debido a la exposición al dióxido de carbono en el aire. Los tampones que hayan estado en contacto con el electrodo durante la calibración deben desecharse. Si nota que el tampón se está enmoheciendo (generalmente alrededor de 4 tampones), deséchelo. No utilice tampones para corregir el pH de su acuario.
Almacenamiento de electrodos de pH
Almacene los sensores de pH correctamente. Lo más importante es que el bulbo de vidrio debe permanecer hidratado. En segundo lugar, la solución madre no debe permitir la ósmosis entre la propia solución y la solución interna/gel de electrodo. Además, debe contener un componente antimicrobiano que evite la aparición de moho y ensuciamiento.
Los tampones de calibración de pH, las soluciones madre y los accesorios necesarios se pueden encontrar aquí: http://hannainst.com/ph-solutions
Recursos y blogs de pH de Hanna Instruments
1.2. Guías y listas de verificación de electrodos de pH
3. Los 10 principales errores en las mediciones de pH
4.