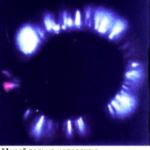
Experiencia química de bromo con aluminio.
Si se colocan unos pocos mililitros de bromo en un tubo de ensayo hecho de vidrio resistente al calor y se introduce cuidadosamente un trozo de papel de aluminio, luego de un tiempo (necesario para que el bromo penetre a través de la película de óxido), se producirá una reacción violenta. empezar. A partir del calor liberado, el aluminio se derrite y, en forma de una pequeña bola de fuego, rueda sobre la superficie del bromo (la densidad del aluminio líquido es menor que la densidad del bromo), disminuyendo rápidamente de tamaño. El tubo de ensayo está lleno de vapor de bromo y humo blanco, que consta de los cristales más pequeños de bromuro de aluminio:
2Al+3Br2 → 2AlBr3.
También es interesante observar la reacción del aluminio con el yodo. Mezclar en una taza de porcelana una pequeña cantidad de polvo de yodo con polvo de aluminio. Si bien la reacción no se nota: en ausencia de agua, avanza extremadamente lentamente. Con una pipeta larga, deje caer unas gotas de agua sobre la mezcla, que desempeña el papel de iniciador, y la reacción procederá vigorosamente, con la formación de una llama y la liberación de vapores púrpuras de yodo.
Experimentos químicos con pólvora: ¡cómo explota la pólvora!
 Pólvora
Pólvora La pólvora ahumada o negra es una mezcla de nitrato de potasio (nitrato de potasio - KNO 3), azufre (S) y carbón (C). Se enciende a una temperatura de unos 300 °C. La pólvora también puede explotar al impactar. Se compone de un agente oxidante (nitrato) y un agente reductor (carbón vegetal). El azufre también es un agente reductor, pero su función principal es unir el potasio en un compuesto fuerte. Durante la combustión de la pólvora se produce la siguiente reacción:
2KNO 3 + ЗС + S → K 2 S + N 2 + 3СО 2,
- como resultado de lo cual se libera un gran volumen de sustancias gaseosas. El uso de pólvora en asuntos militares está relacionado con esto: los gases formados durante la explosión y que se expanden por el calor de la reacción empujan la bala fuera del cañón de la pistola. Es fácil verificar la formación de sulfuro de potasio oliendo el cañón de una pistola. Huele a sulfuro de hidrógeno, un producto de la hidrólisis del sulfuro de potasio.
Experimentos químicos con salitre: inscripción ardiente
Espectacular experiencia química Se puede realizar con nitrato de potasio. Permítanme recordarles que los nitratos son sustancias complejas: sales de ácido nítrico. En este caso, necesitamos nitrato de potasio. Su fórmula química es KNO 3 . En una hoja de papel, dibuje un contorno, un dibujo (para un mayor efecto, ¡deje que las líneas no se crucen!). Preparar una solución concentrada de nitrato de potasio. Para información: en 15 ml agua caliente Se disuelven 20 g de KNO3. Luego, con un pincel, impregnamos el papel a lo largo del contorno dibujado, sin dejar espacios ni espacios. deja que el papel se seque. Ahora debe tocar una astilla ardiente en algún punto del contorno. Inmediatamente aparecerá una "chispa", que se desplazará lentamente por el contorno del cuadro hasta cerrarlo por completo. Esto es lo que sucede: el nitrato de potasio se descompone según la ecuación:
2KNO3 → 2KNO2 + O2.
Aquí KNO 2 +O 2 es una sal de ácido nitroso. A partir del oxígeno liberado, el papel se carboniza y se quema. Para mayor efecto, el experimento se puede llevar a cabo en una habitación oscura.
Experiencia química de disolución de vidrio en ácido fluorhídrico
 El vidrio se disuelve
El vidrio se disuelve en ácido fluorhídrico
De hecho, el vidrio se disuelve fácilmente. El vidrio es un líquido muy viscoso. El hecho de que el vidrio se pueda disolver se puede verificar haciendo lo siguiente reacción química. El ácido fluorhídrico es un ácido formado al disolver fluoruro de hidrógeno (HF) en agua. También se le llama ácido fluorhídrico. Para mayor claridad, tomemos una mota delgada, en la que colocamos un peso. Bajamos el vaso con un peso en una solución de ácido fluorhídrico. Cuando el vidrio se disuelva en el ácido, el peso caerá al fondo del matraz.
Experimentos químicos con emisión de humo
 Reacciones químicas con
Reacciones químicas con emisión de humo
(cloruro amónico)
Hagamos un hermoso experimento para obtener un humo blanco espeso. Para hacer esto, debemos preparar una mezcla de potasa (carbonato de potasio K 2 CO 3) con una solución de amoníaco (amoníaco). Mezclar los reactivos: potasa y amoníaco. Añadir una solución a la mezcla resultante. de ácido clorhídrico. La reacción comenzará ya en el momento en que el matraz con ácido clorhídrico se acerque al matraz que contiene amoníaco. Agregue cuidadosamente ácido clorhídrico a la solución de amoníaco y observe la formación de un vapor blanco espeso de cloruro de amonio, cuya fórmula química es NH 4 Cl. La reacción química entre el amoníaco y el ácido clorhídrico procede de la siguiente manera:
HCl + NH 3 → NH 4 Cl
Experimentos químicos: el brillo de las soluciones
 Solución de reacción de brillo
Solución de reacción de brillo Como se señaló anteriormente, el brillo de las soluciones es un signo de una reacción química. Realicemos otro experimento espectacular, en el que nuestra solución brillará. Para la reacción, necesitamos una solución de luminol, una solución de peróxido de hidrógeno H 2 O 2 y cristales de sal de sangre roja K 3. Luminol- una sustancia orgánica compleja, cuya fórmula es C 8 H 7 N 3 O 2. Luminol es altamente soluble en algunos solventes orgánicos, mientras que no se disuelve en agua. El resplandor se produce cuando el luminol reacciona con algunos agentes oxidantes en un medio alcalino.
Entonces, comencemos: agregue una solución de peróxido de hidrógeno al luminol, luego agregue un puñado de cristales de sal de sangre roja a la solución resultante. Para un mayor efecto, ¡intente realizar el experimento en una habitación oscura! Tan pronto como los cristales de sal de color rojo sangre toquen la solución, se notará inmediatamente un brillo azul frío, lo que indica el curso de la reacción. El brillo en una reacción química se llama quimioluminiscencia
Otro experiencia química con soluciones luminosas:
Para ello, necesitamos: hidroquinona (antiguamente utilizada en equipos fotográficos), carbonato de potasio K 2 CO 3 (también conocido como "potasa"), solución de farmacia de formalina (formaldehído) y peróxido de hidrógeno. Disolver 1 g de hidroquinona y 5 g de carbonato de potasio K 2 CO 3 en 40 ml de formalina farmacéutica (solución acuosa de formaldehído). Vierta esta mezcla de reacción en un matraz o botella grande con una capacidad de al menos un litro. En un recipiente pequeño, prepare 15 ml de solución concentrada de peróxido de hidrógeno. Puede usar tabletas de hidroperita, una combinación de peróxido de hidrógeno con urea (la urea no interferirá con el experimento). Para más efecto, vaya a cuarto oscuro cuando sus ojos se hayan acostumbrado a la oscuridad, vierta la solución de peróxido de hidrógeno en buque grande con hidroquinona. ¡La mezcla comenzará a formar espuma (de ahí la necesidad de un recipiente grande) y aparecerá un brillo naranja distintivo!
Las reacciones químicas en las que aparece el resplandor no ocurren solo durante la oxidación. A veces, el brillo se produce durante la cristalización. La forma más fácil de observarlo es la sal de mesa. Disuelva la sal de mesa en agua y tome suficiente sal para que los cristales sin disolver permanezcan en el fondo del vaso. Vierta la solución saturada resultante en otro vaso y agregue gota a gota ácido clorhídrico concentrado a esta solución. La sal comenzará a cristalizar y saltarán chispas a través de la solución. ¡Es más hermoso si la experiencia se desarrolla en la oscuridad!

Experimentos químicos con cromo y sus compuestos
¡Cromo multicolor!... El color de las sales de cromo puede cambiar fácilmente de púrpura a verde y viceversa. Hagamos la reacción: disolvamos en agua unos cristales violetas de cloruro de cromo CrCl 3 6H 2 O. Al hervir, la disolución violeta de esta sal se vuelve verde. Cuando se evapora la solución verde, se forma un polvo verde de la misma composición que la sal original. Y si satura una solución verde de cloruro de cromo enfriada a 0 ° C con cloruro de hidrógeno (HCl), su color volverá a ser púrpura. ¿Cómo explicar el fenómeno observado? Este es un raro ejemplo de isomería en química inorgánica: la existencia de sustancias que tienen la misma composición, pero diferente estructura y propiedades. En la sal violeta, el átomo de cromo está unido a seis moléculas de agua, y los átomos de cloro son contraiones: Cl 3, y en el cloruro de cromo verde cambian de lugar: Cl 2H 2 O. En un ambiente ácido, los dicromatos son fuertes agentes oxidantes. Sus productos de recuperación son iones Cr3+:
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3K 2 SO 3 → Cr 2 (SO 4) 3 + 4K 2 SO 4 + 4H 2 O.
 Cromato de potasio (amarillo)
Cromato de potasio (amarillo) bicromato - (rojo)
A baja temperatura, de la solución resultante se pueden aislar cristales violetas de alumbre de cromo y potasio KCr (SO 4) 2 · 12H 2 O. La solución de color rojo oscuro que se obtiene al agregar ácido sulfúrico concentrado a una solución acuosa saturada de dicromato de potasio se denomina "crómico". cima". En laboratorios, se utiliza para el lavado y desengrasado de cristalería química. Los platos se enjuagan cuidadosamente con cromo, que no se vierte en el fregadero, sino que se usa repetidamente. Al final, la mezcla se vuelve verde: todo el cromo en dicha solución ya pasó a la forma Cr 3+. Un agente oxidante particularmente fuerte es el óxido de cromo (VI) CrO 3 . Con él, puedes encender una lámpara de alcohol sin fósforos: basta con tocar la mecha humedecida con alcohol con un palito con varios cristales de esta sustancia. Cuando el CrO 3 se descompone, se puede obtener CrO 2 en polvo de óxido de cromo (IV) de color marrón oscuro. Tiene propiedades ferromagnéticas y se utiliza en las cintas magnéticas de algunos tipos de casetes de audio. El cuerpo de un adulto contiene solo alrededor de 6 mg de cromo. Muchos compuestos de este elemento (especialmente los cromatos y dicromatos) son tóxicos, y algunos de ellos son cancerígenos, es decir, capaz de causar cáncer.
Experimentos químicos: las propiedades reductoras del hierro.

Cloruro férrico III
Este tipo reacción química se refiere a reacciones redox. Para llevar a cabo la reacción, necesitamos soluciones acuosas diluidas (5%) de cloruro de hierro (III) FeCl 3 y la misma solución de yoduro de potasio KI. Entonces, se vierte una solución de cloruro de hierro (III) en un matraz. Luego agregue unas gotas de solución de yoduro de potasio. Observe el cambio de color de la solución. El líquido tomará un color marrón rojizo. Las siguientes reacciones químicas tendrán lugar en la solución:
2FeCl 3 + 2KI → 2FeCl 2 + 2KCl + I 2
KI + YO 2 → K
 Cloruro férrico II
Cloruro férrico II Otro experimento químico con compuestos de hierro. Para ello, necesitamos soluciones acuosas diluidas (10–15%) de sulfato de hierro (II) FeSO 4 y tiocianato de amonio NH 4 NCS, agua de bromo Br 2. Empecemos. Vierta una solución de sulfato de hierro (II) en un matraz. También se agregan 3-5 gotas de solución de tiocianato de amonio. Notamos que no hay signos de reacciones químicas. Por supuesto, los cationes de hierro (II) no forman complejos coloreados con iones de tiocianato. Ahora agregue agua de bromo a este matraz. Pero ahora los iones de hierro "se soltaron" y colorearon la solución de un color rojo sangre. así reacciona el ion (III) del hierro de valencia con los iones tiocianato. Esto es lo que sucedió en el matraz:
Fe(H 2 O) 6 ] 3+ + n NCS– (n–3) – + n H 2 O
Experimento químico sobre la deshidratación del azúcar con ácido sulfúrico
 Deshidratación de azúcar
Deshidratación de azúcar ácido sulfúrico
El ácido sulfúrico concentrado deshidrata el azúcar. El azúcar es una sustancia orgánica compleja cuya fórmula es C 12 H 22 O 11. Así es como funciona. El azúcar en polvo se coloca en un vaso de precipitados alto, ligeramente humedecido con agua. Luego se agrega un poco de ácido sulfúrico concentrado al azúcar húmedo. mezclar suave y rápidamente con una varilla de vidrio. Se deja el palito en medio del vaso con la mezcla. Después de 1 a 2 minutos, el azúcar comienza a ennegrecerse, hincharse y elevarse en forma de una masa negra voluminosa y suelta, llevándose consigo la varilla de vidrio. La mezcla en el vaso se calienta mucho y humea un poco. En esta reacción química, el ácido sulfúrico no solo elimina el agua del azúcar, sino que también la convierte parcialmente en carbón.
C 12 H 22 O 11 + 2H 2 SO 4 (conc.) → 11C + CO 2 + 13H 2 O + 2SO 2
El agua liberada durante una reacción química de este tipo es absorbida principalmente por ácido sulfúrico (el ácido sulfúrico absorbe agua "con avidez") con la formación de hidratos, de ahí la fuerte liberación de calor. PERO dióxido de carbono El CO 2 , que se obtiene durante la oxidación del azúcar, y el dióxido de azufre SO 2 elevan la mezcla de carbonización.
Experimento químico con la desaparición de una cuchara de aluminio.
Realicemos otra divertida reacción química: para ello necesitamos una cuchara de aluminio y nitrato de mercurio (Hg (NO 3) 2). Entonces, tomemos una cuchara, límpiela con un grano fino papel de lija luego desengrasar con acetona. Sumerja una cuchara durante unos segundos en una solución de nitrato de mercurio (Hg (NO 3) 2). (¡recuerde que los compuestos de mercurio son venenosos!). Tan pronto como la superficie de la cuchara de aluminio en la solución de mercurio se vuelva gris, se debe quitar la cuchara, lavarla con agua hervida y secar (mojar, pero no limpiar). Después de unos segundos, la cuchara de metal se convertirá en copos blancos y esponjosos, y pronto solo quedará una pila grisácea de ceniza. Esto es lo que pasó:
Al + 3 Hg(NO 3) 2 → 3 Hg + 2 Al(NO 3) 3 .
En la solución, al comienzo de la reacción, aparece en la superficie de la cuchara una fina capa de amalgama de aluminio (una aleación de aluminio y mercurio). La amalgama luego se convierte en copos blancos esponjosos de hidróxido de aluminio (Al(OH) 3). El metal consumido en la reacción se repone con nuevas porciones de aluminio disuelto en mercurio. Y, finalmente, en lugar de una cuchara brillante, quedan en el papel polvo blanco de Al (OH) 3 y pequeñas gotas de mercurio. Si después de una solución de nitrato de mercurio (Hg (NO 3) 2) cuchara de aluminio inmediatamente sumergido en agua destilada, luego aparecerán burbujas de gas y escamas blancas en su superficie (se liberará hidrógeno e hidróxido de aluminio).
Tardecita química entretenida
Al preparar una velada química, se requiere una preparación cuidadosa del maestro para realizar experimentos.
La velada debe estar precedida por un trabajo largo y cuidadoso con los estudiantes, y no se le debe asignar a un estudiante más de dos experimentos.
El propósito de la noche de química.- repetir los conocimientos adquiridos, profundizar el interés de los estudiantes por la química e inculcarles habilidades prácticas para desarrollar e implementar experimentos.
Descripción de los principales escenarios de la velada de química entretenida.
I. Discurso introductorio del profesor sobre el tema "El papel de la química en la vida de la sociedad".
II. Entretenidos experimentos de química.
Liderazgo (el papel del líder lo realiza uno de los estudiantes del grado 10-11):
Hoy vamos a tener una velada de química entretenida. Tu tarea es seguir cuidadosamente los experimentos químicos y tratar de explicarlos. Y así, ¡comenzamos! Experiencia No. 1: "Volcán".
Experiencia número 1. Descripción:
Un participante por la noche vierte dicromato de amonio en polvo (en forma de portaobjetos) sobre una red de amianto, coloca varias cabezas de cerillas en la parte superior del portaobjetos y les prende fuego con una astilla.
Nota: El volcán se verá aún más espectacular si le agregas un poco de magnesio en polvo al bicromato de amonio. Mezcle los componentes de la mezcla inmediatamente, porque. el magnesio arde vigorosamente y al estar en un solo lugar provoca la dispersión de partículas calientes.
La esencia del experimento es la descomposición exotérmica del dicromato de amonio bajo calentamiento local.
No hay humo sin fuego, dice un viejo proverbio ruso. Resulta que con la ayuda de la química puedes obtener humo sin fuego. Y así, ¡atención!
Experiencia número 2. Descripción:
El participante de la velada toma dos varillas de vidrio, en las que se enrolla un poco de algodón, y las humedece: una en ácido nítrico (o clorhídrico) concentrado, la otra en una solución acuosa de amoníaco al 25%. Los palos deben llevarse uno al otro. El humo blanco se eleva de los palos.
La esencia de la experiencia es la formación de nitrato (cloruro) de amonio.
Y ahora presentamos a su atención la siguiente experiencia: "Papel de disparo".
Experiencia número 3. Descripción:
El participante de la velada saca trozos de papel sobre una hoja de madera contrachapada, los toca con una varilla de vidrio. Cuando tocas cada hoja, se escucha un disparo.
Nota: Se cortan por adelantado tiras estrechas de papel de filtro y se humedecen en una solución de yodo en amoníaco. Después de eso, las tiras se colocan sobre una lámina de madera contrachapada y se dejan secar hasta la noche. El disparo es más fuerte, mejor se impregna el papel con la solución y más concentrada estaba la solución de yoduro de nitrógeno.
La esencia del experimento es la descomposición exotérmica del frágil compuesto NI3*NH3.
tengo un huevo ¿Quién de ustedes lo pelará sin romper las cáscaras?
Experiencia número 4. Descripción:
El participante de la velada coloca el huevo en un cristalizador con una solución de ácido clorhídrico (o acético). Después de un tiempo, saca un huevo cubierto solo con una membrana de cáscara.
La esencia de la experiencia es que la composición del caparazón incluye principalmente carbonato de calcio. En ácido clorhídrico (acético), se convierte en cloruro de calcio soluble (acetato de calcio).
Chicos, tengo en mis manos una figura de hombre hecha de zinc. Vamos a vestirlo.
Experiencia número 5. Descripción:
El participante de la velada sumerge la figura en una solución de acetato de plomo al 10%. La estatuilla está cubierta con una capa esponjosa de cristales de plomo, que recuerda a las prendas de piel.
La esencia del experimento es que un metal más activo desplaza a un metal menos activo de las soluciones salinas.
Chicos, ¿es posible quemar azúcar sin la ayuda del fuego? ¡Vamos a revisar!
Experiencia número 6. Descripción:
El participante de la velada vierte azúcar glas (30 g) en un vaso colocado sobre un platillo, vierte 26 ml de ácido sulfúrico concentrado en el mismo lugar y remueve la mezcla con una varilla de vidrio. Después de 1-1,5 minutos, la mezcla en el vaso se oscurece, se hincha y se eleva por encima de los bordes del vaso en forma de una masa suelta.
La esencia del experimento es que el ácido sulfúrico elimina el agua de las moléculas de azúcar, oxida el carbono en dióxido de carbono y, al mismo tiempo, se forma dióxido de azufre. Los gases liberados empujan la masa fuera del vaso.
¿Qué métodos para hacer fuego conoces?
Se dan ejemplos de la audiencia.
Intentemos prescindir de estos fondos.
Experiencia número 7. Descripción:
Un participante en la noche vierte permanganato de potasio (6 g) molido en polvo en un trozo de lata (o un azulejo) y deja caer glicerina con una pipeta. Después de un tiempo, aparece un incendio.
La esencia del experimento es que, como resultado de la reacción, se libera oxígeno atómico y se enciende el glicerol.
Otro participante de la velada:
También obtendré fuego sin fósforos, solo que de una manera diferente.
Experiencia número 8. Descripción:
Un participante en la noche vierte una pequeña cantidad de cristales de permanganato de potasio en un ladrillo y gotea ácido sulfúrico concentrado sobre él. Alrededor de esta mezcla, dobla chips delgados en forma de fuego, pero para que no toquen la mezcla. Luego humedece un pequeño trozo de algodón con alcohol y, manteniendo la mano sobre el fuego, exprime unas gotas de alcohol del algodón para que caigan sobre la mezcla. El fuego se enciende al instante.
La esencia de la experiencia es la vigorosa oxidación del alcohol por el oxígeno, que se libera durante la interacción del ácido sulfúrico con el permanganato de potasio. El calor liberado durante esta reacción enciende el fuego.
Y ahora luces increíbles!
Experiencia número 9. Descripción:
El participante de la velada pone hisopos de algodón humedecidos con alcohol etílico en tazas de porcelana. En la superficie de los tampones, vierte las siguientes sales: cloruro de sodio, nitrato de estroncio (o nitrato de litio), cloruro de potasio, nitrato de bario (o ácido bórico). En un trozo de vidrio, el participante prepara una mezcla (slurry) de permanganato de potasio y ácido sulfúrico concentrado. Toma un poco de esta masa con una varilla de vidrio y toca la superficie de los tampones. Los tampones brillan y se queman en diferentes colores: amarillo, rojo, morado, verde.
La esencia de la experiencia es que los iones de metales alcalinos y alcalinotérreos colorean la llama en diferentes colores.
Queridos hijos, estoy tan cansada y hambrienta que os pido que me dejéis comer un poco.
Experiencia número 10. Descripción:
El anfitrión se dirige al participante de la velada:
Dame un poco de té y galletas, por favor.
El participante de la velada le da al anfitrión un vaso de té y una galleta blanca.
El anfitrión humedece la galleta en té; la galleta se vuelve azul.
Principal :
¡Deshonra, casi me envenenas!
Participante de la velada:
Disculpe, debo haber confundido los vasos.
La esencia del experimento: en el vaso había una solución de yodo. El almidón del pan se volvió azul.
Chicos, recibí una carta, pero había una hoja de papel en blanco en el sobre. ¿Quién puede ayudarme a averiguar qué está mal?
Experiencia número 11. Descripción:
Un estudiante de la audiencia (preparado de antemano) toca una astilla humeante con una marca de lápiz en una hoja de papel. El papel a lo largo de la línea del dibujo se quema lentamente y la luz, moviéndose a lo largo del contorno de la imagen, lo perfila (el dibujo puede ser arbitrario).
La esencia de la experiencia es que el papel arde por el oxígeno del salitre cristalizado en su espesor.
Nota: se aplica preliminarmente un dibujo a una hoja de papel con una solución fuerte de nitrato de potasio. Debe aplicarse en una línea continua sin intersecciones. Desde el contorno del dibujo con la misma solución, dibuje una línea hasta el borde del papel, marcando su extremo con un lápiz. Cuando el papel se seque, el patrón se volverá invisible.
Bueno, ahora, muchachos, pasemos a la segunda parte de nuestra velada. ¡Juegos de química!
tercero Juegos de equipo.
Se invita a los participantes de la velada a dividirse en grupos. Cada grupo participa en el juego propuesto.
Juego número 1. Lotería química.
Las fórmulas de las sustancias químicas están escritas en las tarjetas, que están dispuestas como en un loto normal, y los nombres de estas sustancias están escritos en cuadrados de cartón. Se entregan tarjetas a los miembros del grupo y uno de ellos saca los cuadrados y nombra las sustancias. El ganador es el miembro del grupo que primero cierra todos los campos de la tarjeta.
Juego número 2. Prueba química.
Una cuerda se estira entre los respaldos de dos sillas. Los dulces están atados con hilos, a los que se adjuntan trozos de papel con preguntas. Los miembros del grupo se turnan para cortar dulces con tijeras. El jugador se convierte en el dueño del caramelo después de responder la pregunta adjunta.
Los miembros del grupo forman un círculo. Tienen símbolos químicos y números en sus manos. Dos de los jugadores están en el medio del círculo. A la orden ellos componen fórmula química sustancias de signos y números en poder de los otros jugadores. Gana el participante que completa la fórmula más rápido.
Los miembros del grupo se dividen en dos equipos. Se les entregan tarjetas con fórmulas químicas y números. Deben escribir una ecuación química. El equipo que primero complete la ecuación gana.
La velada finaliza con la entrega de premios a los participantes más activos.
¿Quién no creía en los milagros de niño? Para pasar un tiempo divertido e informativo con su bebé, puede intentar realizar experimentos de química entretenida. Son seguros, interesantes y educativos. Estos experimentos responderán a los "por qué" de muchos niños y despertarán el interés por la ciencia y el conocimiento del mundo. Y hoy quiero contarles qué experimentos para niños en casa pueden organizar los padres.
serpiente faraón

Este experimento se basa en aumentar el volumen de los reactivos mezclados. En el proceso de quema, se transforman y, retorciéndose, se asemejan a una serpiente. El experimento obtuvo su nombre gracias al milagro bíblico, cuando Moisés, quien acudió al faraón con una petición, convirtió su vara en una serpiente.
Para la experiencia necesitarás los siguientes ingredientes:
- arena ordinaria;
- etanol;
- azúcar triturada;
- bicarbonato de sodio.
Impregnamos la arena con alcohol, luego formamos una pequeña colina y hacemos un hueco en la parte superior. Luego mezcle con una cuchara pequeña. azúcar en polvo y una pizca de refresco, luego nos dormimos todo en un "cráter" improvisado. Prendemos fuego a nuestro volcán, el alcohol en la arena comienza a quemarse y se forman bolas negras. Son un producto de descomposición de la soda y el azúcar caramelizado.
Después de que todo el alcohol se haya consumido, el tobogán de arena se volverá negro y se formará una "serpiente negra del faraón" que se retuerce. Esta experiencia se ve más impresionante con el uso de reactivos reales y ácidos fuertes, que solo pueden usarse en un laboratorio químico.
Puedes hacerlo un poco más fácil y comprar una tableta de gluconato de calcio en la farmacia. Préndele fuego en casa, el efecto será casi el mismo, solo que la "serpiente" colapsará rápidamente.
Lampara magica

En las tiendas, a menudo se pueden ver lámparas, dentro de las cuales se mueve y brilla un hermoso líquido iluminado. Estas lámparas se inventaron a principios de los años 60. Trabajan a base de parafina y aceite. En la parte inferior del dispositivo hay una lámpara incandescente convencional incorporada que calienta la cera fundida que desciende. Una parte llega a la parte superior y cae, la otra parte se calienta y sube, por lo que vemos una especie de “baile” de parafina dentro del recipiente.
Para llevar a cabo una experiencia similar en casa con un niño, necesitamos:
- cualquier jugo;
- aceite vegetal;
- tabletas - gaseosas;
- hermoso recipiente.
Tomamos un recipiente y lo llenamos con jugo más de la mitad. Agregue aceite vegetal encima y arroje una tableta emergente allí. Comienza a "trabajar", las burbujas que suben desde el fondo del vaso capturan el jugo en sí mismas y forman una hermosa ebullición en la capa de aceite. Luego, las burbujas que llegan al borde del vaso estallan y el jugo cae. Resulta una especie de "ciclo" de jugo en un vaso. Tal lamparas magicas absolutamente inofensivo, a diferencia de la parafina, que un niño puede romper y quemar accidentalmente.
Globo y naranja: una experiencia para niños pequeños

¿Qué le sucederá a un globo si le dejas caer jugo de naranja o de limón? Reventará tan pronto como las gotas de cítricos lo toquen. Y luego puedes comer una naranja con tu bebé. Es muy entretenido y divertido. Para la experiencia necesitamos un par de globos y cítricos. Los inflamos y dejamos que el bebé gotee jugo de frutas en cada uno y veamos qué sucede.
¿Por qué revienta la pelota? Se trata de un producto químico especial: limoneno. Se encuentra en las frutas cítricas y se usa a menudo en la industria cosmética. Cuando el jugo entra en contacto con la goma del globo, se produce una reacción, el limoneno disuelve la goma y el globo estalla.
vaso dulce
Se pueden hacer cosas increíbles con azúcar caramelizada. En los primeros días del cine, la mayoría de las escenas de lucha usaban este dulce vaso comestible. Esto se debe a que es menos traumático para los actores durante el rodaje y es económico. Luego, sus fragmentos se pueden recolectar, fundir y convertir en accesorios para la película.
Muchos en la infancia hicieron gallos de azúcar o dulce de azúcar, el vidrio debe hacerse de acuerdo con el mismo principio. Vierta agua en una cacerola, caliente un poco, el agua no debe estar fría. Después de eso, vierta azúcar en él y hierva. Cuando el líquido hierva, cocine hasta que la masa comience a espesar gradualmente y burbujee con fuerza. El azúcar derretida en el recipiente debe convertirse en un caramelo viscoso que, si se sumerge en agua fría, se convertirá en un vaso.
Verter el líquido preparado sobre el preparado previamente y engrasado aceite vegetal una bandeja para hornear, un vaso fresco y dulce está listo.
Durante el proceso de cocción, puede agregarle tinte y verterlo en una forma interesante, y luego tratar y sorprender a todos a su alrededor.
uña de filósofo

Esta entretenida experiencia se basa en el principio del cobreado de hierro. Nombrada por analogía con una sustancia que, según la leyenda, podía convertirlo todo en oro, y se la llamó piedra filosofal. Para llevar a cabo el experimento, necesitaremos:
- clavo de hierro;
- un cuarto de vaso de ácido acético;
- sal alimenticia;
- soda;
- un trozo de alambre de cobre;
- contenedor de vidrio.
Tomamos un frasco de vidrio y le echamos ácido, sal y lo agitamos bien. Cuidado, el vinagre es duro. mal olor. Puede quemar las delicadas vías respiratorias del bebé. Luego colocamos el alambre de cobre en la solución resultante durante 10-15 minutos, después de un tiempo bajamos la uña de hierro previamente limpiada con soda a la solución. Después de un tiempo, podemos ver que apareció una capa de cobre y el cable se volvió brillante como nuevo. ¿Cómo pudo pasar esto?
El cobre reacciona con el ácido acético, se forma una sal de cobre, luego los iones de cobre en la superficie de la uña cambian de lugar con los iones de hierro y forman una placa en su superficie. Y la concentración de sales de hierro aumenta en la solución.
Las monedas de cobre no son adecuadas para el experimento, ya que este metal en sí es muy blando, y para fortalecer el dinero se utilizan sus aleaciones con latón y aluminio.
Los productos de cobre no se oxidan con el tiempo, están cubiertos con un revestimiento verde especial: pátina, que evita que se corroa más.
Burbujas de jabón de bricolaje
¿A quién no le encantaba hacer burbujas cuando era niño? Qué hermosos brillan y estallan alegremente. Puede comprarlos en la tienda, pero será mucho más interesante crear su propia solución con su hijo y luego hacer burbujas.
Debe decirse de inmediato que la mezcla habitual de agua y jabón para lavar no funcionará. Produce burbujas que desaparecen rápidamente y se inflan mal. La mayoría forma asequible para preparar tal sustancia - mezcle dos vasos de agua con un vaso detergente para platos Si se agrega azúcar a la solución, las burbujas se vuelven más fuertes. Volarán durante mucho tiempo y no estallarán. Y las enormes burbujas que se pueden ver en el escenario con artistas profesionales se obtienen mezclando glicerina, agua y detergente.
Para la belleza y el estado de ánimo, puede mezclar pintura para alimentos en la solución. Entonces las burbujas brillarán maravillosamente al sol. Puede crear varias soluciones diferentes y turnarse para usarlas con su hijo. Es interesante experimentar con el color y crear el tuyo propio, nuevo tono burbujas de jabón.
También puedes intentar mezclar la solución de jabón con otras sustancias y ver cómo afectan las ampollas. Tal vez inventará y patentará algún nuevo tipo propio.
tinta espía

Esta legendaria tinta invisible. ¿De qué están hechos? Ahora hay tantas películas sobre espías e interesantes investigaciones intelectuales. Puede invitar a su hijo a jugar un poco de agentes secretos.
El significado de tal tinta es que no se pueden ver en papel a simple vista. Solo aplicando un efecto especial, por ejemplo, calentamiento o reactivos químicos, se puede ver un mensaje secreto. Desafortunadamente, la mayoría de las recetas para hacerlos son ineficaces y la tinta deja marcas.
Haremos unos especiales que son difíciles de ver sin una detección especial. Para esto necesitarás:
- agua;
- una cuchara;
- bicarbonato de sodio;
- cualquier fuente de calor;
- pegar con algodón al final.
Vierta líquido tibio en cualquier recipiente, luego, mientras revuelve, vierta bicarbonato de sodio hasta que deje de disolverse, es decir. la mezcla alcanzará una alta concentración. Ponemos allí un palito con algodón en la punta y con él escribimos algo en un papel. Esperemos hasta que se seque, luego lleve la hoja a una vela encendida o una estufa de gas. Después de un tiempo, puedes ver cómo aparecen las letras amarillas de la palabra escrita en el papel. Asegúrese de que durante el desarrollo de las letras la hoja no se incendie.
Dinero a prueba de fuego
Este es un experimento muy conocido y antiguo. Para ello necesitarás:
- agua;
- alcohol;
- sal.
toma un profundo contenedor de vidrio y vierta agua en él, luego agregue alcohol y sal, revuelva bien para que todos los ingredientes se disuelvan. Para el encendido, puede tomar hojas de papel comunes, si no le importa, puede tomar una factura. Simplemente tome una denominación pequeña, de lo contrario, algo puede salir mal en la experiencia y el dinero se echará a perder.
Coloque tiras de papel o dinero en una solución de agua y sal, después de un tiempo se pueden sacar del líquido y prender fuego. Puede ver que la llama cubre todo el billete, pero no se enciende. Este efecto se explica por el hecho de que el alcohol en la solución se evapora y el papel mojado no se enciende
piedra que cumple los deseos

El proceso de hacer crecer los cristales es muy emocionante, pero requiere mucho tiempo. Sin embargo, lo que obtienes como resultado valdrá la pena el tiempo invertido. El más popular es la creación de cristales a partir de sal de mesa o azúcar.
Considere cultivar una "piedra de los deseos" a partir de azúcar refinada. Para esto necesitarás:
- agua potable;
- azúcar granulada;
- hoja de papel;
- palo de madera delgado;
- recipiente pequeño y vaso.
Primero hagamos una preparación. Para hacer esto, necesitamos preparar una mezcla de azúcar. Vierta un poco de agua y azúcar en un recipiente pequeño. Esperamos hasta que la mezcla hierva, y hervimos hasta que se forme un estado de jarabe. Luego bajamos el palo de madera allí y lo espolvoreamos con azúcar, debes hacerlo de manera uniforme, en este caso el cristal resultante se volverá más hermoso y uniforme. Deje la base para que el cristal se seque y se endurezca durante la noche.
Preparemos la solución de jarabe. Vierta agua en un recipiente grande y duerma, revolviendo lentamente, azúcar allí. Luego, cuando la mezcla hierva, hervir hasta el estado de un jarabe viscoso. Retire del fuego y deje enfriar.
Recorta círculos de papel y pégalos al extremo de un palo de madera. Se convertirá en una tapa en la que se adjunta una varita con cristales. Llenamos el vaso con una solución y bajamos la pieza de trabajo allí. Esperamos una semana y la "piedra de los deseos" está lista. Si pones un tinte en el almíbar al cocinar, resultará aún más hermoso.
El proceso de creación de cristales a partir de sal es algo más sencillo. Aquí solo será necesario monitorear la mezcla y cambiarla periódicamente para aumentar la concentración.
En primer lugar, creamos un espacio en blanco. Verter en un recipiente de vidrio agua tibia, y removiendo poco a poco, verter la sal hasta que deje de disolverse. Dejamos el contenedor por un día. Después de este tiempo, puedes encontrar muchos cristales pequeños en el vaso, elige el más grande y átalo a un hilo. Haga una nueva solución de sal y coloque un cristal allí, no debe tocar el fondo ni los bordes del vaso. Esto puede conducir a deformaciones no deseadas.
Después de un par de días, puedes ver que ha crecido. Cuanto más a menudo cambie la mezcla, aumentando la concentración de contenido de sal, más rápido podrá hacer crecer su piedra de deseo.
tomate brillante

Este experimento debe llevarse a cabo estrictamente bajo la supervisión de adultos, ya que se utilizan sustancias nocivas para su implementación. El tomate brillante que se creará durante este experimento está estrictamente prohibido comer, puede provocar la muerte o una intoxicación grave. Necesitaremos:
- tomate ordinario;
- jeringuilla;
- materia sulfúrica de fósforos;
- lejía;
- peróxido de hidrógeno.
Cogemos un recipiente pequeño, ponemos allí el azufre de fósforo previamente preparado y vertemos la lejía. Dejamos todo esto por un tiempo, luego de lo cual extraemos la mezcla en una jeringa y la inyectamos dentro del tomate con diferentes partes para que brille uniformemente. Para iniciar el proceso químico se necesita agua oxigenada, que introducimos por el rastro del pecíolo desde arriba. Apagamos la luz de la habitación y podemos disfrutar del proceso.
Huevo en vinagre: una experiencia muy sencilla
Este es un ácido acético ordinario simple e interesante. Para su implementación, necesitarás hervir. huevo y vinagre Tome un recipiente de vidrio transparente y baje el huevo con cáscara en él, luego llénelo hasta arriba con ácido acético. Puedes ver como salen burbujas de su superficie, esto es una reacción química. Después de tres días, podemos observar que la cáscara se ha vuelto blanda y el huevo es elástico, como una pelota. Si lo apuntas con una linterna, puedes ver que brilla. No se recomienda realizar un experimento con un huevo crudo, ya que la cáscara blanda puede romperse cuando se aprieta.
Baba de bricolaje de PVA

Este es un juguete extraño bastante común de nuestra infancia. Actualmente, es bastante difícil encontrarlo. Intentemos hacer limo en casa. Su color clásico es el verde, pero puedes usar el que más te guste. Prueba a mezclar varios tonos y crea el tuyo propio. color único.
Para el experimento necesitamos:
- jarra de vidrio;
- varios vasos pequeños;
- teñir;
- cola de PVA;
- almidón normal.
Preparemos tres vasos idénticos con soluciones que mezclaremos. Vierta pegamento PVA en el primero, agua en el segundo y almidón en el tercero. Primero, vierta agua en el frasco, luego agregue pegamento y tinte, mezcle todo bien y luego agregue almidón. La mezcla debe mezclarse rápidamente para que no se espese, y puedes jugar con la baba terminada.
Cómo inflar un globo rápidamente
¿Se acercan las vacaciones y necesitas inflar muchos globos? ¿Qué hacer? Esta experiencia inusual ayudará a facilitar la tarea. Para él, necesitamos una pelota de goma, ácido acético y refresco común. Debe llevarse a cabo con cuidado en presencia de adultos.
Vierta una pizca de bicarbonato de sodio en globo y ponla en el cuello de una botella de ácido acético para que no se derrame la soda, enderezar la bolita y dejar caer su contenido en el vinagre. Verás como se producirá la reacción química, comenzará a formar espuma, liberando dióxido de carbono e inflando el globo.
Eso es todo por hoy. No olvide que es mejor realizar experimentos para niños en casa bajo supervisión, será más seguro e interesante. ¡Te veo pronto!
Ni una sola persona, ni siquiera un poco familiarizada con los problemas de la educación moderna, discutirá sobre las ventajas del sistema soviético. Sin embargo, también presentaba ciertos inconvenientes, en particular, en el estudio de materias de ciencias naturales, muchas veces se hacía hincapié en aportar un componente teórico, y la práctica quedaba relegada a un segundo plano. Al mismo tiempo, cualquier profesor confirmará que La mejor manera despertar en un niño el interés por estos objetos es mostrar alguna experiencia física o química espectacular. Esto es especialmente importante para etapa inicial estudio de tales temas e incluso mucho antes. En el segundo caso, un kit especial para experimentos químicos, que se pueda utilizar en casa, puede ser de gran ayuda para los padres. Es cierto que al comprar un regalo de este tipo, los padres y las madres deben comprender que también tendrán que participar en las clases, ya que tal "juguete" en manos de un niño sin supervisión representa un cierto peligro.
¿Qué es un experimento químico?
En primer lugar, debe comprender lo que está en juego. Generalmente se acepta que experimento quimico- esta es la manipulación de diversas sustancias orgánicas e inorgánicas para establecer sus propiedades y reacciones en diversas condiciones. Si hablamos de experimentos que se realizan con el fin de despertar en el niño las ganas de explorar el mundo que le rodea, entonces estos deben ser espectaculares y al mismo tiempo sencillos. Además, no se recomienda elegir opciones que requieran seguridad medidas especiales seguridad.

Dónde empezar
En primer lugar, puede decirle al niño que todo lo que nos rodea, incluido su propio cuerpo, se compone de varias sustancias que interactúan. Como resultado, se pueden observar varios fenómenos: tanto aquellos a los que las personas se han acostumbrado durante mucho tiempo y no les prestan atención, como los muy inusuales. En este caso se puede citar como ejemplo el óxido, que es consecuencia de la oxidación de los metales, o el humo de un incendio, que es un gas que se libera durante la combustión de diversos objetos. Luego puede comenzar a mostrar experimentos químicos simples.

"Huevo flotante"
Se puede mostrar un experimento muy interesante usando un huevo y una solución acuosa de ácido clorhídrico. Para llevarlo a cabo, debe tomar una jarra de vidrio o un vaso ancho y verter en el fondo una solución de ácido clorhídrico al 5%. Luego debes bajar el huevo y esperar un rato.
Pronto, burbujas de dióxido de carbono aparecerán en la superficie de la cáscara del huevo debido a la reacción del ácido clorhídrico y el carbonato de calcio contenido en la cáscara y levantarán el huevo. Habiendo llegado a la superficie, las burbujas de gas estallarán y la "carga" volverá a ir al fondo del plato. El proceso de levantar y sumergir el huevo continuará hasta que toda la cáscara del huevo se haya disuelto en el ácido clorhídrico.
"Señales secretas"
Se pueden realizar interesantes experimentos químicos con ácido sulfúrico. Por ejemplo, con un bastoncillo de algodón humedecido en una solución de ácido sulfúrico al 20%, se dibujan figuras o letras en un papel y se espera a que se seque el líquido. Luego se plancha la sábana con plancha caliente y comienzan a aparecer letras negras. Esta experiencia será aún más espectacular si sostienes la hoja sobre la llama de una vela, pero esto debe hacerse con mucho cuidado, tratando de no prender fuego al papel.
"Letras de fuego"
La experiencia anterior se puede hacer de otra manera. Para ello, dibuje el contorno de una figura o letra en un papel con un lápiz y prepare una composición que consiste en 20 g de KNO 3 disueltos en 15 ml de agua caliente. Luego, con un pincel, satura el papel a lo largo de las líneas de lápiz para que no queden espacios. Tan pronto como la audiencia esté lista y la hoja esté seca, debe llevar una astilla ardiente a la inscripción en un solo punto. Inmediatamente aparecerá una chispa, que “recorrerá” el contorno del dibujo hasta llegar al final de la línea.
Seguro que a los jóvenes espectadores les interesará por qué se consigue tal efecto. Explique que cuando se calienta, el nitrato de potasio se convierte en otra sustancia, el nitrito de potasio, y libera oxígeno, que favorece la combustión.

"Pañuelo ignífugo"
Los niños seguramente estarán interesados en la experiencia con la tela "ignífuga". Para demostrarlo se disuelven 10 g de cola de silicato en 100 ml de agua y se humedece un trozo de tela o pañuelo con el líquido resultante. Luego se exprime y, con unas pinzas, se sumerge en un recipiente con acetona o gasolina. Inmediatamente prende fuego a la tela con una astilla y observa como la llama "devora" el pañuelo, pero queda intacto.
"Ramo azul"
Los experimentos químicos simples pueden ser muy espectaculares. Te invitamos a sorprender al espectador usando flores de papel, cuyos pétalos deben estar untados con pegamento de almidón natural. Luego se debe colocar el ramo en un frasco, se deben poner unas gotas de tintura de alcohol yodado en el fondo y se debe cerrar bien la tapa. En unos minutos ocurrirá un "milagro": las flores se volverán azules, porque el vapor de yodo hará que el almidón cambie de color.
"Decoraciones de navidad"
Una experiencia química original que te dará hermosas joyas para un mini árbol de Navidad, resultará si usa una solución saturada (1:12) de alumbre de potasio KAl (SO 4) 2 con la adición vitriolo azul CuSO4 (1:5).
Primero debe hacer un marco de una estatuilla con un alambre, envolverlo con hilos de lana blancos y bajarlos a una mezcla preparada previamente. Después de una semana o dos, crecerán cristales en la pieza de trabajo, que debe barnizarse para que no se desmoronen.

"Volcanes"
Resultará un experimento químico muy efectivo si toma un plato, plastilina, bicarbonato de sodio, vinagre de mesa, tinte rojo y líquido para lavar platos. A continuación, debe hacer lo siguiente:
- divide un trozo de plastilina en dos partes;
- enrolle uno en un panqueque plano y forme un cono hueco del segundo, en la parte superior del cual debe dejar un agujero;
- coloque el cono sobre una base de plastilina y conéctelo para que el "volcán" no deje pasar el agua;
- poner la estructura en una bandeja;
- vierta "lava", que consiste en 1 cucharada. yo bebiendo soda y unas gotas de colorante alimentario líquido;
- cuando el público esté listo, vierta vinagre en el "ventilador" y observe la reacción violenta, durante la cual se libera dióxido de carbono y sale espuma roja del volcán.
Como puede ver, los experimentos químicos caseros pueden ser muy diversos, y todos ellos interesarán no solo a los niños, sino también a los adultos.
Mi experiencia personal en la enseñanza de la química ha demostrado que una ciencia como la química es muy difícil de estudiar sin ningún conocimiento y práctica iniciales. Los escolares muy a menudo ejecutan este tema. Yo personalmente observé como un estudiante de 8º grado al oír la palabra "química" empezó a fruncir el ceño, como si se hubiera comido un limón.
Más tarde resultó que debido a la aversión y la incomprensión del tema, faltó a la escuela a escondidas de sus padres. Por supuesto, el currículo escolar está diseñado de tal manera que el profesor debe dar mucha teoría en las primeras lecciones de química. La práctica, por así decirlo, se desvanece en el fondo precisamente en el momento en que el estudiante aún no puede darse cuenta de forma independiente si necesita este tema en el futuro. Esto se debe principalmente al equipo de laboratorio de las escuelas. En las grandes ciudades, las cosas están mejor ahora con reactivos e instrumentos. En cuanto a la provincia, así como hace 10 años, y en la actualidad, muchas escuelas no tienen la oportunidad de realizar clases de laboratorio. Pero el proceso de estudio y fascinación por la química, así como por otras ciencias naturales, suele comenzar con experimentos. Y no es casualidad. Muchos químicos famosos, como Lomonosov, Mendeleev, Paracelsus, Robert Boyle, Pierre Curie y Maria Sklodowska-Curie (los escolares también estudian a todos estos investigadores en clases de física) ya comenzaron a experimentar desde la infancia. Los grandes descubrimientos de estas grandes personas se realizaron en laboratorios químicos domésticos, ya que las clases de química en los institutos estaban disponibles solo para personas adineradas.
Y, por supuesto, lo más importante es interesar al niño y transmitirle que la química nos rodea por todas partes, por lo que el proceso de estudiarla puede resultar muy emocionante. Aquí es donde los experimentos de química casera son útiles. Al observar tales experimentos, uno puede buscar una explicación de por qué las cosas suceden de esta manera y no de otra manera. Y cuando un joven investigador encuentra conceptos similares en las lecciones escolares, las explicaciones del maestro serán más comprensibles para él, ya que ya tendrá su propia experiencia en la realización de experimentos químicos en el hogar y el conocimiento adquirido.
Es muy importante comenzar los estudios de ciencias con las observaciones habituales y ejemplos de la vida real que crea que serán los mejores para su hijo. Aquí hay algunos de ellos. Agua es Sustancia química, que consta de dos elementos, así como los gases disueltos en él. El hombre también contiene agua. Sabemos que donde no hay agua, no hay vida. Una persona puede vivir sin comida durante aproximadamente un mes y sin agua, solo unos pocos días.
La arena de río no es más que óxido de silicio, y también la principal materia prima para la producción de vidrio.
Una persona misma no lo sospecha y lleva a cabo reacciones químicas cada segundo. El aire que respiramos es una mezcla de gases - químicos. En el proceso de exhalación, se libera otra sustancia compleja: dióxido de carbono. Podemos decir que nosotros mismos somos un laboratorio químico. Puede explicarle al niño que lavarse las manos con jabón también es un proceso químico de agua y jabón.
A un niño mayor que, por ejemplo, ya ha comenzado a estudiar química en la escuela, se le puede explicar que casi todos los elementos se pueden encontrar en el cuerpo humano. sistema periódico D. I. Mendeleiev. En un organismo vivo, no solo están presentes todos los elementos químicos, sino que cada uno de ellos realiza alguna función biológica.
La química es también medicina, sin la cual en la actualidad muchas personas no pueden vivir ni un día.
Las plantas también contienen la sustancia química clorofila, que le da a la hoja su color verde.
cocinar es dificil procesos quimicos. Aquí puede dar un ejemplo de cómo sube la masa cuando se le agrega levadura.
Una de las opciones para hacer que un niño se interese por la química es llevar a un destacado investigador individual y leer la historia de su vida o ver una película educativa sobre él (ahora están disponibles películas sobre D.I. Mendeleev, Paracelsus, M.V. Lomonosov, Butlerov).
Muchos creen que la química real son sustancias nocivas, es peligroso experimentar con ellas, especialmente en casa. Hay muchas experiencias muy emocionantes que puede hacer con su hijo sin dañar su salud. Y estos experimentos químicos caseros no serán menos emocionantes e instructivos que los que vienen con explosiones, olores acre y bocanadas de humo.
Algunos padres también tienen miedo de realizar experimentos químicos en casa debido a su complejidad o falta de equipo necesario y reactivos. Resulta que puedes arreglártelas con medios improvisados y esas sustancias que toda ama de casa tiene en la cocina. Puedes comprarlos en el más cercano. tienda de artículos para el hogar o farmacia. Los tubos de ensayo para experimentos químicos caseros se pueden reemplazar con frascos de pastillas. Los reactivos se pueden almacenar en frascos de vidrio, p. comida para bebé o mayonesa.
Vale la pena recordar que los platos con reactivos deben tener una etiqueta con la inscripción y estar bien cerrados. A veces es necesario calentar los tubos. Para no sostenerlo en sus manos cuando se calienta y no quemarse, puede construir un dispositivo de este tipo con una pinza para la ropa o un trozo de alambre.
También es necesario asignar varias cucharas de acero y madera para mezclar.
Usted mismo puede hacer un soporte para sostener tubos de ensayo taladrando agujeros en la barra.
Para filtrar las sustancias resultantes, necesitará un filtro de papel. Es muy fácil hacerlo de acuerdo con el diagrama que se muestra aquí.
Para los niños que aún no van a la escuela o están estudiando en los grados de primaria, montar experimentos químicos caseros con sus padres será una especie de juego. Lo más probable es que un investigador tan joven aún no pueda explicar algunas leyes y reacciones individuales. Sin embargo, es posible que tal forma empírica de descubrir el mundo circundante, la naturaleza, el hombre, las plantas a través de experimentos siente las bases para el estudio de las ciencias naturales en el futuro. Incluso puede organizar concursos originales en la familia: quién tendrá la experiencia más exitosa y luego los demostrará en las vacaciones familiares.
Independientemente de la edad del niño y su capacidad para leer y escribir, le aconsejo tener un diario de laboratorio en el que pueda registrar experimentos o dibujar. Un químico real debe escribir un plan de trabajo, una lista de reactivos, bocetos de instrumentos y describe el progreso del trabajo.
Cuando usted y su hijo comiencen a estudiar esta ciencia de las sustancias y realicen experimentos químicos en el hogar, lo primero que deben recordar es la seguridad.
Para esto necesitas seguir las siguientes reglas seguridad:
2. Es mejor asignar una mesa separada para realizar experimentos químicos en el hogar. Si no tiene una mesa separada en casa, es mejor realizar experimentos en una bandeja o paleta de acero o hierro.
3. Es necesario hacerse con guantes finos y gruesos (se venden en farmacia o ferretería).
4. Para experimentos químicos, es mejor comprar una bata de laboratorio, pero también puedes usar un delantal grueso en lugar de una bata.
5. La cristalería de laboratorio no debe usarse para alimentos.
6. En los experimentos químicos caseros, no debe haber crueldad hacia los animales ni violación del sistema ecológico. Los desechos químicos ácidos deben neutralizarse con sosa y los alcalinos con ácido acético.
7. Si desea verificar el olor de un gas, líquido o reactivo, nunca acerque el recipiente directamente a su cara, pero, sosteniéndolo a cierta distancia, dirija, agitando la mano, el aire sobre el recipiente hacia usted y en al mismo tiempo huele el aire.
8. Utilice siempre pequeñas cantidades de reactivos en los experimentos caseros. Evite dejar reactivos en un recipiente sin una inscripción adecuada (etiqueta) en la botella, de la cual debe quedar claro lo que hay en la botella.
El estudio de la química debe comenzar con experimentos químicos simples en el hogar, lo que le permite al niño dominar los conceptos básicos. Una serie de experimentos 1-3 le permiten familiarizarse con los estados agregados básicos de las sustancias y las propiedades del agua. Para empezar, puede mostrarle a un niño en edad preescolar cómo se disuelven el azúcar y la sal en el agua, acompañando esto con una explicación de que el agua es un solvente universal y es un líquido. El azúcar o la sal son sólidos que se disuelven en líquidos.
Experiencia número 1 "Porque - sin agua y ni aquí ni allá"
El agua es una sustancia química líquida compuesta por dos elementos además de gases disueltos en ella. El hombre también contiene agua. Sabemos que donde no hay agua, no hay vida. Una persona puede vivir sin comida durante aproximadamente un mes y sin agua, solo unos pocos días.
Reactivos y equipo: 2 tubos de ensayo, soda, ácido cítrico, agua
Experimento: Tome dos tubos de ensayo. Vierta cantidades iguales de bicarbonato de sodio y ácido cítrico. Luego vierta agua en uno de los tubos de ensayo y no en el otro. En un tubo de ensayo en el que se vertió agua, comenzó a liberarse dióxido de carbono. En un tubo de ensayo sin agua, nada ha cambiado.
Discusión: Este experimento explica el hecho de que muchas reacciones y procesos en los organismos vivos son imposibles sin agua, y el agua también acelera muchas reacciones químicas. A los escolares se les puede explicar que se ha producido una reacción de intercambio, como resultado de lo cual se ha liberado dióxido de carbono.
Experiencia número 2 "Lo que se disuelve en el agua del grifo"
Reactivos y equipo: vidrio transparente, agua del grifo
Experimento: Verter en un vaso transparente agua del grifo y déjalo en un lugar cálido durante una hora. Después de una hora, verás burbujas asentadas en las paredes del vaso.
Discusión: Las burbujas no son más que gases disueltos en agua. Los gases se disuelven mejor en agua fría. Tan pronto como el agua se calienta, los gases dejan de disolverse y se depositan en las paredes. Un experimento químico casero similar también permite familiarizar al niño con el estado gaseoso de la materia.
Experiencia N° 3 “Lo que se disuelve en agua mineral o agua es un solvente universal”
Reactivos y equipo: probeta, agua mineral, vela, lupa
Experimento: Vierta agua mineral en un tubo de ensayo y evapórela lentamente sobre la llama de una vela (el experimento se puede hacer en la estufa en una cacerola, pero los cristales serán menos visibles). A medida que el agua se evapore, quedarán pequeños cristales en las paredes de la probeta, todos ellos de diferentes formas.
Discusión: Los cristales son sales disueltas en agua mineral. Ellos tienen forma diferente y tamaño, ya que cada cristal tiene su propia fórmula química. Con un niño que ya ha comenzado a estudiar química en la escuela, puede leer la etiqueta del agua mineral, que indica su composición y escribir las fórmulas de los compuestos que contiene el agua mineral.
Experimento No. 4 "Filtración de agua mezclada con arena"
Reactivos y equipo: 2 tubos de ensayo, embudo, filtro de papel, agua, arena de río
Experimento: Vierta agua en un tubo de ensayo y sumerja un poco de arena de río, mezcle. Luego, de acuerdo con el esquema descrito anteriormente, haga un filtro de papel. Inserte un tubo de ensayo seco y limpio en una gradilla. Vierta lentamente la mezcla de arena y agua a través de un embudo de papel de filtro. La arena del río permanecerá en el filtro y obtendrá agua limpia en un tubo trípode.
Discusión: La experiencia química nos permite demostrar que existen sustancias que no se disuelven en el agua, por ejemplo, la arena de río. La experiencia también introduce uno de los métodos de limpieza de mezclas de sustancias de impurezas. Aquí puede introducir los conceptos de sustancias puras y mezclas, que se dan en el libro de texto de química de octavo grado. En este caso, la mezcla es arena con agua, la sustancia pura es el filtrado y la arena de río es el sedimento.
El proceso de filtración (descrito en el Grado 8) se usa aquí para separar una mezcla de agua y arena. Para diversificar el aprendizaje este proceso, puedes profundizar un poco más en la historia del tratamiento del agua potable.
Los procesos de filtración se utilizaron ya en los siglos VIII y VII antes de Cristo. en el estado de Urartu (ahora es el territorio de Armenia) para la purificación de agua potable. Sus habitantes realizaron la construcción de un sistema de abastecimiento de agua con el uso de filtros. Utilizado como filtros tejido denso y carbón Sistemas entrelazados similares bajantes, los canales de arcilla equipados con filtros también se encontraban en el territorio del antiguo Nilo entre los antiguos egipcios, griegos y romanos. Se pasó agua a través de dicho filtro varias veces a través de dicho filtro, eventualmente muchas veces, logrando finalmente mejor calidad agua.
uno de los mas experiencias interesantes es el crecimiento de cristales. La experiencia es muy clara y da una idea de muchos conceptos químicos y físicos.
Experiencia número 5 "Cultivar cristales de azúcar"
Reactivos y equipo: Dos vasos de agua; azúcar - cinco vasos; palillos de madera; papel fino; maceta; vasos transparentes; colorante alimentario (se pueden reducir las proporciones de azúcar y agua).
Experimento: El experimento debe comenzar con la preparación de jarabe de azúcar. Tomamos una sartén, le echamos 2 tazas de agua y 2,5 tazas de azúcar. Ponemos a fuego medio y, revolviendo, disolvemos todo el azúcar. Vierta las 2,5 tazas restantes de azúcar en el almíbar resultante y cocine hasta que se disuelva por completo.
Ahora preparemos los embriones de cristales - palos. Esparza una pequeña cantidad de azúcar en un trozo de papel, luego sumerja el palito en el almíbar resultante y enróllelo en azúcar.
Tomamos los pedazos de papel y perforamos un agujero en el medio con un pincho para que el pedazo de papel encaje perfectamente contra el pincho.
Luego vertemos el jarabe caliente en vasos transparentes (es importante que los vasos sean transparentes, de esta manera el proceso de maduración de los cristales será más emocionante y visual). El jarabe debe estar caliente o los cristales no crecerán.
Puedes hacer cristales de azúcar de colores. Para hacer esto, agregue un poco de colorante para alimentos al jarabe caliente resultante y revuélvalo.
Los cristales crecerán de diferentes maneras, algunos rápidamente y otros pueden tardar más. Al final del experimento, el niño puede comer las piruletas resultantes si no es alérgico a los dulces.
Si no tiene brochetas de madera, puede experimentar con hilos comunes.
Discusión: Un cristal es un estado sólido de la materia. Tiene cierta forma y cierto número de caras debido a la disposición de sus átomos. Las sustancias cristalinas son sustancias cuyos átomos están ordenados regularmente, de modo que forman una red tridimensional regular, llamada cristal. Fila de cristales elementos químicos y sus compuestos tienen notables propiedades mecánicas, eléctricas, magnéticas y ópticas. Por ejemplo, el diamante es un cristal natural y el mineral más duro y raro. Debido a su dureza excepcional, el diamante juega un papel muy importante en la tecnología. Piedras cortadas con sierras de diamante. Hay tres formas de formar cristales: cristalización a partir de un fundido, a partir de una solución y a partir de una fase gaseosa. Un ejemplo de cristalización a partir de un derretimiento es la formación de hielo a partir de agua (después de todo, el agua es hielo derretido). Un ejemplo de cristalización de una solución en la naturaleza es la precipitación de cientos de millones de toneladas de sal de agua de mar. En este caso, cuando cultivamos cristales en casa, nos enfrentamos a los métodos más comunes de cultivo artificial: la cristalización a partir de una solución. Los cristales de azúcar crecen a partir de una solución saturada al evaporar lentamente el solvente, el agua, o al bajar lentamente la temperatura.
La siguiente experiencia le permite obtener en casa uno de los productos cristalinos más útiles para los humanos: el yodo cristalino. Antes de realizar el experimento, le aconsejo que vea con su hijo un cortometraje “La vida de las ideas maravillosas. Yodo inteligente. La película da una idea de los beneficios del yodo y historia inusual su descubrimiento, que será recordado durante mucho tiempo por el joven investigador. Y es interesante porque el descubridor del yodo fue un gato común y corriente.
científico francés Bernard Courtois guerras napoleónicas Observé que en los productos obtenidos de las cenizas de algas, que eran arrojadas a la costa de Francia, hay alguna sustancia que corroe los recipientes de hierro y cobre. Pero ni el propio Courtois ni sus ayudantes supieron aislar esta sustancia de las cenizas de las algas. El azar ayudó a acelerar el descubrimiento.
En su pequeña planta salitrera de Dijon, Courtois iba a realizar varios experimentos. Había recipientes sobre la mesa, uno de los cuales contenía una tintura alcohólica de algas y el otro una mezcla de ácido sulfúrico y hierro. Sobre los hombros del científico se sentó su amado gato.
Llamaron a la puerta, y el gato asustado saltó y salió corriendo, rozando con la cola los frascos sobre la mesa. Los recipientes se rompieron, el contenido se mezcló y de repente comenzó una violenta reacción química. Cuando se asentó una pequeña nube de vapores y gases, el científico sorprendido vio una especie de capa cristalina en los objetos y escombros. Courtois empezó a explorarlo. Los cristales a nadie antes de esta sustancia desconocida se llamaban "yodo".
Así se descubrió un nuevo elemento, y el gato doméstico de Bernard Courtois pasó a la historia.
Experiencia nº 6 "Obtención de cristales de yodo"
Reactivos y equipo: tintura de yodo farmacéutico, agua, un vaso o un cilindro, una servilleta.
Experimento: Mezclamos agua con tintura de yodo en la proporción: 10 ml de yodo y 10 ml de agua. Y poner todo en el refrigerador por 3 horas. Durante el enfriamiento, el yodo se precipitará en el fondo del vaso. Escurrimos el líquido, sacamos el precipitado de yodo y lo ponemos en una servilleta. Apriete con servilletas hasta que el yodo comience a desmoronarse.
Discusión: A este experimento químico se le llama extracción o extracción de un componente de otro. En este caso, el agua extrae el yodo de la solución de la lámpara de alcohol. Así, el joven investigador repetirá la experiencia del gato Courtois sin humo y batiendo platos.
Su hijo ya aprenderá sobre los beneficios del yodo para desinfectar heridas de la película. Así, demuestras que existe un vínculo inextricable entre la química y la medicina. Sin embargo, resulta que el yodo puede usarse como indicador o analizador del contenido de otro sustancia beneficiosa- almidón. La siguiente experiencia introducirá al joven experimentador en una química aparte muy útil: la analítica.
Experiencia N° 7 “Yodo-indicador del contenido de almidón”
Reactivos y equipo: patatas frescas, trozos de plátano, manzana, pan, un vaso de almidón diluido, un vaso de yodo diluido, una pipeta.
Experimento: Cortamos las papas en dos partes y las goteamos con yodo diluido; las papas se vuelven azules. Luego echamos unas gotas de yodo en un vaso de almidón diluido. El líquido también se vuelve azul.
Goteamos con una pipeta yodo disuelto en agua sobre una manzana, plátano, pan, a su vez.
Mirando:
La manzana no se volvió azul en absoluto. Plátano - ligeramente azul. Pan - se volvió muy azul. Esta parte de la experiencia muestra la presencia de almidón en varios alimentos.
Discusión: El almidón, al reaccionar con el yodo, da un color azul. Esta propiedad nos da la capacidad de detectar la presencia de almidón en diversos alimentos. Así, el yodo es, por así decirlo, un indicador o analizador del contenido de almidón.
Como sabes, el almidón se puede convertir en azúcar, si tomas una manzana verde y le echas yodo, se volverá azul, ya que la manzana aún no está madura. Tan pronto como la manzana madure, todo el almidón contenido se convertirá en azúcar y la manzana no se volverá azul cuando se trate con yodo.
La siguiente experiencia será útil para los niños que ya comenzaron a estudiar química en la escuela. Introduce conceptos tales como reacción química, reacción compuesta y reacción cualitativa.
Experimento No. 8 "Coloración de la llama o reacción compuesta"
Reactivos y equipo: pinzas, sal de mesa, lámpara de alcohol
Experimento: Tome con unas pinzas unos cristales de sal de mesa de sal gruesa. Sostenámoslos sobre la llama del mechero. La llama se volverá amarilla.
Discusión: Este experimento permite realizar una reacción de combustión química, que es un ejemplo de reacción compuesta. Debido a la presencia de sodio en la composición de la sal de mesa, durante la combustión, reacciona con el oxígeno. Como resultado, se forma una nueva sustancia: óxido de sodio. La aparición de una llama amarilla indica que la reacción ha pasado. Reacciones similares son reacciones cualitativas para compuestos que contienen sodio, es decir, se puede utilizar para determinar si una sustancia contiene sodio o no.