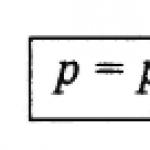Miscele di gas. La legge di Dalton
La pressione parziale è quella parte della pressione totale di una miscela di gas dovuta a un determinato gas o vapore. Il gas parziale nella miscela è uguale alla pressione del gas nella miscela che avrebbe da solo, occupando lo stesso volume che occupa la miscela alla stessa temperatura.
La legge di Dalton.In assenza di reazioni chimiche, la pressione totale della miscela di gas P total è pari alla somma delle pressioni parziali di tutti i gas in essa compresi p 1, p 2, p 3..., p n ˸
P totale = p 1 + p 2 + ... + p n. (62)
La pressione parziale di un dato gas è proporzionale alla frazione ᴇᴦο di molecole sul numero totale di molecole della miscela (frazione molare)˸
p i = P totale ·X i = P totale · . (63)
La frazione molare X i è il rapporto tra il numero di moli di una data sostanza - n i (o un certo tipo di particella) e il numero totale di moli della sostanza (o particelle) situate nel sistema n i.
La frazione molare può essere attribuita all'intero sistema o ad alcune fasi. In quest'ultimo caso, viene preso il rapporto tra il numero di moli di una data sostanza in questa fase e il numero totale di moli della sostanza che forma una data fase. La somma delle frazioni molari di tutte le sostanze che formano un sistema (o fase) è uguale all'unità.
La composizione delle miscele di gas può essere espressa anche utilizzando parti in peso e volumetriche. La frazione in peso di un dato gas in una miscela è il rapporto tra la massa di questo gas e la massa della miscela di gas. Se denotiamo le frazioni in peso dei gas con G 1, G 2, G 3, ..., G i; e le masse dei gas nella miscela - attraverso m 1, m 2, m 3, ..., mi e la massa totale della miscela di gas - attraverso m, quindi otteniamo˸
SOL 1 = SOL 2 = SOL 3 = … SOL n = (64)
SOL 1 + SOL 2 + SOL 3 + … + SOL n =1
m1 + m2 + m3 + … + mn = m.
Per esprimere la composizione di una miscela di gas in unità volumetriche è necessario portare i volumi di gas componenti la miscela alla stessa pressione e temperatura. Il volume di un singolo gas contenuto in una miscela ridotta alla pressione della miscela è chiamato volume ridotto. Per trovare il volume ridotto di gas alla pressione della miscela di gas Ptot e alla temperatura T è necessario utilizzare la legge di Boyle-Mariotte˸
p 1 V totale = v 1 P totale; p2V totale = v2P totale; p 3 V totale = v 3 P totale; ...; p n V totale = v n P totale,
dove v 1, v 2, v 3, ..., v n sono i volumi ridotti dei singoli gas che compongono la miscela; р 1, р 2, р 3, …, р n – pressioni parziali dei singoli gas;
v1 = v2 = v3 = …; v n = (65)
La somma dei volumi ridotti dei singoli gas è uguale al volume totale della miscela˸
v 1 + v 2 + v 3 + … + v n = V totale.
Il rapporto tra i volumi ridotti dei singoli gas e il volume totale della miscela è chiamato frazione volumetrica e si esprime tramite r˸
r1 = r2 = r3 = ...; r n = (66)
Per le miscele di gas la composizione espressa in volume e frazioni molari è la stessa, cioè˸
Miscele di gas. Legge di Dalton: concetto e tipi. Classificazione e caratteristiche della categoria "Miscele di gas. Legge di Dalton" 2015, 2017-2018.
Vale la pena menzionare altre due leggi sul gas. Uno di questi riguarda il numero di molecole di gas diversi alle stesse pressioni e temperature, l'altro riguarda la miscela di gas.
Legge di Avogadro
All'inizio del XIX secolo. è stata stabilita la regola dei rapporti multipli per i gas che entrano in una reazione chimica. Se le temperature e le pressioni dei gas che si combinano tra loro sono uguali, allora i loro volumi sono in rapporti semplici: 1:1, 1:2, 1:3, ecc. Sulla base di questa regola, Avogadro nel 1811 espresse un'audace affermazione a riguardo ipotesi temporale: Volumi uguali di gas alle stesse temperature e pressioni contengono lo stesso numero di molecole. In un rapporto di 1:1 le molecole dei gas reagenti sono collegate a coppie. Se il rapporto volumetrico è 1:2, allora ciascuna molecola del primo gas attacca a sé due molecole del secondo, ecc.
Attualmente l'ipotesi di Avogadro è stata rigorosamente dimostrata e si chiama legge di Avogadro.
Secondo la legge di Avogadro gas diversi, presi in una quantità di 1 mole, hanno gli stessi volumi alle stesse pressioniR e temperatureT , poiché il numero di molecole in essi contenute è lo stesso. In condizioni normali, cioè ad una temperatura di 0 °C e ad una pressione atmosferica di 101.325 Pa, questo volume, come mostrano le misurazioni, è pari a
Volume V M 0 chiamato molare.
Perché in volumi uguali di gas alle stesse pressioni e temperature si trova sempre lo stesso numero di molecole, indipendentemente dal gas prelevato? Ciò può essere spiegato solo utilizzando l’energia cinetica molecolare (vedi §4.5).
La legge di Dalton
Più spesso non si tratta di gas puro: ossigeno, idrogeno, ecc., Ma di una miscela di gas. L'aria atmosferica, in particolare, è una miscela di azoto, ossigeno e molti altri gas. Ciascuno dei gas presenti nella miscela fornisce il proprio “contributo” alla pressione totale sulle pareti del recipiente. La pressione che avrebbe ciascuno dei gas componenti la miscela se i restanti gas venissero rimossi dal recipiente si chiama pressione parziale (cioè privata).
L'ipotesi più semplice che si può fare è quella della pressione della miscela di gas R pari alla somma delle pressioni parziali di tutti gas pag 1 , R 2 , R 3 ...:
 (3.8.2)
(3.8.2)
Il chimico inglese D. Dalton ha scoperto che per i gas sufficientemente rarefatti questo è esattamente il caso nella realtà. La relazione (3.8.2) è detta legge di Dalton.
Dal punto di vista della teoria cinetica molecolare, la legge di Dalton è soddisfatta perché l'interazione tra le molecole di un gas ideale è trascurabile. Pertanto ogni gas esercita sulla parete del recipiente la stessa pressione come se non ci fossero altri gas.
Una mole di qualsiasi gas in condizioni normali occupa un volume 22,4 l. Questo valore di volume è stato stabilito sperimentalmente. In una miscela di gas ciascuno di essi esercita una pressione sulle pareti del contenitore, indipendentemente dalla presenza di altri gas.
§ 3.9. Equazione di stato dei gas ideali
Lo stato di una data massa di gas è caratterizzato da tre parametri macroscopici: pressione p, volumeVe la temperatura T. Ora troveremo la connessione tra loro.
Equazione di stato
Nei § 3.5 e 3.6 avete familiarizzato con il comportamento di un gas ideale in condizioni appositamente create. Due parametri su tre (p, V O V, T) cambiato ad un valore costante della terza (G o R). Tipicamente, in natura e nella tecnologia, il gas cambia tutti e tre i parametri contemporaneamente. Ad esempio, quando l'aria riscaldata sulla superficie della Terra sale, si espande, la sua pressione diminuisce e la temperatura diminuisce.
Utilizzando le leggi dei gas (3.5.2) e (3.7.8), possiamo ottenere un'equazione che mette in relazione tutti e tre i parametri P, V E T, che caratterizza lo stato di un gas di una data massa. Questa equazione è detta equazione di stato dei gas ideali.
Se un gas è costituito da una miscela di più gas, la legge di Dalton aiuterà a calcolare la pressione della miscela
Dove pvp 2 , ръ - pressioni parziali gas contenuti nella miscela.
Pressione parzialeè la pressione che avrebbe un gas se occupasse da solo l'intero volume disponibile.
Teoria cinetica molecolare(MKT) è nato nel XIX secolo. e ha presentato la struttura della materia (principalmente gas) dal punto di vista di tre disposizioni:
- tutti i corpi sono costituiti da particelle: atomi e molecole;
- le particelle sono in continuo movimento caotico (termico);
- le particelle interagiscono tra loro attraverso urti perfettamente elastici.
La MCT è diventata una delle teorie fisiche di maggior successo ed è stata confermata da una serie di fatti sperimentali. C'era una chiara conferma sperimentale del caotico movimento termico di atomi e molecole Moto browniano.
Movimento browniano - questo fenomeno fu scoperto da Robert Brown 1 nel 1827. Osservando al microscopio il movimento del polline dei fiori sospeso nell'acqua, vide traiettorie disordinate a zigzag delle particelle.
La causa del moto browniano è il movimento termico delle molecole del mezzo, causato dalle fluttuazioni di pressione. Gli impatti delle molecole del mezzo portano la particella in movimento casuale: la sua velocità cambia rapidamente in grandezza e direzione. Una teoria completa del moto browniano fu data successivamente da Albert Einstein e Marian Smoluchowski.
Equazione MKT di base. La pressione di un gas sulla parete di un recipiente è determinata dall'impulso che le molecole di gas impartiscono alla parete del recipiente quando entrano in collisione con essa. Maggiore è la velocità della molecola, maggiore è l'impulso che trasporta, più forte agisce sulla parete, cioè R ~ v. Inoltre, maggiore è la massa della molecola T, maggiore è l'impulso, R ~ T. Maggiore è la concentrazione di molecole P, più spesso si verificano collisioni, quindi, R ~ P. Supponendo che la pressione sia distribuita equamente in tutte le direzioni nello spazio (x, z/, z), scriviamo infine

Energia cinetica di una molecola E = mv/ 2. Collegando le ultime due equazioni tra loro, otteniamo

Si chiama l'ultima equazione equazione base di MKT. Questa equazione indica l'energia cinetica media delle molecole di gas ideali (E) proporzionale alla sua temperatura T. Si noti che l'equazione è scritta per un gas ideale monoatomico. Per un gas poliatomico assumerà la forma

Dove io- il numero di gradi di libertà di una molecola a te già nota. Dall'uguaglianza

segue quello velocità quadratica media radice molecole di un gas monoatomico sono pari a

La distribuzione di Maxwell 1 è una distribuzione di probabilità, spesso riscontrabile in parti uguali della fisica (e non solo), ed è alla base della MCT. La distribuzione di Maxwell è applicabile anche ai processi di trasferimento elettronico, per descrivere le proprietà delle singole molecole in un gas. Tipicamente questa distribuzione si riferisce alla distribuzione delle energie delle molecole in un gas, ma può anche essere applicata alla distribuzione delle velocità, dei momenti e del modulo delle molecole. Può anche essere espresso come una distribuzione discreta su molti livelli energetici discreti o come una distribuzione continua su un continuum di energia.
Ci limiteremo a considerare una sola applicazione della distribuzione di Maxwell: la distribuzione della velocità delle molecole di gas.
Matematicamente, la funzione di distribuzione di Maxwell (Fig. 4.1) è scritta come segue:


Riso. 4.1.
Spieghiamo il significato matematico della funzione di distribuzione. Qualsiasi funzione di distribuzione (inclusa quella di Maxwell) mostra la probabilità che una certa quantità (nel nostro caso, la velocità delle molecole di gas) v) assume un certo valore specificato. Funzione di distribuzione della velocità di Maxwell f(v) mostra la probabilità che la velocità di una molecola di gas sia v.
Nella fig. 4.1 sulla curva di distribuzione della velocità sono segnati tre punti caratteristici: o - più probabilmente velocità della molecola (corrisponde al massimo, poiché ha la probabilità più alta, da qui il nome), r> sr - velocità media molecole (la sua probabilità è leggermente inferiore) eg; kv- significa quadrato velocità (con ancora meno probabilità).
Definiamo le espressioni matematiche per tutte e tre le velocità. Per trovare la velocità più probabile che corrisponde al valore massimo /( v),è necessario calcolare df/dv, impostalo uguale a zero e risolvi v

James Clerk Maxwell (1831-1879) - fisico e matematico britannico. Ha gettato le basi dell'elettrodinamica classica moderna (equazioni di Maxwell), ha introdotto nella fisica i concetti di corrente di spostamento e di campo elettromagnetico, ha predetto l'esistenza delle onde elettromagnetiche, la natura elettromagnetica della luce, è uno dei fondatori della teoria cinetica dei gas e l'autore del principio della fotografia a colori.
Formulazione di leggi
Legge sulla pressione totale di una miscela di gas
Legge sulla solubilità dei componenti delle miscele gassose
A temperatura costante, la solubilità in un dato liquido di ciascuno dei componenti della miscela di gas posti al di sopra del liquido è proporzionale alla loro pressione parziale.
Limiti di applicabilità
Entrambe le leggi di Dalton sono strettamente soddisfatte per i gas ideali. Per i gas reali queste leggi sono applicabili a condizione che la loro solubilità sia bassa e il loro comportamento sia vicino a quello di un gas ideale.
Storia della scoperta
La legge di addizione delle pressioni parziali fu formulata nel 1801. Allo stesso tempo, la giustificazione teorica corretta, basata sulla teoria cinetica molecolare, è stata fatta molto più tardi.
Appunti
Fondazione Wikimedia. 2010.
Scopri cosa sono le "Leggi di Dalton" in altri dizionari:
LE LEGGI DI DALTON- (Dalton Dalton): prima legge, la pressione totale di una miscela di gas ideali che non interagiscono chimicamente tra loro è uguale alla somma parziale (vedi) dei singoli gas che compongono la miscela, cioè delle pressioni che ogni gas produrrebbe in... ... Grande Enciclopedia del Politecnico
Le leggi di Dalton- scoperto dal fisico e chimico inglese J. Dalton (1766 1844) nel 1801 e 1803. 1) la pressione di una miscela di gas ideali chimicamente non interagenti è pari alla somma delle pressioni parziali. Applichiamolo ai gas reali a temperature e pressioni... ... Concetti delle scienze naturali moderne. Glossario dei termini fondamentali
Le leggi fondamentali della chimica possono essere suddivise in qualitative e quantitative. Indice 1 Leggi qualitative 1.1 I. Legge di fase di Gibbs ... Wikipedia
LE LEGGI DI DALTON- (più correttamente Dalton, Dalton). 1. La legge dei rapporti multipli, scoperta da D., è che gli elementi sono inclusi in una sostanza chimica. connessioni in rapporti che sono sempre multipli di certi numeri primi. Quindi, se hanno acqua, allora per una parte in peso di idrogeno... ... Grande Enciclopedia Medica
LEGGI DI DALTON: 1) la pressione di una miscela di gas che non interagiscono chimicamente tra loro è uguale alla somma delle loro pressioni parziali 2) la solubilità di un componente di una miscela di gas in un dato liquido a temperatura costante è proporzionale al parziale... ... Grande dizionario enciclopedico
1) la pressione di una miscela di gas ideali chimicamente non interagenti è pari alla somma delle pressioni parziali. Approssimativamente applicabile ai gas reali a temperature p e pressioni lontane da quelle critiche. 2) A costante tasso di solubilità in un dato liquido... ... Enciclopedia fisica
1) la pressione di una miscela di gas ideali chimicamente non interagenti è pari alla somma delle pressioni parziali. Applicabile approssimativamente ai gas reali a temperature e pressioni lontane da quelle critiche. 2) A costante solubilità della temperatura in un dato ... Enciclopedia fisica
LEGGI DI DALTON: 1) la pressione di una miscela di gas che non interagiscono chimicamente tra loro è uguale alla somma delle loro pressioni parziali; 2) la solubilità di un componente di una miscela di gas in un dato liquido a temperatura costante è proporzionale alla parziale... ... Dizionario enciclopedico
Descrivere i processi che si verificano in sistemi in equilibrio “soluzione liquida-vapore” sotto l'influenza della temperatura o della pressione. Indice 1 Prima legge di Konovalov 2 Seconda legge di Konovalov ... Wikipedia
Questo articolo o sezione necessita di revisione. Si prega di migliorare l'articolo in conformità con le regole per la scrittura di articoli. Il tutto...Wikipedia
Le miscele di gas in cui i componenti non interagiscono tra loro possono essere descritte utilizzando la legge di Dalton. Mette in relazione le pressioni parziali dei componenti e le loro frazioni molari in un'unica equazione. Diamo uno sguardo più da vicino a questa legge e mostriamo anche come può essere utilizzata con esempi specifici.
Gas ideali
La legge di Dalton in fisica risulta valida esclusivamente per i gas ideali. Si tratta di gas le cui particelle costituenti (atomi, molecole) non interagiscono tra loro. Per un gas ideale con un numero costante di molecole (atomi) al suo interno (n = const), è valida un'uguaglianza che mette in relazione tre parametri macroscopici (pressione P, volume V e temperatura T):
P*V = n*R*T, R = 8,314 J/(K*mol) è un valore costante.
Tutti i gas reali a pressioni di diverse atmosfere e temperature dell'ordine della temperatura ambiente e superiori possono essere considerati ideali con buona precisione, cioè per loro vale l'uguaglianza di cui sopra.
Pressione parziale del componente
Per comprendere l'essenza della legge di Dalton è necessario comprendere il concetto di "pressione parziale".
Poiché le molecole di gas diversi non si “sentono” tra loro, per ciascun componente chimico i nella miscela di gas sarà vera l’uguaglianza:
La pressione Pi è detta parziale per la componente i-esima. In altre parole, la pressione parziale è la pressione che solo la i-esima componente crea sulle pareti del vaso. Si chiama parziale perché fa parte della pressione totale, o di una sua porzione.
Enunciato della legge di Dalton

Nei primi anni del 19° secolo, studiando il comportamento di diverse miscele di gas, lo scienziato britannico John Dalton stabilì il seguente fatto: se si sommano tutte le pressioni parziali dei componenti di una miscela di gas, si ottiene una pressione totale che può essere misurato con un barometro, un manometro o un altro dispositivo progettato per questo. Questa è la legge di Dalton. Scriviamolo sotto forma di uguaglianza matematica:
Puoi capire perché questa uguaglianza è vera se ricordi che i componenti della miscela creano pressione indipendentemente l'uno dall'altro.
Considerando che la pressione parziale Pi è direttamente proporzionale alla quantità di sostanza ni componente i, il che è sempre vero quando T = cost e V = cost, allora arriviamo ad un'altra uguaglianza:
La quantità xi è detta frazione molare. È legato alle percentuali atomiche ai del componente mediante una semplice relazione:
Un'espressione che permette di determinare la frazione molare di un componente attraverso la sua pressione parziale e viceversa è detta anche legge di Dalton.

Non va dimenticato che la legge considerata è valida non solo nel caso dei gas ideali, ma anche in assenza di reazioni chimiche in essi. Questi ultimi portano a cambiamenti nella composizione dei componenti e nella composizione molare, che violano la legge sulla pressione della miscela di gas.
Esempi di risoluzione dei problemi
In questo paragrafo considereremo esempi di applicazione della legge di Dalton per risolvere problemi pratici.
Compito 1. È necessario determinare la pressione parziale dei tre componenti principali nell'aria secca.
Dalla letteratura si può apprendere che, essendo l'aria secca, i suoi componenti principali saranno l'azoto (circa il 78%), l'ossigeno (circa il 21%) e il gas nobile argon (circa l'1%). Considerando che la pressione totale dell'aria al livello del mare è di 1 atmosfera, e convertendo le percentuali atomiche in frazioni molari, otteniamo le pressioni parziali per ciascun componente:
Pi = Ptot*xiPN2 = 1 *0,78 = 0,78 atm.PO2 = 1*0,21 = 0,21 atm.PAr = 1*0,01 = 0,01 atm.
Problema 2. Ci sono due bombole con gas puliti. La prima bombola contiene azoto con una temperatura di 300 K, un volume di 10 litri e una pressione di 2 atmosfere. La seconda bombola contiene ossigeno con una temperatura di 300 K, ma avente un volume di 15 litri e una pressione di 1,5 atmosfere. Entrambi i cilindri erano collegati tra loro. È necessario calcolare la pressione parziale di ciascun componente nella miscela risultante.

Iniziamo a risolvere questo problema calcolando la quantità di sostanza per azoto e ossigeno. Utilizzando l'equazione dei gas ideali otteniamo:
PN2*VN2 = nN2*R*T =>nN2 = PN2*VN2/R*T = 2*101325*10-2/(8,314*300) = 0,812 mol nO2 = PO2*VO2/R*T = 1, 5*101325*1,5*10-2/(8,314*300) = 0,914 moli.
Quando due bombole sono collegate, i gas vengono miscelati in modo che ciascun componente occupi l'intero volume delle due bombole. La pressione totale che ci sarà nel sistema può essere calcolata utilizzando anche l'equazione di stato di un gas ideale:
Vtot = VN2+VO2 = 2,5*10-2 m3 n = nN2+nO2 = 0,812+0,914 = 1,726 mol. Ptot = n*R*T/Vtot = 1,726*8,314*300/(2,5*10 -2) = 172199,568 Pa o 1,7 atm.
Ora puoi applicare le formule della legge di Dalton per calcolare le pressioni parziali di ossigeno e azoto:
PN2 = Ptot*nN2/n = 1,7*0,812/1,726 = 0,8 atm; PO2 = Ptot - PN2 = 1,7 - 0,8 = 0,9 atm;
Il rapporto tra le pressioni parziali risultanti dei gas è uguale al rapporto tra le quantità di sostanza per essi.