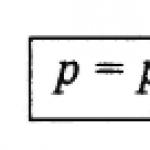Plinske smjese. Daltonov zakon
Parcijalni tlak je onaj dio ukupnog tlaka plinske smjese koji je posljedica određenog plina ili pare. Parcijalni plin u smjesi jednak je tlaku plina u smjesi koji bi imala sama, zauzimajući isti volumen kao što smjesa zauzima pri istoj temperaturi.
Daltonov zakon.U nedostatku kemijskih reakcija, ukupni tlak plinske smjese P total jednak je zbroju parcijalnih tlakova svih plinova uključenih u nju p 1, p 2, p 3 ..., p n ˸
P ukupno = p 1 + p 2 + ... + p n. (62)
Parcijalni tlak određenog plina proporcionalan je udjelu ᴇᴦο molekula od ukupnog broja molekula smjese (molni udio)˸
p i = P ukupno ·X i = P ukupno · . (63)
Molni udio X i je omjer broja molova dane tvari - n i (ili određene vrste čestica) prema ukupnom broju molova tvari (ili čestica) smještenih u sustavu n i.
Molni udio može se pripisati ili cijelom sustavu ili nekoj fazi. U potonjem slučaju uzima se omjer broja molova dane tvari u ovoj fazi prema ukupnom broju molova tvari koja tvori ovu fazu. Zbroj molnih udjela svih tvari koje tvore sustav (ili fazu) jednak je jedinici.
Sastav plinskih smjesa također se može izraziti pomoću težinskih i volumetrijskih dijelova. Težinski udio danog plina u smjesi je omjer mase tog plina i mase plinske smjese. Označimo li težinske udjele plinova s G 1, G 2, G 3, ..., G i; i mase plinova u smjesi - kroz m 1, m 2, m 3, ..., m i i ukupne mase plinske smjese - kroz m, tada dobivamo˸
G 1 = G 2 = G 3 = … G n = (64)
G 1 + G 2 + G 3 + … + G n =1
m 1 + m 2 + m 3 + … + m n = m.
Da bi se sastav plinske smjese izrazio u volumetrijskim jedinicama, potrebno je dovesti volumene plinova koji čine smjesu na isti tlak i temperaturu. Volumen pojedinog plina uključenog u smjesu sveden na tlak smjese naziva se reducirani volumen. Da bi se našao reducirani volumen plina pri tlaku plinske smjese Ptot i temperaturi T, potrebno je koristiti Boyle-Mariotteov zakon˸
p 1 V ukupno = v 1 P ukupno; p 2 V ukupno = v 2 P ukupno; p 3 V ukupno = v 3 P ukupno; ... ; p n V ukupno = v n P ukupno,
gdje su v 1, v 2, v 3, ..., v n reducirani volumeni pojedinačnih plinova koji čine smjesu; r 1, r 2, r 3, …, r n – parcijalni tlakovi pojedinih plinova;
v 1 = v 2 = v 3 = …; v n = (65)
Zbroj reduciranih volumena pojedinih plinova jednak je ukupnom volumenu smjese˸
v 1 + v 2 + v 3 + … + v n = V ukupno.
Omjer reduciranih volumena pojedinih plinova prema ukupnom volumenu smjese naziva se volumni udio i izražava se kroz r˸
r 1 = r 2 = r 3 = ...; r n = (66)
Za plinske smjese, sastav izražen volumnim i molnim udjelima je isti, tj.˸
Plinske smjese. Daltonov zakon – pojam i vrste. Klasifikacija i značajke kategorije "Plinske smjese. Daltonov zakon" 2015., 2017.-2018.
Vrijedno je spomenuti još dva plinska zakona. Jedna se odnosi na broj molekula različitih plinova pri istim tlakovima i temperaturama, a druga na mješavinu plinova.
Avogadrov zakon
Početkom 19.st. uspostavljeno je pravilo višestrukih omjera za plinove koji stupaju u kemijsku reakciju. Ako su temperature i tlakovi plinova koji se međusobno spajaju jednaki, tada su njihovi volumeni u jednostavnim omjerima: 1:1, 1:2, 1:3, itd. Na temelju ovog pravila, Avogadro je 1811. izrazio hrabru izjavu za ovo vremenska hipoteza: Jednaki volumeni plinova pri istim temperaturama i tlakovima sadrže isti broj molekula. U omjeru 1:1 molekule reagirajućih plinova su povezane u parove. Ako je omjer volumena 1:2, tada svaka molekula prvog plina na sebe veže dvije molekule drugog itd.
Trenutno je Avogadrova pretpostavka strogo dokazana i naziva se Avogadrov zakon.
Prema Avogadrovom zakonu različiti plinovi, uzeti u količini od 1 mola, imaju iste volumene pri istim tlakovimaR i temperaturet , budući da je broj molekula u njima isti. U normalnim uvjetima, tj. pri temperaturi od 0 °C i atmosferskom tlaku od 101,325 Pa, ovaj volumen, kako mjerenja pokazuju, jednak je
Volumen V M 0 zvan kutnjak.
Zašto se u jednakim volumenima plinova pri istim tlakovima i temperaturama uvijek nalazi isti broj molekula, neovisno o tome koji se plin uzima? Ovo se može objasniti samo uporabom molekularne kinetičke energije (vidi §4.5).
Daltonov zakon
Češće se ne bave čistim plinom - kisikom, vodikom itd., Već mješavinom plinova. Konkretno, atmosferski zrak je mješavina dušika, kisika i mnogih drugih plinova. Svaki od plinova u smjesi daje svoj “doprinos” ukupnom pritisku na stijenke posude. Tlak koji bi svaki od plinova koji čine smjesu imao kad bi se preostali plinovi uklonili iz posude naziva se parcijalni (tj. privatni) tlak.
Najjednostavnija pretpostavka koja se može napraviti jest da tlak plinske smjese R jednak zbroju parcijalnih tlakova svih plinovi str 1 , R 2 , R 3 ...:
 (3.8.2)
(3.8.2)
Engleski kemičar D. Dalton otkrio je da se za dovoljno razrijeđene plinove upravo to događa u stvarnosti. Odnos (3.8.2) naziva se Daltonov zakon.
Sa stajališta molekularne kinetičke teorije, Daltonov zakon je zadovoljen jer je međudjelovanje između molekula idealnog plina zanemarivo. Stoga svaki plin vrši isti pritisak na stijenku posude kao da drugih plinova nema.
Mol bilo kojeg plina u normalnim uvjetima zauzima volumen 22,4 l. Ova vrijednost volumena utvrđena je eksperimentalno. U mješavini plinova svaki od njih vrši pritisak na stijenke spremnika, bez obzira na prisutnost drugih plinova.
§ 3.9. Jednadžba stanja idealnog plina
Stanje dane mase plina karakteriziraju tri makroskopska parametra: tlak p, volumenVa temperatura T. Sada ćemo pronaći vezu između njih.
Jednadžba stanja
U § 3.5 i 3.6 ste se upoznali s ponašanjem idealnog plina u posebno stvorenim uvjetima. Dva parametra od tri (p, V ili V, T) mijenjao pri konstantnoj vrijednosti trećine (G ili R). Tipično, u prirodi i tehnologiji, plin mijenja sva tri parametra odjednom. Na primjer, kada se zrak zagrijan na površini Zemlje diže, on se širi, njegov tlak opada, a temperatura opada.
Koristeći plinske zakone (3.5.2) i (3.7.8), možemo dobiti jednadžbu koja povezuje sva tri parametra str, V I T, karakteriziranje stanja plina dane mase. Ova se jednadžba naziva jednadžba stanja idealnog plina.
Ako se plin sastoji od mješavine nekoliko plinova, tada će Daltonov zakon pomoći u izračunavanju tlaka mješavine
Gdje p v str 2 , rʺ - parcijalni pritisci plinovi uključeni u smjesu.
Parcijalni tlak je tlak koji bi plin imao kada bi sam zauzimao cijeli raspoloživi volumen.
Molekularno kinetička teorija(MKT) nastao je u 19. stoljeću. i predstavio strukturu tvari (uglavnom plinova) sa stajališta tri odredbe:
- sva tijela se sastoje od čestica: atoma i molekula;
- čestice su u kontinuiranom kaotičnom gibanju (termalno);
- čestice međusobno djeluju kroz savršeno elastične sudare.
MCT je postala jedna od najuspješnijih fizikalnih teorija i potvrđena je nizom eksperimentalnih činjenica. Jasna eksperimentalna potvrda kaotičnog toplinskog gibanja atoma i molekula bila je Brownovo gibanje.
Brownovo gibanje - ovaj fenomen otkrio je Robert Brown 1 1827. Promatrajući kroz mikroskop kretanje cvjetnog polena suspendiranog u vodi, vidio je neuređene cik-cak putanje čestica.
Uzrok Brownovog gibanja je toplinsko gibanje molekula medija koje je uzrokovano fluktuacijama tlaka. Udari molekula medija vode česticu u nasumično gibanje: njezina brzina brzo se mijenja u veličini i smjeru. Potpunu teoriju Brownovog gibanja dali su kasnije Albert Einstein i Marian Smoluchowski.
Osnovna MKT jednadžba. Tlak plina na stijenku posude određen je impulsom koji molekule plina daju stijenci posude kada se s njom sudare. Što je veća brzina molekule, to nosi veći impuls, jače djeluje na stijenku, tj. R ~ v. Osim toga, što je veća masa molekule T, što je veći impuls, R ~ T.Što je veća koncentracija molekula P, češće dolazi do sudara, dakle, R ~ P. Uz pretpostavku da je tlak jednako raspoređen u svim smjerovima u prostoru (x, z/, z), konačno pišemo

Kinetička energija jedne molekule E = mv / 2. Povezivanjem zadnje dvije jednadžbe jedna s drugom, dobivamo

Posljednja jednadžba zove se osnovna jednadžba MKT. Ova jednadžba pokazuje da je prosječna kinetička energija molekula idealnog plina (E) proporcionalan svojoj temperaturi T. Imajte na umu da je jednadžba napisana za monatomski idealni plin. Za poliatomski plin poprimit će oblik

Gdje ja - broj stupnjeva slobode molekule koji vam je već poznat. Iz ravnopravnosti

slijedi to korijen srednje kvadratne brzine molekula jednoatomskog plina jednaka je

Maxwellova distribucija 1 je distribucija vjerojatnosti, koja se često nalazi u jednakim dijelovima fizike (i ne samo), a nalazi se u osnovi MCT-a. Maxwellova distribucija također je primjenjiva na procese elektroničkog prijenosa, za opisivanje svojstava pojedinačnih molekula u plinu. Obično se ova distribucija odnosi na distribuciju energija molekula u plinu, ali se također može primijeniti na distribuciju brzina, momenta i modula molekula. Također se može izraziti kao diskretna distribucija preko mnogo diskretnih energetskih razina ili kao kontinuirana distribucija kroz neki kontinuum energije.
Ograničit ćemo se na razmatranje samo jedne primjene Maxwellove distribucije - raspodjele brzina molekula plina.
Matematički, funkcija Maxwellove distribucije (slika 4.1) je zapisana na sljedeći način:


Riža. 4.1.
Objasnimo matematičko značenje funkcije distribucije. Bilo koja funkcija distribucije (uključujući Maxwellovu) pokazuje vjerojatnost da određena veličina (u našem slučaju brzina molekula plina v) uzima određenu određenu vrijednost. Maxwellova funkcija distribucije brzine f(v) pokazuje vjerojatnost da je brzina molekule plina v.
Na sl. 4.1 na krivulji raspodjele brzine označene su tri karakteristične točke: o - najvjerojatnije brzina molekule (odgovara maksimumu, jer ima najveću vjerojatnost, otuda i naziv), r> sr - Prosječna brzina molekule (vjerojatnost mu je nešto manja) i g; kv - glavni trg brzinom (s još manjom vjerojatnošću).
Definirajmo matematičke izraze za sve tri brzine. Za pronalaženje najvjerojatnije brzine koja odgovara maksimalnoj vrijednosti /( v), treba izračunati df/dv, postavite ga na nulu i riješite v

James Clerk Maxwell (1831. - 1879.) - britanski fizičar i matematičar. Postavio je temelje moderne klasične elektrodinamike (Maxwellove jednadžbe), uveo u fiziku pojmove struje pomaka i elektromagnetskog polja, predvidio postojanje elektromagnetskih valova, elektromagnetsku prirodu svjetlosti, jedan je od utemeljitelja kinetičke teorije plinova i autor principa fotografije u boji.
Formuliranje zakona
Zakon o ukupnom tlaku smjese plinova
Zakon o topljivosti sastojaka plinske smjese
Pri konstantnoj temperaturi, topljivost u određenoj tekućini svake od komponenti plinske smjese koja se nalazi iznad tekućine proporcionalna je njihovom parcijalnom tlaku.
Granice primjenjivosti
Oba Daltonova zakona su strogo zadovoljena za idealne plinove. Za stvarne plinove ovi su zakoni primjenjivi pod uvjetom da je njihova topljivost niska i ponašanje blisko idealnom plinu.
Povijest otkrića
Zakon zbrajanja parcijalnih tlakova formuliran je 1801. Istodobno, ispravno teoretsko opravdanje, temeljeno na molekularno-kinetičkoj teoriji, dano je mnogo kasnije.
Bilješke
Zaklada Wikimedia. 2010. godine.
Pogledajte što su "Daltonovi zakoni" u drugim rječnicima:
DALTONOVI ZAKONI- (Dalton Dalton): prvi zakon, ukupni tlak smjese idealnih plinova koji međusobno ne kemijski djeluju jednak je zbroju parcijalnih (vidi) pojedinačnih plinova koji čine smjesu, tj. tlakova koji bi svaki plin proizveo u ... ... Velika politehnička enciklopedija
Daltonovi zakoni- otkrio engleski fizičar i kemičar J. Dalton (1766. 1844.) 1801. i 1803. godine. 1) tlak smjese kemijski neinteragirajućih idealnih plinova jednak je zbroju parcijalnih tlakova. Primijenimo na stvarne plinove pri temperaturama i pritiscima... ... Pojmovi moderne prirodne znanosti. Rječnik osnovnih pojmova
Osnovni zakoni kemije mogu se podijeliti na kvalitativne i kvantitativne. Sadržaj 1 Kvalitativni zakoni 1.1 I. Gibbsov fazni zakon ... Wikipedia
DALTONOVI ZAKONI- (točnije Dalton, Dalton). 1. Zakon višestrukih omjera, koji je otkrio D., je da su elementi uključeni u kemikaliju. veze u omjerima koji su uvijek višekratnici određenih prostih brojeva. Dakle, ako imaju vodu, onda za jedan težinski dio vodika... ... Velika medicinska enciklopedija
DALTONOVI ZAKONI: 1) tlak mješavine plinova koji međusobno ne kemijski djeluju jednak je zbroju njihovih parcijalnih tlakova 2) topljivost komponente plinske smjese u određenoj tekućini pri konstantnoj temperaturi je proporcionalno djelomičnom... ... Veliki enciklopedijski rječnik
1) tlak smjese kemijski neinteragirajućih idealnih plinova jednak je zbroju parcijalnih tlakova. Približno primjenjivo na stvarne plinove pri temperaturama p i pritiscima daleko od kritičnih. 2) Na konstanti stopa topljivosti u određenoj tekućini... ... Fizička enciklopedija
1) tlak smjese kemijski neinteragirajućih idealnih plinova jednak je zbroju parcijalnih tlakova. Približno primjenjivo na stvarne plinove na temperaturama i pritiscima daleko od kritičnih. 2) Na konstanti temperaturna topljivost u određenom ... Fizička enciklopedija
DALTONOVI ZAKONI: 1) tlak smjese plinova koji međusobno ne kemijski djeluju jednak je zbroju njihovih parcijalnih tlakova; 2) topljivost komponente plinske smjese u određenoj tekućini pri konstantnoj temperaturi proporcionalna je djelomičnom... ... enciklopedijski rječnik
Opišite procese koji se odvijaju u ravnotežnim sustavima "tekuća otopina-para" pod utjecajem temperature ili tlaka. Sadržaj 1 Konovalovljev prvi zakon 2 Konovalovljev drugi zakon ... Wikipedia
Ovaj članak ili odjeljak treba revidirati. Molimo poboljšajte članak u skladu s pravilima za pisanje članaka. Cijela ... Wikipedia
Smjese plinova u kojima komponente ne djeluju jedna na drugu mogu se opisati Daltonovim zakonom. Povezuje parcijalne tlakove komponenata i njihove molarne frakcije u jednu jednadžbu. Pogledajmo pobliže ovaj zakon, a također pokažimo kako se može koristiti na konkretnim primjerima.
Idealni plinovi
Pokazalo se da Daltonov zakon u fizici vrijedi isključivo za idealne plinove. To su plinovi čije sastavne čestice (atomi, molekule) ne djeluju međusobno. Za idealan plin s konstantnim brojem molekula (atoma) u njemu (n = const) vrijedi jednakost koja povezuje tri makroskopska parametra (tlak P, volumen V i temperaturu T):
P*V = n*R*T, R = 8,314 J/(K*mol) je konstantna vrijednost.
Svi realni plinovi pri tlakovima od nekoliko atmosfera i temperaturama reda sobne temperature i više mogu se s dobrom točnošću smatrati idealnima, odnosno za njih vrijedi gornja jednakost.
Parcijalni tlak komponente
Za razumijevanje suštine Daltonovog zakona potrebno je razumjeti koncept "parcijalnog tlaka".
Budući da molekule različitih plinova ne "osjećaju" jedna drugu, za svaku kemijsku komponentu i u plinskoj smjesi vrijedit će jednakost:
Tlak Pi se naziva parcijalni za i-tu komponentu. Drugim riječima, parcijalni tlak je tlak koji samo i-ta komponenta stvara na stijenke posude. Naziva se djelomični jer je dio ukupnog tlaka, odnosno njegov dio.
Izjava o Daltonovom zakonu

Početkom 19. stoljeća, proučavajući ponašanje raznih plinskih smjesa, britanski znanstvenik John Dalton utvrdio je sljedeću činjenicu: zbroje li se svi parcijalni tlakovi komponenata plinske smjese, dobiva se ukupni tlak koji može se mjeriti barometrom, manometrom ili drugim za to namijenjenim uređajem. Ovo je Daltonov zakon. Zapišimo to u obliku matematičke jednakosti:
Možete razumjeti zašto je ova jednakost istinita ako se sjetite da komponente smjese stvaraju pritisak neovisno jedna o drugoj.
S obzirom da je parcijalni tlak Pi izravno proporcionalan količini tvari ni komponente i, što uvijek vrijedi kada je T = const i V = const, dolazimo do druge jednakosti:
Količina xi naziva se molni udio. Povezan je s atomskim postocima ai komponente jednostavnom relacijom:
Izraz koji omogućuje određivanje molnog udjela komponente kroz njezin parcijalni tlak i obrnuto naziva se i Daltonov zakon.

Ne treba zaboraviti da razmatrani zakon vrijedi ne samo u slučaju idealnih plinova, već iu odsutnosti kemijskih reakcija u njima. Potonji dovode do promjena u komponentnom i molarnom sastavu, što krši zakon za tlak plinske smjese.
Primjeri rješavanja problema
U ovom paragrafu razmotrit ćemo primjere primjene Daltonovog zakona za rješavanje praktičnih problema.
Zadatak 1. Potrebno je odrediti parcijalni tlak tri glavne komponente u suhom zraku.
Iz literature možete saznati da će, budući da je zrak suh, njegove glavne komponente biti dušik (oko 78%), kisik (oko 21%) i plemeniti plin argon (oko 1%). Uzimajući u obzir da je ukupni tlak zraka na razini mora 1 atmosfera i pretvarajući atomske postotke u molne frakcije, dobivamo parcijalne tlakove za svaku komponentu:
Pi = Ptot*xiPN2 = 1 *0,78 = 0,78 atm.PO2 = 1*0,21 = 0,21 atm.PAr = 1*0,01 = 0,01 atm.
Problem 2. Postoje dva cilindra s čistim plinovima. Prvi cilindar sadrži dušik s temperaturom od 300 K, volumenom od 10 litara i tlakom od 2 atmosfere. Drugi cilindar sadrži kisik s temperaturom od 300 K, ali ima volumen od 15 litara i tlak od 1,5 atmosfere. Oba su cilindra bila međusobno povezana. Potrebno je izračunati parcijalni tlak svake komponente u dobivenoj smjesi.

Počnimo rješavati ovaj problem izračunavanjem količine tvari za dušik i kisik. Koristeći jednadžbu idealnog plina, dobivamo:
PN2*VN2 = nN2*R*T =>nN2 = PN2*VN2/R*T = 2*101325*10-2/(8,314*300) = 0,812 mol nO2 = PO2*VO2/R*T = 1, 5*101325*1,5*10-2/(8,314*300) = 0,914 mol.
Kada su spojena dva cilindra, plinovi se miješaju tako da svaka komponenta zauzima cijeli volumen dva cilindra. Ukupni tlak koji će biti u sustavu može se izračunati također koristeći jednadžbu stanja idealnog plina:
Vtot = VN2+VO2 = 2,5*10-2 m3; n = nN2+nO2 = 0,812+0,914 = 1,726 mol. Ptot = n*R*T/Vtot = 1,726*8,314*300/(2,5*10 -2) = 172199,568 Pa ili 1,7 atm.
Sada možete primijeniti formule Daltonovog zakona za izračun parcijalnih tlakova kisika i dušika:
PN2 = Ptot*nN2/n = 1,7*0,812/1,726 = 0,8 atm; PO2 = Ptot - PN2 = 1,7 - 0,8 = 0,9 atm.
Omjer nastalih parcijalnih tlakova plinova jednak je omjeru količina tvari za njih.