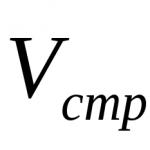1) Métodos físicos: evaporación (evaporación), destilación
Evaporación – evaporación incompleta del disolvente (reducción de volumen – concentración)
Evaporación – evaporación del disolvente hasta sequedad (seguido de disolución del residuo seco en un pequeño volumen)
Destilación – separación de componentes volátiles
2) Métodos químicos: precipitación, coprecipitación
Precipitación – separación (curso de análisis sistemático); concentración (precipitación del ion que se determinará a partir de un gran volumen de la solución analizada y disolución del precipitado en un pequeño volumen)
Coprecipitación – precipitación simultánea a partir de la misma solución de un microcomponente soluble en determinadas condiciones con un macrocomponente precipitado.
Causas de la coprecipitación: 1) adsorción superficial: la sustancia coprecipitada se adsorbe en la superficie del colector y se deposita en él; 2) oclusión: captura mecánica de parte de la solución madre con el ion coprecipitado dentro del sedimento colector; 3) inclusión – formación de cristales mixtos
La coprecipitación se utiliza para concentrar sustancias presentes en microcantidades en la solución analizada, seguido de su determinación en el concentrado.
3) Métodos fisicoquímicos: extracción, cromatografía
Extracción – un método para extraer una sustancia de una solución o mezcla seca utilizando un disolvente adecuado. Para extraer de una solución se utilizan disolventes que son inmiscibles con esta solución, pero en los que la sustancia se disuelve mejor que en el primer disolvente. La extracción se utiliza en las industrias química, de refinación de petróleo, alimentaria, metalúrgica y farmacéutica.
cromatografía – método de sorción dinámica para separar y analizar mezclas de sustancias, así como para estudiar las propiedades fisicoquímicas de las sustancias. Se basa en la distribución de sustancias entre dos fases: estacionaria (fase sólida o líquida unida a un portador inerte) y móvil (fase gaseosa o líquida).
88. Métodos de análisis químico cualitativo.
Análisis microcristaloscópico.
Las reacciones que producen compuestos con formas cristalinas características se pueden utilizar para detectar cationes y aniones. La forma y la velocidad de formación de cristales se ven afectadas por las condiciones de reacción. Un papel importante en las reacciones microcristaloscópicas lo desempeña la rápida evaporación del disolvente, lo que conduce a la concentración de la solución y, en consecuencia, a un aumento de la sensibilidad de la determinación de iones.
Análisis piroquímico
Al calentar sustancias en la llama de un quemador, se pueden observar varios fenómenos característicos: evaporación, fusión, cambio de color, coloración de la llama. Todos estos fenómenos se utilizan en el análisis cualitativo para las pruebas preliminares de una sustancia. A veces, con la ayuda de reacciones piroquímicas, es posible aumentar selectividad y sensibilidad de determinación. Reacciones piroquímicas utilizado para el análisis de minerales en el campo.
Coloración de llama
Cuando una solución de sal metálica se introduce en la llama, se producen una serie de procesos complejos: evaporación, formación de aerosoles sólidos, disociación, ionización, interacción con oxígeno, excitación de átomos, iones y moléculas. El resultado final de estos procesos es el efecto utilizado analíticamente: resplandor de la llama.
89. Métodos para determinar la composición cuantitativa de compuestos.

90. Cantidades físicas básicas
Cantidad física – una propiedad física de un objeto material, fenómeno físico, proceso que puede caracterizarse cuantitativamente.
Valor de cantidad física – un número que caracteriza esta cantidad física, indicando la unidad de medida a partir de la cual se obtuvieron.
Sistema de unidades físicas – un conjunto de unidades de medida de cantidades físicas, en el que hay un cierto número de las llamadas unidades de medida básicas, y las unidades de medida restantes se pueden expresar a través de estas unidades básicas. SI (Sistema Internacional) - Sistema Internacional de Unidades. El SI es el sistema de unidades más utilizado en el mundo, tanto en la vida cotidiana como en la ciencia y la tecnología.
En el sistema SI, cada cantidad básica tiene una unidad correspondiente: unidad de longitud– metro (m); unidad de tiempo- segundos); unidad de masa– kilogramo (kg); unidades intensidad de corriente eléctrica– amperio (A); unidad de temperatura– grados Kelvin (K); unidad de cantidad de sustancia– mol (mol); unidad de intensidad luminosa– candela (cd)
En el uso práctico, las unidades del Sistema Internacional a menudo resultan ser demasiado grandes o demasiado pequeñas, por lo que se pueden formar múltiplos y submúltiplos decimales utilizando prefijos especiales.
| caja de resonancia | Sí | 10 1 | deci | d | 10 -1 |
| hecto | GRAMO | 10 2 | centi | Con | 10 -2 |
| kilo | A | 10 3 | Mili | metro | 10 -3 |
| mega | METRO | 10 6 | micro | mk | 10 -6 |
| giga | GRAMO | 10 9 | nano | norte | 10 -9 |
| tera | t | 10 12 | pico | PAG | 10 -12 |
| peta | PAG | 10 15 | femto | F | 10 -15 |
| exá | mi | 10 18 | en A | A | 10 -18 |
91. El concepto de métodos físicos y su clasificación.
92. Uso de métodos físicos en la investigación de expertos.
93. El concepto de cantidad física “densidad”. Métodos para determinar la densidad.
Densidad – una cantidad física igual a la relación entre la masa corporal y su volumen ( ρ = metro/V). Según la definición de densidad, su dimensión. kg/m3 en el sistema SI.
La densidad de una sustancia depende de la masa de los átomos que la componen y la densidad de empaquetamiento de los átomos y moléculas de la sustancia. Cuanto mayor es la masa de los átomos y cuanto más cerca están entre sí, mayor es la densidad.
Medidores de densidad Se utiliza para medir la densidad de líquidos, gases y sólidos.
Densidad de la materia no homogénea. - la relación entre masa y volumen cuando este último se contrae hasta el punto en el que se mide la densidad. La relación de las densidades de dos sustancias bajo ciertas condiciones físicas estándar se llama densidad relativa; para sustancias líquidas y sólidas se mide a temperatura t, generalmente en relación con la densidad del agua destilada a 4°C, para gases– en relación con la densidad del aire seco o del hidrógeno en condiciones normales ( t= 273K, pag = 1,01·105Pa).
Para sólidos a granel y porosos, se distinguen densidades. verdadero (la masa de una unidad de volumen de un material denso que no contiene poros), aparente (la masa de una unidad de volumen de material poroso hecho de granos o gránulos) y a granel (la masa de una unidad de volumen de una capa de material ).
94. El concepto de cantidad física “masa”. Métodos para determinar la masa.
Peso – una cantidad física escalar, una de las principales características de la materia, que determina sus propiedades inerciales y gravitacionales. Hay masa inercial y masa gravitacional.
El concepto de masa se introdujo en la mecánica. Yo Newton. En mecanica clasica Newton la masa está incluida en la definición de impulso (cantidad de movimiento) de un cuerpo: impulso R proporcional a la velocidad del cuerpo V , p=mv (1). Factor de proporcionalidad – un valor constante para un cuerpo dado metro– y hay masa corporal. La definición equivalente de masa se obtiene de la ecuación de movimiento de la mecánica clásica. F=ma(2). Aquí la masa es el coeficiente de proporcionalidad entre la fuerza que actúa sobre el cuerpo. F y la aceleración del cuerpo causada por él. a. La masa determinada por las relaciones (1) y (2) se llama masa inercial (inercial) ; caracteriza las propiedades dinámicas del cuerpo, es una medida de la inercia del cuerpo: con una fuerza constante, cuanto mayor es la masa del cuerpo, menos aceleración adquiere, es decir cuanto más lento cambia el estado de su movimiento.
En la teoría de la gravedad. Newton La masa actúa como fuente del campo gravitacional. Cada cuerpo crea un campo gravitacional proporcional a la masa del cuerpo (y se ve afectado por el campo gravitacional creado por otros cuerpos, cuya fuerza también es proporcional a la masa de los cuerpos). Este campo provoca la atracción de cualquier otro cuerpo hacia este cuerpo con una fuerza determinada por la ley de gravedad de Newton: F = G* (m 1 *m 2 / R 2) - (3), donde R– distancia entre cuerpos, GRAMO es la constante gravitacional universal, a metro 1 Y metros 2– masas de cuerpos que se atraen.
De la fórmula (3) es fácil obtener la fórmula del peso. R masa corporal metro en el campo gravitacional de la Tierra: P = mg(4). Aquí gramo = G*M/r 2- aceleración de la gravedad en el campo gravitacional de la Tierra. La masa determinada por las relaciones (3) y (4) se llama masa gravitacional del cuerpo .
Escamas - un dispositivo para determinar la masa de los cuerpos (pesaje) por el peso que actúa sobre ellos, considerándolo aproximadamente igual a la fuerza de gravedad. Consideremos como ejemplo la medición del peso corporal, que medimos utilizando una báscula ordinaria de brazos iguales. Bajo la influencia de la gravedad, se crean fuerzas. La masa del cuerpo, junto con estas fuerzas, presiona una taza y la masa de las pesas, la otra. Seleccionando pesos conseguimos el equilibrio, es decir. igualdad de estas fuerzas. Esto nos da derecho a decir que la masa del cuerpo que se pesa es igual a la masa de las pesas, suponiendo que la fuerza de gravedad a la distancia entre las tazas sigue siendo la misma. Como puede ver, para medir la masa tuvimos que convertir las masas del cuerpo y los pesos en fuerzas, y para comparar las fuerzas entre sí, convertir su acción en movimiento mecánico de las palancas de la balanza.
Trabajo del curso:
Métodos de separación y concentración en análisis elemental.
Introducción
Características generales de los métodos de separación.
Extracción como método de separación.
Características generales de los métodos de concentración.
La coprecipitación como método de concentración.
Conclusión
Bibliografía
Introducción
El desarrollo de la química analítica se produce de dos maneras principales: el desarrollo de los métodos más selectivos para la determinación de sustancias individuales y la combinación óptima de métodos de separación y concentración con métodos de determinación no selectivos en métodos de análisis combinados. En este caso, la selectividad del método significa la capacidad de registrar una señal analítica correspondiente a la sustancia que se está determinando en el contexto creado por las impurezas que la acompañan y la matriz. El concepto de combinado está totalmente de acuerdo con el contenido semántico de esta palabra: conectados entre sí para lograr un objetivo común. En consecuencia, pueden existir métodos de separación combinados, cuyo objetivo es mejorar la separación, y métodos analíticos combinados, que proporcionan una combinación óptima de la separación preliminar con la determinación final. El uso generalizado de métodos de análisis combinados, principalmente cromatográficos, no puede considerarse sólo como consecuencia de la selectividad limitada de los métodos conocidos para la determinación directa de sustancias en el objeto de análisis.
Además del importante papel de los métodos de separación y concentración para los métodos de análisis combinados, los métodos de separación tienen un valor independiente para resolver problemas preparativos. Los analistas necesitan constantemente sustancias de alta pureza: disolventes, principalmente agua, reactivos y, finalmente, todas las sustancias que analizan. Las tareas de preparación de muestras estándar son tan variadas como los objetos de análisis. Y no siempre es posible utilizar muestras preparadas y sus componentes con el grado de pureza requerido. En sus intereses preparativos, la química analítica entra en estrecho contacto con la tecnología química. Los métodos de separación y concentración desarrollados por los analistas a menudo se implementan en procesos tecnológicos sin sufrir cambios fundamentales. En este caso, podemos hablar tanto de tecnologías de extracción a gran escala para la producción de metales raros como de procesos en la industria farmacéutica, en la producción bioquímica, donde la línea entre la escala de experimentos de laboratorio y la producción industrial está prácticamente ausente.
Características generales de los métodos de separación.
Por métodos de separación nos referimos a un conjunto de procesos químicos y físicos característicos de ellos y métodos para su implementación. El proceso en sí, por ejemplo, de separar sustancias entre dos fases líquidas, aún no es un método de separación. En combinación con un método de implementación que asegura la transición de sustancias de una fase a otra como resultado de su distribución equilibrada entre fases, dicho proceso se convertirá en extracción, y en combinación con un método cromatográfico, cromatografía líquido-líquido.
Los métodos de análisis combinados introducen dificultades en cualquier intento de sistematizar los métodos de separación. Los nombres de cromatografía “gas” y “líquida” esconden ambos métodos para la separación cromatográfica de sustancias en las fases gaseosa y líquida, así como los correspondientes métodos combinados.
Todavía no existe una clasificación generalmente aceptada de las mieles de separación y concentración. Al considerar varios métodos juntos, lo más frecuente es que se encuentre con una simple lista de ellos. O con agrupación según algún criterio formal fuera de la clasificación general. Al sistematizar los métodos de separación, en el caso más simple, se parte del hecho de que el método pertenece a uno u otro campo de la ciencia que lo dio origen: métodos químicos, fisicoquímicos, físicos. Clasifiquemos los métodos de separación en las tablas siguientes.
Tabla 1. Métodos de separación basados en la formación de una nueva fase por la sustancia aislada
Estado agregado de la fase en la que se encuentra la mezcla inicial de sustancias Estado agregado de la fase aislada Cuerpo sólido Gas Líquido Líquido Precipitación, electrodeposición, congelación, cristalización Destilación, destilación, rectificación - Gas - Congelación Sólido - Destilación a alta temperatura al interactuar con un reactivo gaseoso, sublimación Disolución selectiva
Los métodos de separación de fases comprenden cuatro grupos y se basan en:
2.diferencias en la distribución de sustancias entre fases; .diferencias en la transferencia de masa, que se manifiestan durante la transición inducida de una sustancia de una fase a otra a través de la tercera fase que las separa; .Mecanismos de separación intrafase. Para el primer grupo de métodos, los rasgos característicos son los estados agregativos de la mezcla inicial de sustancias y la fase aislada (Tabla 1). Los métodos del segundo grupo se basan en patrones generales de distribución de sustancias entre fases y pueden caracterizarse por su estado de agregación y el método de llevar a cabo el proceso de distribución entre fases. Para el tercer y cuarto grupo, además del estado de agregación de las fases, un rasgo característico es la naturaleza de las fuerzas impulsoras del proceso. La importancia para la química analítica de los métodos de separación incluidos en el primer grupo está lejos de ser ambigua. Los procesos de congelación de la fase líquida y gaseosa y de disolución selectiva de la fase sólida se utilizan relativamente raramente. La congelación se utiliza en el análisis de gases para separar la humedad y concentrar criogénicamente impurezas de alto punto de ebullición. La disolución selectiva se utiliza en dos variantes: disolución parcial o completa de la matriz y disolución selectiva de fases. Un ejemplo de disolución completa de la matriz es la disolución de aceros y aleaciones al determinar inclusiones no metálicas: óxidos, carburos, nitruros. De suma importancia para la química analítica son los métodos de separación basados en diferencias en la distribución de sustancias entre fases: extracción, sorción y varios métodos cromatográficos. Un rasgo característico de los métodos de separación de este grupo, además del sistema de fases, es el método de realización del proceso de separación de interfases (Tabla 2). Tabla 2. Métodos de separación basados en diferencias en la distribución de sustancias entre fases. Sistema de fases Método para llevar a cabo el proceso de separación de interfases Distribución de equilibrio único Múltiples repeticiones del proceso de distribución Cromatografía Extracción líquido-líquido Extracción multietapa Cromatografía líquido-líquido con fases estacionarias polares y no polares Coprecipitación líquido-sólido, fusión por zonas , cristalización direccional, sorción e intercambio iónico Recristalización múltiple Cambio de intercambio iónico, adsorción, permeación en gel, cromatografía de afinidad Líquido-gasExtracción de gasesBurbujeoCromatografía gas-líquido y líquido-gasSustancia crítica-sólido (liquidez)Extracción de fluidos supercríticosExtracción de fluidos en múltiples etapasCromatografía de fluidos supercríticos
Extracción como método de separación.
De los métodos de separación basados en una separación de sustancias en equilibrio único, la extracción tiene la mayor importancia práctica. La extracción es uno de los métodos más fiables, eficaces y extendidos para concentrar y separar sustancias. La investigación y aplicación de la extracción es una dirección líder y de rápido desarrollo en la química moderna. La extracción se refiere tanto al proceso de distribución de sustancias entre dos fases como al método de separación basado en este proceso. En el caso más general, podemos considerar equilibrios de fases en sistemas líquido-líquido y líquido-gas. Son posibles una amplia variedad de fases líquidas: agua y soluciones acuosas, disolventes orgánicos y soluciones de otros compuestos orgánicos en ellos, sales y metales fundidos, compuestos orgánicos sólidos fundidos en condiciones normales. El método de extracción de gas (sistema líquido-gas y, con menos frecuencia, sistema sólido-gas) tiene un propósito más limitado: analizar compuestos gaseosos y volátiles en fases condensadas, y se diferencia de la extracción convencional solo en que el gas se utiliza como agente de extracción. , que no interfiere con la determinación analítica de compuestos gaseosos e impurezas. Muchos métodos cercanos a la extracción, como la cromatografía de partición en columna y en papel, se basan en la distribución de sustancias entre dos fases líquidas. En la cromatografía de partición, una de las fases, orgánica o acuosa, se fija sobre un soporte inerte, mientras la otra se mueve. Esto logra múltiples intercambios entre fases. De particular importancia es la extracción de diversos compuestos metálicos de soluciones acuosas en disolventes orgánicos que son inmiscibles con ellos. La extracción se lleva a cabo 1) poniendo en contacto soluciones (iones metálicos y extractante) (mezclando); 2) separación mecánica de fases; 3) regeneración del extractante. Los campos de aplicación de la extracción son muy diversos. La extracción permite separar incluso pequeñas cantidades de impurezas de la base, lo cual es especialmente importante a la hora de obtener y analizar materiales de alta pureza, separar radioisótopos, purificar materiales biológicos, etc. La extracción se utiliza con menos frecuencia para separar la base de las trazas y, por regla general, solo en los casos en que no se pueden aislar las impurezas. Los macrocomponentes se extraen normalmente en forma de ácidos halogenuros metálicos complejos (por ejemplo, hierro a partir de soluciones de HCl con éter dietílico) o sales de solvatación de coordinación. Las microimpurezas a menudo se extraen en forma de compuestos intracomplejos y, con menos frecuencia, en forma de ácidos metálicos complejos. La extracción también es eficaz para separar componentes con propiedades similares, incluidas sustancias de alto punto de ebullición y mezclas azeotrópicas. La extracción se utiliza ampliamente para aumentar la sensibilidad de las determinaciones mediante muchos métodos de análisis químicos y fisicoquímicos. La extracción juega un papel importante en el estudio de los equilibrios en soluciones, procesos de formación complejos y, en general, en el estudio del estado de sustancias en soluciones. Ventajas de la extracción como versatilidad, rapidez, facilidad de implementación, velocidad, bajas temperaturas de funcionamiento, accesibilidad, falta de equipos complejos, coextracción relativamente pequeña (o incluso ausencia), y otras, hacen de la extracción un método muy eficaz para concentrar microimpurezas y separar sustancias. Hasta la fecha, se han desarrollado métodos para la extracción de casi todos los elementos y muchas clases de compuestos, tanto con fines preparativos como en tecnología, especialmente en tecnología nuclear. La extracción se puede utilizar tanto para la concentración absoluta como para la relativa. Para el análisis es más importante la concentración de extracción relativa, a la que se logra el enriquecimiento, es decir, la relación entre macro y microcomponentes disminuye. En la práctica del análisis químico, la extracción se utiliza únicamente como método de separación; el elemento aislado en este caso (si es necesario, el extracto está premineralizado) se determina mediante cualquier método convencional, o en combinación con una determinación posterior (extracción fotométrica, extracción polarográfica y otros métodos denominados combinados). La determinación del elemento de interés se puede realizar tanto en ambientes acuosos como orgánicos. Sistema de fases Fuerza motriz del proceso gradiente de potencial químico gradiente de potencial eléctrico gradiente de presión líquido-líquido-líquido Diálisis a través de membranas líquidasElectrodiálisis a través de membranas líquidas - Líquido-sólido-líquidoDiálisis Electrodiálisis, electroósmosisUltrafiltración, ósmosis inversa, piezodiálisis Líquido-sólido-gasEvaporación a través de membrana - - Separación por difusión gas-sólido-gas - - Los métodos de separación basados en múltiples distribuciones de equilibrio siempre tienen limitaciones fundamentales en cuanto a la pureza de las fracciones aisladas. Obviamente, en este caso sólo se puede lograr una buena separación si existe una diferencia significativa en las propiedades de las sustancias que se separan. El proceso en el campo de estos métodos está enteramente determinado por la creación de nuevos sorbentes o extractantes selectivos. Pero la aparición de clases fundamentalmente nuevas de tales compuestos, como los extractantes organofosforados, los éteres corona o los sorbentes quirales, es un fenómeno relativamente raro. Como regla general, la búsqueda conduce a la necesidad de obtener compuestos cada vez más complejos y costosos, y el efecto positivo de su uso no justifica los costos de búsqueda. Basado en los datos dados en la tabla. 2 clasificación de métodos basada en diferencias en la distribución de sustancias entre fases, se puede ver otra forma de aumentar la eficiencia de los métodos de este grupo, que consiste en mejorar los métodos para llevar a cabo los procesos de distribución entre fases, en la transición de procesos únicos a multietápicos y cromatográficos. Puede parecer algo extraño que el método cromatográfico se clasifique como un método para llevar a cabo el proceso de distribución interfacial de sustancias. Normalmente, los métodos cromatográficos se consideran de forma aislada de otros métodos de separación basados en diferencias en la distribución de sustancias entre fases. Numerosas definiciones de cromatografía, propuestas a lo largo de los años, enfatizan que la cromatografía es un método de separación o un proceso que conduce a la separación de sustancias. No hay ninguna contradicción aquí. Históricamente, la cromatografía surgió como un método de separación, cuya esencia era la separación de zonas de sustancias individuales cuando una solución que contiene su mezcla pasa a través de una capa de sorbente sólido. Al considerar los fenómenos fisicoquímicos que provocan esta “disolución”, es natural hablar de cromatografía como un proceso que ocurre en un sistema de dos fases. Cuando hablamos de un conjunto de técnicas metodológicas aplicadas a casi cualquier sistema bifásico, que permiten aumentar en gran medida los coeficientes de separación logrados con una única distribución en equilibrio de sustancias entre fases, podemos decir que la cromatografía es una forma de llevar llevar a cabo el proceso de separación de interfases. La cromatografía como método para llevar a cabo el proceso de interfase consiste en el movimiento relativo de fases en un espacio limitado en condiciones en las que una de ellas se encuentra constantemente en estado disperso o en forma de película sobre la superficie de las paredes que delimitan este espacio. Este movimiento se produce en una columna, en un capilar, en una capa fina. Una de las fases puede estar estacionaria o ambas estarán en movimiento. En cualquier caso, el método cromatográfico proporciona una redistribución secuencial múltiple de sustancias entre fases que se mueven entre sí, lo que conduce a diferencias en las velocidades de movimiento de las zonas de sustancias individuales en el espacio de separación, y en el caso de movimiento simultáneo de ambas fases en diferentes direcciones. , a diferencias en la dirección de movimiento de las zonas. Y el método de separación real será la aplicación de una de las posibles manifestaciones del método cromatográfico para implementar el proceso de distribución de interfases a un sistema bifásico específico. La interpretación propuesta del concepto de “cromatografía” parece esencial para comprender la generalidad de los métodos de separación cromatográfica que subyacen a los métodos de análisis cromatográficos más comunes en la actualidad. El interés por los métodos cromatográficos está determinado principalmente por el hecho de que teóricamente no tienen restricciones en los coeficientes de separación de sustancias, por pequeñas que sean las diferencias en los coeficientes de distribución para ellos. Este es el salto cualitativo que supone la transición de métodos basados en una única distribución de equilibrio a los cromatográficos. En los métodos para separar sustancias basados en diferencias en la distribución interfacial, siempre existen restricciones en la transferencia de masa. No pueden pasar de una fase a otra más sustancias de las que se desprende del coeficiente de distribución, cuyo valor, por regla general, disminuye al aumentar la cantidad de sustancia en el sistema de fases. La transición a métodos cromatográficos y de múltiples etapas permite una mejor separación, pero introduce restricciones aún más estrictas en la cantidad de sustancias a separar. Por tanto, para los métodos cromatográficos, la independencia del coeficiente KD de la concentración se convierte en un requisito previo, es decir, el requisito de la linealidad de la isoterma de distribución de interfase. Por lo tanto, para resolver problemas que requieren un aumento en la transferencia de masa sin aumentar el volumen de la fase de separación, el grupo de métodos más prometedor se basa en la transferencia de materia inducida en interfase. Estamos hablando de procesos en los que la separación se lleva a cabo bajo la influencia de una fuerza motriz que actúa constantemente. En el caso general, el esquema de implementación de tales procesos implica la transferencia de una sustancia de una fase a otra a través de una tercera fase que las separa, que es un tabique, una membrana. De ahí el nombre de este grupo de métodos de separación: métodos de membrana. En un caso particular, se conocen intentos de implementar una transferencia inducida dentro de un sistema de dos fases: el proceso de extracción eléctrica. Pero como el método no se utiliza mucho y su mecanismo se describe dentro de una de las etapas del esquema general del proceso de extracción con membrana, no merece una consideración especial. La clasificación por tipo de membrana es un homenaje a la historia del desarrollo de los métodos de membrana, porque su aparición en la mayoría de los casos se inició con la creación de materiales selectivamente permeables. Sólo en los últimos años ha habido una tendencia hacia la búsqueda específica de membranas que cumplan con los requisitos de un método de separación de membranas específico. A partir de la definición de los métodos de separación por membranas como procesos de transferencia indicada de una sustancia de una fase a otra a través de una tercera fase que las separa, se considera que sus principales características de clasificación son el sistema de tronos de fases y la fuerza impulsora del proceso (Tabla 3). Dado que la principal ventaja del sistema de membranas para llevar a cabo el proceso de separación es el aumento de la transferencia de masa de la sustancia a través de la fase de separación, los métodos de membrana naturalmente caen principalmente en el ámbito de interés de la tecnología química. Sin embargo, ya se han encontrado una serie de áreas interesantes de aplicación de los métodos de membrana en el análisis químico, pero no se puede descartar un intercambio de ideas mutuamente enriquecedor entre la tecnología química y la química analítica en el futuro. Finalmente, queda la posibilidad de separar sustancias debido a diferencias en las propiedades de sus iones, átomos o moléculas, manifestadas dentro de un sistema homogéneo bajo la influencia de campos eléctricos, magnéticos, gravitacionales, térmicos o fuerzas centrífugas. Al mismo tiempo, no se excluye la posibilidad de transformaciones de fase al transferir la mezcla inicial de sustancias al estado de agregación en el que se produce la separación, o al separar fracciones de sus componentes individuales. El efecto de separación se consigue gracias a los diferentes movimientos espaciales de las sustancias dentro de la fase en la que se produce su separación. Las diferencias en la velocidad del movimiento espacial de iones, átomos o moléculas aparecerán dependiendo de su masa, tamaño, carga, energía de interacción de las partículas con iones y moléculas que forman el medio en el que se produce la separación. El papel relativo de ciertos factores para lograr el efecto de separación final, a su vez, depende de la naturaleza de las fuerzas que actúan sobre ellos. El caso más obvio es la separación electroforética o, como a veces se la llama, electromigración de iones en soluciones debido a la diferentes velocidades de su movimiento en la voluntad eléctrica. Los factores más importantes aquí son el tamaño y la carga del ion. Las diferencias de masa y carga son más pronunciadas cuando las partículas ionizadas se exponen a un campo eléctrico acelerado y a un campo magnético deflector. Este método de influir en el sistema es la base del método de separación de masas. En la separación bajo la influencia de fuerzas centrífugas (ultracentrifugación), el factor determinante es la masa de las moléculas. Tabla 4. Métodos de separación intrafase Estado agregado de las fases en las que se produce la separación Tipo de fuerzas que provocan el movimiento espacial de iones, átomos o moléculas Campo eléctrico Campo eléctrico y magnético Fuerza centrífuga o campo gravitacional Electroforesis líquida (electromigración) - ultracentrifugación Electroforesis gaseosa Ultracentrifugación por separación de masas En consecuencia, cualquiera de los métodos conocidos de separación intrafase puede caracterizarse por el estado agregativo de la fase dentro de la cual se produce la separación y el tipo de fuerzas que causan el movimiento espacial de iones, átomos o moléculas. Los métodos de separación intrafase en general se caracterizan por soluciones de hardware complejas y la viabilidad de su uso en química analítica se justifica en proporción a las capacidades que otros métodos no tienen. El diseño técnico más simple es el método de separación electroforética (electromigración) de iones en solución, que conserva ciertas áreas de aplicación en química analítica. La separación de masas como método de separación es interesante principalmente porque es la base de uno de los métodos de análisis químico más utilizados: la espectrometría de masas. Aquí se ha producido una fusión aún más estrecha entre el método de separación y los métodos de determinación final que en el caso de los métodos de análisis cromatográficos. Al describir un método espectrométrico de masas, normalmente ni siquiera se menciona que se trata de uno de los métodos de análisis combinados. La complejidad del equipo y el elevado consumo energético en el método de separación de masas se compensan con su versatilidad y capacidad de separación prácticamente ilimitada. Características generales de los métodos de concentración.
La determinación de microimpurezas es una tarea urgente debido a los mayores requisitos de pureza de los materiales y la necesidad de un seguimiento analítico del medio ambiente. Para determinar trazas, sólo se utilizan métodos que permitan la detección de impurezas que pesen 10 -7-10-8g, y a veces hasta 10 -14d) Los más importantes son los métodos de análisis físicos: adsorción atómica, activación de neutrones, fluorescencia de rayos X y algunos otros. Las principales tareas al determinar macrocomponentes: 1.El uso de porciones o volúmenes de muestra muy pequeños con contenidos significativos de los componentes que se determinan; 2.Análisis de muestras de gran masa o volumen para determinar el contenido de trazas de sustancias. Para resolver el primer problema, además de los métodos de análisis físicos indicados, son adecuados los métodos de ultramicroanálisis, incluido el análisis ultramicroquímico. Es un conjunto de técnicas para utilizar equipos especiales para trabajar con volúmenes de soluciones ultrapequeños. Para resolver el segundo problema se utiliza la concentración como operación preliminar. Es necesario en los casos en que es necesario aumentar las concentraciones de microcomponentes para análisis posteriores o separar trazas de componentes del analito de los microcomponentes principales u otros. Con la concentración absoluta, los microcomponentes se transfieren de un volumen mayor a uno más pequeño. Como se desprende de la definición, la concentración siempre está asociada con la separación y redistribución de sustancias en diferentes fases, por lo que para la concentración se utilizan todos los métodos adecuados para la separación. Los métodos más comunes se enumeran en la tabla. 5. Al elegir un método de concentración, se guían por la naturaleza del objeto y su composición química, el método de análisis posterior, la duración de todas las operaciones, la disponibilidad de todo el equipo necesario, etc. Tabla 5. Métodos de concentración para análisis de trazas. Método Características y ventajas Desventajas Extracción Le permite concentrar tanto las impurezas de un grupo de sustancias como las sustancias individuales. El método es universal, simple de diseñar; Uso de reactivos costosos; Coprecipitación Permite la concentración de sustancias; De larga duración, menos universal, baja selectividad; Cromatografía de intercambio iónico; Se utiliza para intercambiar el componente principal de una mezcla por H +(OH -) o para concentrar microcomponentes de grandes volúmenes de soluciones. La separación completa se logra con valores bajos de coeficientes de distribución. La selectividad es baja, las pérdidas y la contaminación son posibles debido a los procesos de sorción, el proceso requiere mucha mano de obra. Destilación Se utiliza para concentrar impurezas altamente volátiles con su condensación en una pequeña superficie. No requiere reactivos ni disolventes adicionales. Aplicación limitada a determinadas clases de sustancias.
La coprecipitación como método de concentración.
Recientemente, la coprecipitación, uno de los métodos más eficaces y conocidos desde hace mucho tiempo para concentrar trazas de diversos elementos, ha adquirido especial importancia para fines analíticos. La coprecipitación es un tipo de distribución, es decir, la distribución de un microcomponente provocada por la liberación del yacimiento a la fase sólida. En otras palabras, representa la transición simultánea de micro a macrocomponentes en la fase sólida en formación del yacimiento. La coprecipitación implica la captura de impurezas durante el crecimiento de las partículas colectoras (introducidas en el sistema como partículas recién formadas). Durante la maduración de sedimentos en Ostwald, así como durante la mejora estructural y morfológica de las partículas en fase sólida. Como colectores se utilizan hidróxidos metálicos (hierro, aluminio, etc.), sulfuros (CdS, HgS), fosfatos (Ca3(PO4)2, etc.), sulfatos (BaSO4, etc.) y otros compuestos inorgánicos. Hay dos grandes clases de contaminación: Coprecipitación, cuando la sustancia principal y la impureza se depositan juntas. El hecho de que dos sustancias precipiten simultáneamente no indica coprecipitación. Así, si, por ejemplo, se precipitan cuantitativamente trazas de hidróxido de berilio con una gran cantidad de hidróxido de aluminio en condiciones en las que ambos son insolubles, es decir, a partir de sus soluciones saturadas, entonces deberíamos hablar de coprecipitación y no de coprecipitación ( precipitación conjugada); La posdeposición es la transición de impurezas a sedimento no durante su formación, sino después. Primero se libera un precipitado principal puro y luego una impureza. Normalmente, la posprecipitación se produce en una solución sobresaturada. Así, las trazas de zinc (II) e indio se precipitan tras el contacto prolongado de sus soluciones con el precipitado de sulfuros metálicos. Cuando la deposición involucra una fase sólida, se distinguen los siguientes casos de coprecipitación: Formación de un compuesto químico. La composición bruta de la fase sólida es diferente de la composición de cada uno de sus ingredientes, pero la composición local es la misma. Formación de una solución sólida. Un cambio en la composición bruta de la fase sólida con un cambio en la concentración de los componentes en la mezcla inicial indica la formación de una solución sólida. La fase sólida resultante de este tipo de coprecipitación a veces se denomina compuesto de composición variable. La formación de soluciones sólidas ocurre como resultado de procesos moleculares que pueden considerarse reacciones cuasiquímicas de intercambio o adición. La generalidad del mecanismo molecular de formación es un argumento importante a favor de combinar todos los casos de coprecipitación con la formación de soluciones sólidas en una subclase. Esta subclase se puede dividir en dos tipos dependiendo de si la solución sólida es cristalina o amorfa. La coprecipitación con la formación de una fase sólida cristalina suele denominarse cocristalización. Formación de una fase sólida con una impureza segregada en los defectos. La composición bruta de la fase sólida en este caso depende de la composición de la mezcla inicial y la composición local no es la misma. Hay dos tipos de segregación: A) Durante su crecimiento, solo los macrocomponentes de la mezcla inicial o los productos de su interacción pasan al volumen de partículas de sedimento durante su crecimiento, y el microcomponente es empujado por las partículas en crecimiento, acumulándose cerca de la interfaz de fase (episegregación). Este tipo está asociado con la captura de impurezas por la superficie de partículas de sedimento en crecimiento; b) el microcomponente se localiza en el volumen de la fase sólida (endosegregación), cerca de las dislocaciones (endosegregación de dislocaciones), en los límites intercristalinos (endosegregación intercristalina) o está ubicado dentro de inclusiones aisladas del medio uterino (endosegregación oclusiva). En la coprecipitación con la participación de varias fases sólidas se distingue entre coprecipitación con la participación de fases sólidas separables e inseparables. Si el proceso de coprecipitación se produce sólo en la superficie de la fase sólida o también en su interior, se distinguen dos tipos de coprecipitación: adsorción: depósito de impurezas en la superficie de las partículas; oclusión: depósito de una impureza dentro de las partículas primarias a través de cualquier mecanismo posible. El fenómeno de la coprecipitación se utiliza ampliamente en química analítica como una forma sencilla y eficaz de extraer oligoelementos de soluciones muy diluidas en las que no se consigue el producto de solubilidad del precipitado. Conclusión Los métodos de separación y concentración suelen verse como algo que complementa la química analítica, ampliando sus capacidades, pero no como su parte central fundamental. Por otro lado, como ya se señaló en la introducción, una de las dos direcciones principales en el desarrollo de la química analítica se centra a priori en una combinación limitada de métodos para la separación y determinación de sustancias en objetos de análisis. Bibliografía
1.Moskvin L.N., Tsaritsina L.G. Métodos de separación y concentración en química analítica. - L., “Química”, 1991. - 256 p. 2.Skorokhod O.R. Análisis químico: Fundamentos de métodos de concentración y separación de sustancias. - Mn., "Editorial BSU", 1980. - 272 p. .Posypaiko V.I. y otros Métodos químicos de análisis: libro de texto. Manual para tecnólogos químicos. universidades / Posypaiko V.I., Kozyreva N.A., Logacheva Yu.P. - M., “Más alto. escuela", 1989. - 448 p.Trabajos similares a - Métodos de separación y concentración en el análisis de elementos
Los métodos de separación y concentración se utilizan para separar mezclas complejas de múltiples componentes, aislar el componente analito de la mezcla y aumentar la concentración del componente analizado en la muestra. Estos métodos incluyen: extracción, separación y concentración por precipitación, evaporación, incineración y fundición por zonas. Estos métodos se clasifican más correctamente como métodos fisicoquímicos, ya que se basan en propiedades de sustancias como la solubilidad, la volatilidad, la fusión y la cristalización.
La necesidad de separación y concentración a la hora de realizar una investigación experta puede deberse principalmente a los siguientes factores:
- la concentración del componente que se está determinando está por debajo del límite de detección del método;
- la muestra de prueba contiene componentes que interfieren con la determinación.
Extracción - El proceso de extracción de componentes individuales de una mezcla compleja utilizando un disolvente. Cuando se trabaja con muestras sólidas (polvo finamente molido), se utilizan diferentes solubilidades de los componentes individuales de la mezcla, y cuando se extrae de una solución, se utilizan diferentes distribuciones de los componentes de la mezcla en dos líquidos inmiscibles.
Estos métodos se utilizan ampliamente en el estudio de objetos forenses, tanto para la investigación preliminar como para la preparación para el análisis posterior de objetos tales como materiales de escritura, papel, pinturas y barnices, pólvora, fibras, marcas de identificación, materiales poliméricos, drogas y medicamentos, petróleo. productos y combustibles y lubricantes, suelos y minerales.
Precipitación. Métodos de aislamiento y concentración por precipitación: basados en el aislamiento de componentes de una mezcla en forma de un compuesto poco soluble o la coprecipitación sobre un precipitado poco soluble de un compuesto inorgánico, orgánico o mixto.
Evaporación Es un proceso de separación y purificación de sustancias en el que una sustancia líquida o sólida, al calentarse, pasa a estado gaseoso (se evapora de la mezcla), y luego, al enfriarse, se condensa, formando nuevamente una fase líquida o a veces sólida.
Existen métodos: destilación, evaporación fraccionada (destilación), sublimación.
Destilación o simple evaporación: un proceso de un solo paso para separar y concentrar sustancias.
Destilación o evaporación fraccionada basado en diferente volatilidad de sustancias. La separación y concentración de los componentes de la mezcla se produce debido a la diferencia en sus puntos de ebullición y a la evaporación de los componentes individuales a diferentes temperaturas en diferentes momentos.
Sublimación (sublimación) – Se trata de la transferencia de una sustancia del estado sólido al gaseoso y su posterior precipitación en forma sólida (sin pasar por la fase líquida). Para la sublimación de microcantidades de sustancias, a menudo se utiliza el método del "dedo frío", en el que se condensa un componente traza en una varilla enfriada ubicada dentro de un recipiente cerrado directamente encima de la muestra calentada; si es necesario, se evacua el sistema
Métodos de incineración– estos son métodos de concentración que implican la mineralización de objetos de análisis: compuestos orgánicos y organometálicos, materiales animales y vegetales, suelos para su posterior análisis elemental.
Se utilizan para preparar objetos para el examen técnico forense de documentos, el examen biológico forense, el examen de sustancias, materiales y productos elaborados a partir de ellos, para el análisis elemental mediante métodos químicos y espectrales. Es posible diferenciar papeles de un mismo tipo por el color del residuo de ceniza y determinación aproximada del tipo de carga. La mineralización de productos farmacéuticos se utiliza para la determinación aproximada de una sustancia medicinal por el tipo de residuo de ceniza.
Zona de fusión es un método para purificar sustancias sólidas resistentes al calor, basado en la redistribución de los componentes de la mezcla en la masa fundida (entre las fases líquida y sólida fundida en contacto).
La condición para utilizar el método de fusión por zonas es la estabilidad térmica de la sustancia a la temperatura de fusión y su capacidad para cristalizar. La ausencia de disolventes durante el proceso de purificación prácticamente elimina la pérdida de una sustancia, posible debido a su separación incompleta de la solución.
Los métodos de separación electroquímica se basan en el aislamiento del analito sobre un electrodo inerte en estado elemental o en forma de precipitado insoluble que precipita cuando se hace pasar una corriente eléctrica directa a través de la solución analizada.
La teoría y la práctica de los métodos de separación electroquímica se describen en detalle en el capítulo. VI.
Actualmente, los métodos electroquímicos se utilizan para separar compuestos de la mayoría de elementos químicos y han demostrado ser muy convenientes porque no requieren la introducción de sustancias extrañas en la solución analizada. Utilizando diversos métodos de deposición electroquímica utilizando electrodos de platino u otros y un cátodo de mercurio, así como electrólisis interna (ver Capítulo VI, § 5), es posible separar cationes de aluminio, titanio, circonio, vanadio, uranio de cationes de cromo. , hierro, cobalto, níquel, zinc, cobre, plata, cadmio, germanio, molibdeno, estaño, bismuto y otros elementos. También es posible separar las impurezas de los componentes principales al analizar metales no ferrosos, sus aleaciones y minerales.
La separación de una mezcla compleja que consta de varios iones depositados electrolíticamente se logra seleccionando un electrolito apropiado o realizando una electrólisis con control automático del potencial del electrodo al que se lleva a cabo la electrodoposición.
Deposición sobre un cátodo de mercurio. ¡Un tipo especial! La separación electrolítica es la deposición sobre un cátodo de mercurio. En este caso, los metales bajo la influencia de una corriente eléctrica se liberan sobre el mercurio para formar amalgamas. Como resultado, el aislamiento y separación de muchos metales se produce de forma rápida y cuantitativa. Algunos metales (por ejemplo, ), que no se liberan en un cátodo sólido, se liberan cuantitativamente durante la electrólisis en un cátodo de mercurio. Sin embargo, algunos metales (por ejemplo) no se depositan en el cátodo de mercurio.
La electrólisis con cátodo de mercurio se realiza en dispositivos especiales (Fig. 95). Para ello, se añaden unos 200 g de mercurio metálico al recipiente en el que se realiza la electrólisis, se vierte la solución a analizar y se realiza la electrólisis a una densidad de corriente de aproximadamente . El ánodo se refuerza en la superficie de la solución. Durante el proceso de electrólisis, se agita el mercurio. Al final de la electrólisis, una muestra de la solución debería dar una reacción negativa a los elementos separados.
Sin interrumpir la corriente, se drena la solución del mercurio y se lava el mercurio con agua. El agua de lavado se añade a la solución principal. Se analiza la solución resultante, libre de elementos aislados en el cátodo de mercurio. Si es necesario extraer del mercurio los metales depositados en él, la amalgama se disuelve en ácidos o el mercurio se elimina por destilación.
Usando un cátodo de mercurio se puede separar:
a) aluminio de hierro, zinc, cobre;
b) titanio de indio, renio, molibdeno, germanio;
c) vanadio a partir de molibdeno;
d) compuestos de fósforo y arsénico de todos los elementos liberados en el cátodo de mercurio (hierro, zinc, cobalto, níquel, cromo, plata, cobre, cadmio, mercurio, estaño, platino, oro, etc.).
Por ejemplo, un método para la determinación cuantitativa de aluminio en presencia de iones de hierro y otros elementos, basado en la separación del hierro por electrólisis sobre un cátodo de mercurio, es el siguiente. Primero, se aísla el hierro de una solución de sulfato en un cátodo de mercurio; junto con el hierro se liberan otros elementos: zinc, cromo, níquel, cobalto, etc. En la solución quedan iones de aluminio, berilio, titanio, fósforo, etc., luego se determinan de la forma habitual los iones de aluminio, que precipitan. del filtrado con oxiquinolina o cupferón en solución de amoníaco o de ácido ligeramente acético. El titanio se precipita en una solución ácida con cupferón.
Los métodos electroquímicos se pueden utilizar no sólo para la separación y aislamiento de elementos, sino también para la concentración de analitos.
Este tipo de concentración (acumulación) del elemento que se determina en una gota estacionaria de mercurio se realiza mediante el método de polarografía de amalgama. La esencia del método es que mediante electrólisis durante un tiempo al potencial de la corriente límite del metal que se está determinando, se concentra en forma de amalgama de una solución diluida en una gota estacionaria de mercurio, que actúa como mercurio. microelectrodo. Luego, a un voltaje que varía linealmente, se registra la curva de disolución anódica de la amalgama. En este caso, los picos anódicos se obtienen en el polarograma, cuya posición, por potencial, caracteriza la naturaleza de la sustancia y la altura del pico, la concentración de la impureza.
El método fue propuesto por Barker y estudiado por Shein, Kemulya, A.G. Stromberg, E.N. Vinogradova, L.N. Vasilyeva, S.I. Sinyakova y otros. Gran valor teórico y práctico para la polarografía de amalgama con concentración preliminar (acumulación) en Una gota estacionaria de mercurio está representada por el trabajo de M. T. Kozlovsky en el campo de la investigación de amalgamas metálicas.

Arroz. 95. Cátodo de mercurio.
La combinación de la determinación electroquímica de la concentración de los elementos en una gota estacionaria de mercurio con la posterior polarización anódica de la amalgama resultante permite aumentar la sensibilidad del método en varios órdenes de magnitud en comparación con el método de polarografía convencional. Esto es de gran importancia práctica para el análisis de metales de alta pureza, reactivos químicos y materiales semiconductores.
Existen varias opciones para concentrar microimpurezas mediante el método electroquímico (polarográfico). Su principio general es la acumulación de determinados elementos mediante electrólisis preliminar sobre un electrodo estacionario.
Para fines de preconcentración electroquímica, se han desarrollado técnicas de polarografía de amalgama para determinar impurezas en sales de zinc, aluminio, indio, estaño, arsénico, galio, uranio, reactivos químicamente puros, objetos biológicos, productos alimenticios, etc.
Enviar su buen trabajo en la base de conocimientos es sencillo. Utilice el siguiente formulario
Los estudiantes, estudiantes de posgrado y jóvenes científicos que utilicen la base de conocimientos en sus estudios y trabajos le estarán muy agradecidos.
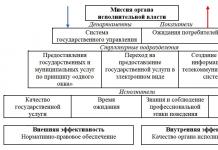
1. Métodos de separación y concentración.
Información general sobre separación y concentración.
La separación es una operación que permite separar los componentes de una muestra entre sí.
Se utiliza si algunos componentes de la muestra interfieren con la determinación o detección de otros, es decir, cuando el método analítico no es lo suficientemente selectivo y se debe evitar la superposición de señales analíticas. En este caso, las concentraciones de las sustancias separadas suelen ser cercanas.
La concentración es una operación que permite aumentar la concentración de un microcomponente en relación con los componentes principales de la muestra (matriz).
Se utiliza si la concentración de un microcomponente es inferior al límite de detección Cmin, es decir, cuando el método de análisis no es lo suficientemente sensible. Sin embargo, las concentraciones de los componentes varían mucho. La concentración suele combinarse con la separación.
Tipos de concentración.
1. Absoluto: el microcomponente se transfiere de un gran volumen o gran masa de la muestra (Vpr o mpr) a un menor volumen o menor masa del concentrado (Vconc o mconc). Como resultado, la concentración del microcomponente aumenta n veces:
donde n es el grado de concentración.
Cuanto menor sea el volumen de concentrado, mayor será el grado de concentración. Por ejemplo, 50 mg de resina catiónica absorbieron germanio de 20 litros de agua del grifo, luego el germanio fue desorbido por 5 ml de ácido. En consecuencia, el grado de concentración de germanio fue:
2. Relativo (enriquecimiento): el microcomponente se separa del macrocomponente de modo que aumenta la proporción de sus concentraciones. Por ejemplo, en la muestra inicial la proporción de concentraciones de micro y macrocomponentes fue de 1: 1000, y después del enriquecimiento fue de 1: 10. Esto generalmente se logra mediante la eliminación parcial de la matriz.
La separación y la concentración tienen mucho en común; se utilizan los mismos métodos para estos fines. Son muy diversos. A continuación se considerarán los métodos de separación y concentración que son de mayor importancia en la química analítica.
Clasificación de métodos de separación y concentración.
Existen muchas clasificaciones de métodos de separación y concentración en función de diferentes características. Veamos los más importantes de ellos.
1. La clasificación según la naturaleza del proceso se da en la Fig.
Arroz. 1 Clasificación de los métodos de separación según la naturaleza del proceso.
Los métodos químicos de separación y concentración se basan en la aparición de una reacción química, que se acompaña de la precipitación del producto y la liberación de gas. Por ejemplo, en el análisis orgánico, el principal método de concentración es la destilación: durante la descomposición térmica, la matriz se destila en forma de CO2, H2O, N2 y en las cenizas restantes se pueden determinar metales.
Los métodos fisicoquímicos de separación y concentración se basan con mayor frecuencia en la distribución selectiva de una sustancia entre dos fases. Por ejemplo, en la industria petroquímica la cromatografía es de gran importancia.
Los métodos físicos de separación y concentración se basan con mayor frecuencia en cambiar el estado de agregación de una sustancia.
2. Clasificación según la naturaleza física de las dos fases. La distribución de una sustancia se puede realizar entre fases que se encuentran en el mismo o diferente estado de agregación: gaseosa (G), líquida (L), sólida (S). De acuerdo con esto, se distinguen los siguientes métodos (Fig.).
Arroz. 2 Clasificación de los métodos de separación según la naturaleza de las fases.
En química analítica, los métodos de separación y concentración, que se basan en la distribución de una sustancia entre las fases líquida y sólida, han adquirido la mayor importancia.
3. Clasificación según el número de actos elementales (etapas).
§ Métodos de una sola etapa: basados en una única distribución de una sustancia entre dos fases. La separación se produce en condiciones estáticas.
§ Métodos de varias etapas: basados en la distribución múltiple de una sustancia entre dos fases. Hay dos grupos de métodos de varias etapas:
– repetir el proceso de distribución única (por ejemplo, extracción repetida). La separación se realiza en condiciones estáticas;
– métodos basados en el movimiento de una fase con respecto a otra (por ejemplo, cromatografía). La separación se produce en condiciones dinámicas.
3. Clasificación según el tipo de equilibrio (Fig.).
Arroz. 3 Clasificación de los métodos de separación por tipo de equilibrio.
Los métodos de separación termodinámica se basan en diferencias en el comportamiento de sustancias en estado de equilibrio. Son de gran importancia en la química analítica.
Los métodos de separación cinética se basan en las diferencias en el comportamiento de las sustancias durante el proceso que conduce a un estado de equilibrio. Por ejemplo, en la investigación bioquímica, la electroforesis es de gran importancia. Se utilizan otros métodos cinéticos para separar partículas de soluciones coloidales y soluciones de compuestos de alto peso molecular. En química analítica, estos métodos se utilizan con menos frecuencia.
Los métodos cromatográficos se basan tanto en el equilibrio termodinámico como en el cinético. Son de gran importancia en química analítica, ya que permiten la separación y análisis simultáneo cualitativo y cuantitativo de mezclas multicomponentes.
La extracción como método de separación y concentración.
La extracción es un método de separación y concentración basado en la distribución de una sustancia entre dos fases líquidas inmiscibles (normalmente acuosa y orgánica).
Para la separación por extracción se crean las condiciones tales que un componente pase completamente a la fase orgánica y el otro permanezca en la fase acuosa. A continuación se separan las fases mediante un embudo de decantación.
Para lograr la concentración absoluta, la sustancia se transfiere de un volumen mayor de solución acuosa a un volumen menor de fase orgánica, como resultado de lo cual aumenta la concentración de la sustancia en el extracto orgánico.
A efectos de la concentración relativa, se crean las condiciones para que el microcomponente pase a la fase orgánica y la mayor parte del macrocomponente permanezca en la fase acuosa. Como resultado, en el extracto orgánico la proporción de las concentraciones de los micro y macrocomponentes aumenta a favor del microcomponente.
Ventajas de la extracción:
§ alta selectividad;
§ facilidad de implementación (solo se necesita un embudo de separación);
§ baja intensidad laboral;
§ velocidad (3-5 min);
§ la extracción se combina muy bien con los métodos de determinación posterior, como resultado de lo cual han surgido una serie de métodos híbridos importantes (extracción-fotométrica, extracción-espectral, etc.).
La coprecipitación como método de separación y concentración.
La coprecipitación es la captura de un microcomponente por un recolector de sedimentos durante su formación, y el microcomponente pasa al sedimento desde una solución insaturada (PS< ПР).
Como colectores se utilizan compuestos inorgánicos y orgánicos poco solubles con una superficie desarrollada. La separación de fases se lleva a cabo mediante filtración.
La coprecipitación se utiliza para los siguientes fines:
§ la concentración de impurezas como un método muy eficaz y uno de los más importantes, que permite aumentar la concentración entre 10 y 20 mil veces;
§ separación de impurezas (con menos frecuencia).
La sorción como método de separación y concentración.
La sorción es la absorción de gases o sustancias disueltas por sorbentes sólidos o líquidos.
Como sorbentes se utilizan carbones activados, Al2O3, sílice, zeolitas, celulosa, sorbentes naturales y sintéticos con grupos ionógenos y quelantes.
La absorción de sustancias puede ocurrir en la superficie de la fase (adsorción) o en el volumen de la fase (absorción). En química analítica, la adsorción se utiliza con mayor frecuencia para:
§ separación de sustancias, si se crean las condiciones para la absorción selectiva;
§ concentración (con menos frecuencia).
Además, la sorción en condiciones dinámicas constituye la base del método más importante de separación y análisis: la cromatografía.
Intercambio iónico
El intercambio iónico es un proceso estequiométrico reversible que ocurre en la interfaz entre el ionito y la solución electrolítica.
Los intercambiadores de iones son polielectrolitos de alto peso molecular de diversas estructuras y composiciones. concentración de gas de sorción química
La principal propiedad de los intercambiadores de iones es que absorben cationes o aniones de una solución, liberando en la solución un número equivalente de iones del mismo signo de carga.
El proceso de intercambio iónico se describe mediante la ley de acción de masas:
donde A y B son iones en solución y son iones en la fase de intercambiador de iones.
Este equilibrio se caracteriza por la constante de cambio (K):
donde a es la actividad de los iones.
Si K > 1, entonces el ion B tiene una mayor afinidad por el intercambiador de iones; si k< 1, то ион А обладает бульшим сродством к иониту; если же К? 1, то оба иона одинаково сорбируются ионитом.
Los siguientes factores influyen en el curso del intercambio iónico:
1) la naturaleza del intercambiador de iones;
2) la naturaleza del ion: cuanto mayor es la relación entre la carga iónica y el radio del ion hidratado (z/r), mayor es la afinidad por el intercambiador de iones;
3) propiedades de la solución:
§ valor de pH (ver las siguientes secciones);
§ concentración de iones: de soluciones diluidas, el intercambiador de iones absorbe iones con una carga mayor y de soluciones concentradas, con una carga menor;
§ fuerza iónica de la solución: cuanto menor es m, mejor se absorben los iones.
Tipos de intercambiadores de iones
Existe una gran cantidad de intercambiadores de iones diferentes. Se clasifican según su origen y el signo de la carga de los iones que intercambian.
Según el origen se distinguen dos grupos
intercambiadores de iones:
1. Intercambiadores de iones naturales:
§ inorgánicos (arcillas, zeolitas, apatitas);
§ orgánico (celulosa).
2. Intercambiadores de iones sintéticos:
§ inorgánico (permutitas);
§ orgánico (materiales de alto peso molecular).
En química analítica, los intercambiadores de iones orgánicos sintéticos se utilizan con mayor frecuencia.
Dependiendo del signo de la carga de los iones intercambiadores, los intercambiadores de iones se denominan de la siguiente manera:
1. Intercambiadores de cationes: intercambian cationes, contienen grupos ácidos:
§ -SO3H (intercambiadores de cationes de ácidos fuertes, el intercambio se produce en una amplia gama de valores de pH);
§ -PO3H2 (intercambiadores de cationes de medio ácido, el intercambio se produce a pH > 4);
§ -COOH, -OH (intercambiadores de cationes ácidos débiles, el intercambio se produce a pH > 5).
2. Intercambiadores de aniones: intercambian aniones, contienen grupos básicos:
§ grupos alquilamonio cuaternario (intercambiadores de aniones altamente básicos, el intercambio se produce en una amplia gama de valores de pH);
§ grupos amino e imino (intercambiadores de aniones básicos medios y bajos, el intercambio se produce a pH< 8-9).
3. Anfólitos: intercambian cationes y aniones según las condiciones. Tienen ambos tipos de grupos: ácidos y básicos.
Estructura de intercambiadores de iones orgánicos sintéticos. Reacciones de intercambio iónico
Los intercambiadores de iones orgánicos sintéticos tienen una estructura de cadena tridimensional. Consisten en una matriz de alto peso molecular (HM) en la que se fijan grupos ionógenos.
Por ejemplo, para un intercambiador de aniones altamente básico en la forma cloruro R-N(CH3)3Cl
Composición del intercambiador de iones.
|
ion HM estacionario |
ion NM móvil |
||
|
ion fijo |
contraión |
||
|
grupo iónico |
La matriz suele ser un copolímero de estireno y divinilbenceno (DVB), que es un agente reticulante: cada una de sus moléculas, a modo de puente, conecta 2 cadenas lineales adyacentes de poliestireno.
En el intercambio iónico participan iones móviles de bajo peso molecular (LM) que forman parte de grupos ionógenos.
Por ejemplo, una reacción de intercambio catiónico que involucra un intercambiador de cationes fuertemente ácido en forma de hidrógeno se escribe de la siguiente manera:
y una reacción de intercambio aniónico que involucra un intercambiador aniónico altamente básico en forma de cloruro
Características físicas y químicas básicas de los intercambiadores de iones.
Las ionitas como materiales tienen muchas características físico-químicas y físico-mecánicas. De estas, tres características físicas y químicas principales son las de mayor importancia para el químico analítico: humedad, hinchamiento y capacidad de intercambio.
La humedad (W, %) caracteriza la capacidad del intercambiador de iones para absorber la humedad del aire. Se puede calcular basándose en datos experimentales:
donde mo y m son la masa del intercambiador de iones antes y después del secado.
Normalmente, la humedad de los intercambiadores de iones está en el rango del 10 al 15%.
La hinchazón caracteriza el grado de aumento en el volumen del intercambiador de iones al entrar en contacto con agua u otro disolvente. La cantidad de hinchamiento depende del grado de reticulación de la matriz del intercambiador de iones de alto peso molecular (% DVB). Debido a la hinchazón, el intercambio iónico se produce rápidamente. El motivo del hinchamiento es la presencia de grupos ionógenos polares capaces de hidratarse o solvatarse. La capacidad de intercambio (CE) es la característica cuantitativa más importante de un intercambiador de iones. Caracteriza la capacidad del intercambiador de iones para realizar el intercambio iónico. La capacidad de intercambio total (TEC) de un intercambiador de iones determinado es un valor constante y está determinada por el número de iones fijos en la matriz del intercambiador de iones. Depende de los siguientes factores: la naturaleza del intercambiador de iones;
§ valor de pH de la solución;
§ condiciones de definición (estáticas o dinámicas);
§ naturaleza del ion intercambiado;
§ radio de iones (efecto tamiz).
La capacidad de intercambio de masa muestra cuántos equivalentes en milimoles de un ion (ion n(1/z)) pueden intercambiar 1 gramo de intercambiador de iones seco. Se calcula mediante la fórmula:
La capacidad de intercambio volumétrico muestra cuántos equivalentes en milimoles de un ion (ion n(1/z)) puede intercambiar 1 mililitro de intercambiador de iones hinchado. Se calcula mediante la fórmula:
Dependiendo de las condiciones de determinación, se distingue entre capacidad de intercambio estática (SOE) y dinámica (DOE), ¿y qué pasa con las SOE? GAMA.
Tipos de capacidad de intercambio dinámico:
§ antes de la ruptura del ion absorbido, o trabajo (DOE), muestra cuántos iones puede absorber el intercambiador de iones antes de que aparezcan en el eluato (ruptura);
§ total (PDOE): muestra cuántos iones puede absorber el intercambiador de iones hasta que los grupos ionógenos estén completamente saturados en determinadas condiciones.
La diferencia entre los valores de DOE y PDOE se presenta en la figura:
Publicado en http://www.allbest.ru/
Arroz. 4 Capacidad total de intercambio dinámico (TDEC) y capacidad antes de la ruptura (DEC)
Aplicación de intercambiadores de iones en química analítica.
Los intercambiadores de iones se utilizan para resolver los siguientes problemas en la práctica analítica.
§ Separación de sustancias. El intercambio iónico es un método conveniente y eficaz para separar sustancias. Por ejemplo, con su ayuda es posible separar incluso elementos con propiedades químicas similares, como los lantánidos.
§ Concentración de sustancias. Primero, se hace pasar un gran volumen de la solución diluida a través de una columna que contiene una resina de intercambio iónico. Después de esto, los iones absorbidos se eliminan de la columna por lavado con una cantidad mínima de un eluyente adecuado.
§ Determinación de cationes y aniones “inconvenientes”. A menudo es necesario analizar el contenido de los llamados iones "inconvenientes". Dichos iones no tienen propiedades analíticas químicas que permitan determinarlos fácilmente mediante métodos de análisis químicos o instrumentales. De los cationes, estos incluyen iones de metales alcalinos (Na+, K+, etc.), aniones - , etc. La determinación de cationes “incómodos” se basa en hacer pasar primero la muestra a través de una columna con un intercambiador de cationes en forma de hidrógeno y valoración posterior con álcali:
La determinación de aniones "inconvenientes" se basa en el paso preliminar de la muestra a través de una columna con un intercambiador de aniones en forma de hidróxido y la posterior titulación del álcali liberado con un ácido:
§ Obtención de agua desionizada. El agua se hace pasar secuencialmente a través de una columna con una resina de intercambio catiónico en forma de hidrógeno, luego a través de una columna con una resina de intercambio aniónico en forma de hidróxido. Como resultado, todos los cationes y aniones quedan retenidos por los intercambiadores de iones y se obtiene agua que no contiene iones.
Métodos cromatográficos de análisis.
El método de análisis cromatográfico fue utilizado por primera vez por el botánico ruso M. S. Tsvet para el análisis de la clorofila. El nombre del método proviene de la palabra griega "chromatos" - color, aunque el método permite separar cualquier compuesto, incluidos los incoloros.
Actualmente, la cromatografía es uno de los métodos de análisis más prometedores. Es ampliamente utilizado en diversas industrias e investigaciones científicas para el análisis de mezclas de sustancias gaseosas, líquidas y sólidas.
En la industria petroquímica y del gas, la cromatografía representa el 90% de todos los análisis realizados. La cromatografía de gases se utiliza en biología y medicina, tecnología de procesamiento de madera, química forestal, industria alimentaria y otras áreas. Alrededor del 30% de los análisis de seguimiento medioambiental (contaminación del aire, análisis de aguas residuales, etc.) se realizan mediante métodos de cromatografía de gases.
La esencia de los métodos de análisis cromatográficos.
La cromatografía es un método dinámico para la separación y determinación de sustancias, basado en la distribución múltiple de componentes entre dos fases: móvil y estacionaria.
La sustancia ingresa a la capa absorbente junto con el flujo de la fase móvil. En este caso, la sustancia se absorbe y luego, al entrar en contacto con porciones nuevas de la fase móvil, se desorbe. El movimiento de la fase móvil se produce de forma continua, por lo que la sorción y desorción de la sustancia se produce de forma continua. En este caso, parte de la sustancia está en fase estacionaria en estado sorbido, y parte está en fase móvil y se mueve con ella. Como resultado, la velocidad de movimiento de la sustancia es menor que la velocidad de movimiento de la fase móvil. Cuanto más se absorbe una sustancia, más lento se mueve.
Si se cromatografía una mezcla de sustancias, entonces la velocidad de movimiento de cada una de ellas es diferente debido a las diferentes afinidades por el sorbente, como resultado de lo cual las sustancias se separan: algunos componentes se retrasan al comienzo del viaje, otros se mueven más.
Clasificación de métodos de análisis cromatográficos.
Los métodos de análisis cromatográficos son tan diversos que no existe una clasificación única de ellos. Muy a menudo, se utilizan varias clasificaciones, que se basan en las siguientes características:
§ estado de agregación de las fases móvil y estacionaria;
§ mecanismo de interacción de la sustancia con el sorbente;
§ técnica de análisis (forma de diseñar el proceso);
§ método de cromatografía (método de mover una sustancia a través de una columna);
§ finalidad de la cromatografía.
Dependiendo del estado de agregación de las fases, se distingue entre cromatografía de gases (fase móvil: gas o vapor) y cromatografía líquida (fase móvil: líquida).
Según el mecanismo de interacción de una sustancia con un sorbente, se distinguen los siguientes tipos de cromatografía: adsorción, distribución, intercambio iónico, sedimentación, redox, complejación, etc.
EN dependencias de forma registro proceso diferenciar de columna Y plano cromatografía. EN de columna cromatografía proceso separación dirigir V columnas, completado sorbente. plano cromatografía incluye V mí mismo dos variedades: cromatografía en papel Y capa delgada cromatografía en registros.
EN dependencias de forma cromatografía diferenciar siguiente tipos cromatografía:
§ eluyente (desarrollando) cromatografía;
§ represivo cromatografía;
§frontal cromatografía.
Más a menudo En general se utiliza el método de desarrollo de la cromatografía. Consiste en introducir en un flujo continuo de la fase móvil (eluyente) una mezcla de sustancias que se absorben mejor que el eluyente. A medida que el eluyente se mueve a través de la columna con sustancias sorbidas, se mueven a lo largo de la capa sorbente a diferentes velocidades y finalmente la dejan en zonas separadas separadas por el eluyente.
Según el propósito del proceso cromatográfico, se distinguen: cromatografía analítica: un método independiente de separación, análisis cualitativo y cuantitativo de sustancias; Cromatografía preparativa para aislar sustancias puras de una mezcla.
Cromatografía de gases
El método de cromatografía de gases se ha generalizado más porque la teoría y el equipo para ello están más desarrollados.
La cromatografía de gases es un método híbrido que permite la separación y determinación simultánea de los componentes de una mezcla.
Como fase móvil (gas portador) se utilizan gases, sus mezclas o compuestos que se encuentran en estado gaseoso o de vapor en condiciones de separación.
Como fase estacionaria se utilizan sorbentes sólidos (cromatografía de adsorción de gases) o líquidos aplicados en una capa fina sobre la superficie de un portador inerte (cromatografía de gases-líquido).
Ventajas de la cromatografía de gases analítica:
§ la capacidad de identificar y cuantificar componentes individuales de mezclas complejas;
§ alta claridad de separación y expresividad;
§ la capacidad de estudiar micromuestras y registrar resultados automáticamente;
§ la capacidad de analizar una amplia gama de objetos, desde gases ligeros hasta compuestos orgánicos de alto peso molecular;
Principales enfoques teóricos
La tarea de la teoría de la cromatografía es establecer las leyes del movimiento y la difuminación de las zonas cromatográficas. Muy a menudo, se utilizan los siguientes enfoques para esto:
§ teoría de placas teóricas;
§ Teoría cinética.
La teoría de las placas teóricas se basa en el supuesto de que la columna está dividida en pequeñas secciones: placas. Se trata de capas estrechas de la columna en las que se establece el equilibrio en la distribución de la sustancia entre las fases móvil y estacionaria.
La teoría cinética relaciona la eficiencia de la separación con los procesos de difusión de la sustancia en la columna debido al movimiento del flujo del gas portador. Cuando una sustancia se mueve a lo largo de la columna, se encuentra en fase móvil o en fase estacionaria, es decir, el proceso de cromatografía se realiza por pasos. El tiempo que pasa una sustancia en ambas fases determina la velocidad de su movimiento a través de la columna.
Parámetros de pico cromatográfico
Arroz. 5 Cromatograma de una mezcla de tres sustancias.
1. El tiempo de retención (tR) es el tiempo desde que se introduce la muestra analizada hasta que se registra el máximo del pico cromatográfico. Depende de la naturaleza de la sustancia y es una característica cualitativa.
2. Altura (h) o área (S) del pico
S = ½ h. (4)
La altura y el área del pico dependen de la cantidad de sustancia y son características cuantitativas.
El tiempo de retención consta de dos componentes: el tiempo de residencia de sustancias en la fase móvil (tm) y el tiempo de residencia en la fase estacionaria (ts):
Diagrama esquemático de un cromatógrafo de gases y finalidad de los componentes principales.
El dispositivo de inyección de muestra 3 permite introducir una cierta cantidad de la mezcla analizada en estado gaseoso en el flujo de gas portador inmediatamente antes de la columna. Incluye un evaporador y un dosificador.
El flujo de gas portador introduce la muestra analizada en la columna 5, donde la mezcla se separa en sus componentes individuales.
Arroz. 6 Diagrama de bloques de un cromatógrafo de gases: 1 - cilindro con gas portador; 2 - unidad de preparación de gas; 3 - dispositivo de inyección de muestra; 4 - termostato; 5 - columna cromatográfica; 6 - detector; 7 - amplificador; 8 - grabadora
Estos últimos, en mezcla con un gas portador, se suministran al detector 6, que convierte los cambios correspondientes en las propiedades físicas o fisicoquímicas de la mezcla de componentes - gas portador en comparación con el gas portador puro en una señal eléctrica. Un detector con su correspondiente fuente de alimentación constituye el sistema de detección.
Las condiciones de temperatura requeridas del evaporador, columna y detector se consiguen colocándolos en los correspondientes termostatos 4, controlados por un termostato. Si es necesario aumentar la temperatura de la columna durante el análisis, utilice un programador de temperatura. Los termostatos y un termostato con programador constituyen un sistema de termostato, que también incluye un dispositivo para medir la temperatura.
La señal del detector, convertida por el amplificador 7, se registra en forma de cromatograma mediante el registrador 8.
A menudo se incluye en el circuito un integrador electrónico o una computadora de procesamiento de datos.
Condiciones para el análisis cromatográfico.
Al realizar análisis cromatográficos, es necesario seleccionar las condiciones óptimas para la separación de los componentes analizados. Como regla general, al determinarlos, se guían por datos de la literatura. En base a ellos, se seleccionan experimentalmente los siguientes:
§ fase estacionaria en gas-líquido o adsorbente en cromatografía de adsorción de gases;
§ portador sólido inerte en cromatografía gas-líquido;
§ gas portador;
§ consumo de gas portador;
§ volumen de la muestra;
§ temperatura de la columna.
Analisis cualitativo
Métodos básicos de identificación de sustancias:
1. Método de etiqueta
La primera versión del método se basa en el hecho de que, en las mismas condiciones, se determinan y comparan experimentalmente los tiempos de retención de la sustancia de referencia (marca) y del analito. La igualdad de los parámetros de retención permite identificar la sustancia.
La segunda versión del método de etiquetado consiste en introducir en la mezcla que se analiza un componente de referencia (etiqueta), cuya presencia se supone que está en la mezcla. Un aumento en la altura del pico correspondiente en comparación con la altura del pico antes de la adición del aditivo indica la presencia de este compuesto en la mezcla.
2. Uso de valores bibliográficos de parámetros de retención.
Análisis cuantitativo
El análisis cuantitativo se basa en la dependencia del área del pico de la cantidad de sustancia (en algunos casos, se utiliza la altura del pico).
Hay varias formas de determinar el área del pico:
§ según la fórmula, como el área de un triángulo;
§ usando un planímetro;
§ pesar los picos recortados (los picos del cromatograma se copian en un papel uniforme, se recortan y se pesan);
§ utilizando un integrador electrónico;
§ usando una computadora.
La precisión del análisis cromatográfico cuantitativo está determinada en gran medida por la elección del método más racional para calcular la concentración de sustancias. Los principales métodos son:
§ método de calibración absoluta,
§ método de normalización interna,
§ método estándar interno.
Método de calibración absoluta
La esencia del método es que se introducen cantidades conocidas de una sustancia estándar en una columna cromatográfica y se determinan las áreas de los picos.
A partir de los datos obtenidos se construye un gráfico de calibración. Luego se cromatografía la mezcla analizada y se determina el contenido de este componente según el gráfico.
Para calcular estos coeficientes se determinan las áreas de los picos de al menos 10 mezclas estándar con diferentes contenidos de una determinada sustancia i. Luego usa la fórmula.
ki = shi q / (S 100),
donde ki es el factor de corrección absoluto de la i-ésima sustancia; ui es el contenido del i-ésimo componente en la mezcla estándar (%); S - área del pico;
q es el tamaño de la muestra (volumen, cm3 - para gases, μL - para líquidos, o masa, μg - para líquidos y sólidos).
Los coeficientes obtenidos de esta forma se promedian. Luego se analiza la mezcla de prueba y el resultado se calcula usando la fórmula
shi = ki S 100/q.
El método de calibración absoluta es bastante simple, pero las condiciones necesarias para su uso son la precisión y reproducibilidad de la dosificación de la muestra, el estricto cumplimiento de la constancia de los parámetros del modo cromatográfico al calibrar el dispositivo y al determinar el contenido de la sustancia cromatográfica.
El método de calibración absoluta se utiliza especialmente para determinar uno o más componentes de una mezcla, en particular cuando se utiliza un cromatógrafo para regular el modo del proceso tecnológico en función del contenido de una o una pequeña cantidad de sustancias en los productos. Este método es el principal para determinar trazas de impurezas.
Factores de corrección relativos
Debido a la baja precisión de la dosificación de muestras, se han desarrollado varios métodos en los que el tamaño de la muestra no se utiliza en los cálculos. Estos métodos utilizan factores de corrección relativos. Toman en cuenta las diferencias en la sensibilidad del detector utilizado a los componentes de la muestra analizada y dependen poco de los parámetros del proceso. Se encuentran de antemano para cada componente de la muestra.
Para determinar los coeficientes de corrección relativa (calibración), se preparan una serie de mezclas binarias de composición conocida y, a partir de los cromatogramas resultantes, se realizan cálculos mediante la fórmula
ki =(i /st)/(Si/Sst), (4)
Se pueden utilizar mezclas de calibración de un mayor número de sustancias, aunque la precisión de la determinación puede disminuir.
Los factores de corrección relativos se utilizan en los métodos de normalización interna, estándar interno, etc.
Método de normalización interna
La esencia del método es que la suma de las áreas de los picos de todos los componentes de la mezcla se toma como 100%.
Una condición necesaria para utilizar el método es el registro de todos los componentes (el cromatograma contiene picos separados de todos los componentes de la mezcla).
La concentración del i-ésimo componente se calcula mediante la fórmula
i = ki Si 100/ У(ki Si).
Al calcular los factores de corrección utilizando la fórmula (4) para este método, se puede seleccionar como estándar uno de los compuestos incluidos en la mezcla en estudio. El factor de calibración de una sustancia estándar es igual a 1.
Método estándar interno
La esencia del método es que se introduce una cierta cantidad de una sustancia estándar (sustancia de comparación) en la mezcla analizada.
i = ki Si 100 r/Sst..
donde ki es el factor de corrección relativo del i-ésimo componente, calculado según la fórmula (4); Si y Sst. - áreas de pico del i-ésimo componente y patrón interno; r es la relación entre la masa del estándar interno y la masa de la mezcla analizada (sin estándar): r = mst./mmezcla.
Requisitos para una sustancia utilizada como patrón interno:
§ no debe formar parte de la mezcla que se está probando;
§ debe ser inerte respecto de los componentes de la mezcla analizada y completamente miscible con ellos;
§ El pico del estándar debe estar bien resuelto y ubicado muy cerca de los picos de los compuestos que se están determinando.
El estándar interno se selecciona entre compuestos que son similares en estructura y propiedades fisicoquímicas a los componentes de la mezcla que se analiza. Los factores de corrección relativos para los componentes de la mezcla se determinan en relación con el estándar interno.
El método se utiliza tanto cuando todos los componentes de la mezcla analizada están registrados en el cromatograma como en el caso de mezclas identificadas de forma incompleta. La principal dificultad reside en la selección y dosificación precisa de la sustancia estándar.
Publicado en Allbest.ru
...Documentos similares
Análisis de métodos de separación de sustancias como conjunto de procesos químicos y físicos característicos de las mismas y métodos de su implementación: extracción, membrana, intrafase. La coprecipitación es un método para concentrar trazas de varios elementos.
trabajo del curso, añadido el 16/10/2011
Enfoques generales para la síntesis de esquemas de separación tecnológica. Organización multivariante del proceso de separación tecnológica. Métodos para la síntesis de esquemas de separación tecnológica. Método integral-hipotético. Productos de separación. Clorobenceno y diclorobencenos.
tesis, agregada el 04/01/2009
Métodos de análisis cualitativo de sustancias. Separación magnética de hierro y azufre y síntesis de sulfuro de hierro. Flotación, filtración y evaporación de mezclas. El uso de la cromatografía como método de separación y purificación de sustancias. Métodos de análisis físicos y químicos.
resumen, añadido el 15/02/2016
Enfoques generales para la síntesis de esquemas de separación tecnológica. Organización multivariante del proceso de separación tecnológica. Criterios de optimización. Métodos para la síntesis de esquemas de separación tecnológica. Métodos de síntesis basados en reglas heurísticas.
tesis, agregada el 04/01/2009
Características físico-químicas del cobalto. Compuestos complejos de zinc. Estudio de la concentración de sorción de Co en presencia de zinc a partir de soluciones de cloruro en un equipo de intercambiador iónico. El resultado técnico que se logró en la implementación de la invención.
resumen, añadido el 14/10/2014
Los sorbentes inmovilizados por sustancias son una nueva clase de sorbentes eficaces. 8-hidroxiquinolina y sus aplicaciones analíticas. Sorbentes quelantes con grupos 8-hidroxiquinolina. Estudio de la concentración de Cu en el intercambiador aniónico AV-17 y sus resultados.
trabajo del curso, añadido el 27/09/2010
El método cromatográfico para separar y analizar mezclas complejas fue descubierto por el botánico ruso M.S. Color. La cromatografía es la repetición repetida de actos de sorción y desorción de una sustancia a medida que se mueve en un flujo de la fase móvil a lo largo de un sorbente estacionario.
trabajo del curso, añadido el 13/03/2011
Métodos para separar mezclas azeotrópicas y zeotrópicas. Rectificación azeotrópica y heteroazeotrópica. Rectificación extractiva. Métodos para la síntesis de esquemas de separación tecnológica. Algunas propiedades, efectos tóxicos, preparación y uso de componentes.
tesis, agregada el 04/01/2009
Ecuación de una reacción química mediante el método del ion electrón. Determinación de los potenciales del oxidante y reductor, la dirección del proceso, las características termodinámicas de H, S, G. Fórmula electrónica de elementos por 2 y 4 números cuánticos.
trabajo del curso, añadido el 25/11/2009
El efecto térmico de una reacción química o el cambio de entalpía de un sistema debido a la ocurrencia de una reacción química. Influencia de las condiciones externas sobre el equilibrio químico. La influencia de la presión, la concentración y la temperatura en la posición de equilibrio. Tipos de enlaces químicos.