Pretože d-oxidy kovov sú nerozpustné vo vode, ich hydroxidy sa získavajú nepriamo výmennými reakciami medzi ich soľami a alkalickými roztokmi:
ZnCl2 + 2NaOH \u003d Zn(OH)2 + 2NaCl;
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl (v neprítomnosti kyslíka);
FeSO4 + 2KOH \u003d Fe (OH)2 + K2S04 (v neprítomnosti kyslíka).
Hydroxidy d-prvkov v najnižších oxidačných stupňoch sú slabé zásady; Sú nerozpustné vo vode, ale rozpustné v kyselinách:
Cu(OH)2 + 2HCl = CuCl2 + H20
Cu(OH)2 + H2S04 = CuS04 + H20
Hydroxidy d-prvkov v stredných oxidačných stavoch a hydroxid zinočnatý sa rozpúšťajú nielen v kyselinách, ale aj v prebytočných alkalických roztokoch za vzniku hydroxokomplexov (t.j. majú amfotérne vlastnosti), napr.
Zn(OH)2 + H2S04 = ZnS04 + 2H20;
Zn (OH)2 + 2NaOH \u003d Na2;
Cr(OH)3 + 3HN03 = Cr(N03)3 + 3H20;
Cr(OH)3 + 3KOH = K3.
Vo vyšších oxidačných stupňoch tvoria prechodné kovy hydroxidy, ktoré vykazujú kyslé vlastnosti alebo amfotérne vlastnosti s prevahou kyslých:
So zvyšovaním stupňa oxidácie prvku sa základné vlastnosti oxidov a hydroxidov oslabujú a zvyšujú sa vlastnosti kyselín.
Preto v priebehu obdobia zľava doprava dochádza k zvýšeniu kyslých vlastností hydroxidov d-kovov vo vyšších oxidačných stupňoch na podskupinu Mn, potom kyslé vlastnosti oslabujú:
Sc(OH)3 - Ti02 xH20 - V205 xH20 - H2Cr04 - HMn04
Posilnenie kyslých vlastností
Fe(OH)3 - Co(OH)2 - Cu(OH)2 - Zn(OH)2
Pomalé oslabovanie kyslých vlastností
Zvážte zmenu vlastností d-hydroxidov kovov v podskupinách. Zhora nadol v podskupine základné vlastnosti hydroxidov d-prvkov vo vyšších oxidačných stupňoch stúpajú, kyslé vlastnosti klesajú. Napríklad pre šiestu skupinu d-kovov:
H 2 CrO 4 - ostro - MoO 3 H 2 O - slabo - WO 3 H 2 O
Vlastnosti kyselín sa znižujú
Redoxné vlastnosti zlúčenín d-prvkov
Spoje d - prvkov v nižších oxidačných stavoch vykazujú predovšetkým, redukčné vlastnosti, najmä v alkalickom prostredí. Preto sú napríklad hydroxidy Mn(+2), Cr(+2), Fe(+2) veľmi nestabilné a rýchlo sa oxidujú vzdušným kyslíkom:
2Mn(OH)2 + 02 + 2H20 = 2Mn(OH)4;
4Cr(OH)2 + 02 + 2H20 = 4Cr(OH)3
Na premenu hydroxidu kobaltnatého (II) alebo nikelnatého (II) na Co (OH) 3 alebo Ni (OH) 3 je potrebné použiť silnejšie oxidačné činidlo - napríklad peroxid vodíka H 2 O 2 v alkalickom prostredí. alebo bróm Br 2:
2Co(OH)2 + H202 = 2Co(OH)3;
2 Ni(OH) 2 + Br2 + 2NaOH = 2 Ni(OH) 3 + 2NaBr
Deriváty Ti(III), V(III), V(II), Cr(II) ľahko oxidujú na vzduchu, niektoré soli môžu byť oxidované aj s vodou:
2Ti2(S04)3 + 02 + 2H20 \u003d 4TiOS04 + 2H2S04;
2CrCl2 + 2H20 \u003d 2Cr (OH) Cl2 + H2
Zlúčeniny d-prvkov vo vyšších oxidačných stupňoch (od +4 do +7) zvyčajne vykazujú oxidačné vlastnosti. Avšak zlúčeniny Ti (IV) a V (V) sú vždy stabilné, a preto majú relatívne slabé oxidačné vlastnosti:
TiOS04 + Zn + H2S04 = Ti2(S04)3 + ZnS04 + H20;
Na 3 VO 4 + Zn + H 2 SO 4 = VOSO 4 + ZnSO 4 + H 2 O
Obnova prebieha v drsných podmienkach - s atómovým vodíkom v čase jeho uvoľnenia (Zn + 2H + = 2H+ + Zn 2+).
A zlúčeniny chrómu vo vyšších oxidačných stupňoch sú silné oxidačné činidlá, najmä v kyslom prostredí:
K2Cr207 + 3SO2 + H2SO4 = Cr2(S04)3 + K2S04 + H20;
2CrO3 + C2H5OH \u003d Cr203 + CH3COH + H20
Zlúčeniny Mn(VI), Mn(VII) a Fe(VI) vykazujú ešte silnejšie oxidačné vlastnosti:
2KMn04 + 6KI + 4H20 = 2Mn02 + 3I2 + 8KOH;
4K 2 FeO 4 + 10H 2 SO 4 \u003d 2 Fe 2 (SO 4) 3 + 3O 2 + 10H 2 O + 4K 2 SO 4
teda oxidačné vlastnosti zlúčenín d-prvkov vo vyšších oxidačných stupňoch sa v priebehu periódy zvyšujú zľava doprava.
Oxidačná schopnosť zlúčenín d-prvkov vo vyšších oxidačných stupňoch v podskupine zhora nadol sa oslabuje. Napríklad v podskupine chrómu: dvojchróman draselný K 2 Cr 2 O 7 interaguje aj s takým slabým redukčným činidlom, akým je SO 2 . Na obnovenie molybdénanových alebo volfrámových iónov je potrebné veľmi silné redukčné činidlo, napríklad roztok chloridu cínatého v kyseline chlorovodíkovej:
K2Cr207 + SO2 + H2SO4 = Cr2(SO4)3 + K2S04 + H20
3 (NH 4) 2 MoO 4 + НSnCl 3 + 9HCl = MoO 3 MoO 5 + H 2 SnCl 6 + 4H 2 O + 6NH 4 Cl
Posledná reakcia nastáva pri zahrievaní a oxidačný stav d-prvku veľmi mierne klesá.
Zlúčeniny d-kovov v strednom oxidačnom stave majú redoxnú dualitu. Napríklad zlúčeniny železa (III), v závislosti od povahy partnerskej látky, môžu vykazovať vlastnosti redukčného činidla:
2FeCl3 + Br2 + 16KOH = 2K2Fe04 + 6KBr + 6KCl + 8H20,
a oxidačné vlastnosti:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
2NaOH + CO2 \u003d Na2C03 + H20,
soľ zásaditej kyseliny
Cu(OH)2 + H2S04 = CuS04 + 2H20,
soľ zásaditej kyseliny
2NaOH + PbO \u003d Na2PbO2 + H20,
základná amfotérna soľ
2NaOH + Pb(OH)2 = Na2Pb02 + 2H20,
základná amfotérna soľ
hydroxid
2H3P04 + 3Na20 \u003d 2Na3P04 + 3H20,
kyslá zásaditá soľ
H2SO4 + SnO \u003d SnS04 + H20,
kyslá amfotérna soľ
H2S04 + Sn (OH)2 \u003d SnS04 + 2H20.
kyslá amfotérna soľ
hydroxid
Amfotérne hydroxidy v reakciách s kyselinami vykazujú hlavné vlastnosti:
2Al (OH)3 + 3H2S04 \u003d Al2(S04)3 + 6H20,
s alkáliami (zásadami) - kyslé vlastnosti:
H3AlO3 + 3NaOH \u003d Na3Al03 + 3H20,
alebo H3A103 + NaOH = NaAl02 + 2H20.
Zásady a kyseliny reagujú so soľami, ak výsledkom je zrazenina alebo slabý elektrolyt. Slabé kyseliny - H 3 PO 4, H 2 CO 3, H 2 SO 3, H 2 SiO 3 a iné.
2NaOH + NiSO 4 \u003d Ni (OH) 2 + Na2S04,
soľný základ
3H2S04 + 2Na3P04 = 2H3P04 + 3Na2S04
kyslá soľ
Anoxické kyseliny vstupujú do rovnakých reakcií ako predtým uvažované kyseliny obsahujúce kyslík.
Príklad. Vytvorte vzorce hydroxidov zodpovedajúcich oxidom: a) FeO; b) N203; c) Cr203. Pomenujte spojenia.
rozhodnutie
a) FeO je zásaditý oxid, preto zodpovedajúci hydroxid je zásada, v základnom vzorci sa počet hydroxoskupín (OH) rovná oxidačnému stavu atómu kovu; vzorec hydroxidu železitého je Fe (OH)2.
b) N203 je kyslý oxid, preto je zodpovedajúci hydroxid kyselina. Vzorec kyseliny možno získať z vyjadrenia kyseliny ako hydrátu zodpovedajúceho oxidu:
N203. H20 \u003d (H2N204) \u003d 2HNO2 - kyselina dusitá.
c) Cr 2 O 3 je amfotérny oxid, preto je zodpovedajúci hydroxid amfotérny. Amfotérne hydroxidy sa píšu vo forme zásad - Cr (OH) 3 - hydroxid chrómový (III).
soľ
soľ- látky, ktoré pozostávajú zo zásaditých a kyslých zvyškov. Soľ CuSO 4 teda pozostáva z hlavného zvyšku - kovového katiónu Cu 2+ a kyslého zvyšku - SO 4 2 .
Podľa tradičnej nomenklatúry sú názvy solí kyslíkatých kyselín nasledovné: koncovka sa pridáva ku koreňu latinského názvu centrálneho atómu zvyšku kyseliny - pri(pri vyšších oxidačných stavoch centrálneho atómu) alebo - to(pre nižší oxidačný stav) a potom - zvyšok bázy v prípade genitívu, napr.: Na 3 PO 4 - fosforečnan sodný, BaSO 4 - síran bárnatý, BaSO 3 - siričitan bárnatý. Názvy solí bezkyslíkatých kyselín vznikajú pridaním prípony ku koreňu latinského názvu nekovu - id a ruský názov pre kov (zvyšok zo zásady), napríklad CaS - sulfid vápenatý.
Stredné soli neobsahujú vo svojom zložení vodíkové ióny a hydroxoskupiny, ktoré je možné nahradiť kovom, napríklad CuCl2, Na2C03 a iné.
Chemické vlastnosti solí
Stredné soli vstupujú do výmenných reakcií s alkáliami, kyselinami, soľami. Príklady relevantných reakcií nájdete vyššie.
Kyslé soli obsahujú ako súčasť kyslého zvyšku vodíkový ión, napríklad NaHC03, CaHP04, NaH2P04 atď. V názve kyslej soli je vodíkový ión označený predponou hydro-, pred ktorým uveďte počet atómov vodíka v molekule soli, ak je väčší ako jeden. Napríklad názvy solí vyššie uvedeného zloženia sú hydrogenuhličitan sodný, hydrogenfosforečnan vápenatý, dihydrogenfosforečnan sodný.
Kyslé soli sú
interakcia základne a viacsýtna kyselina s nadbytkom kyseliny:
Ca(OH)2 + H3P04 = CaHP04 + 2H20;
interakcia priemernej soli viacsýtnej kyseliny a zodpovedajúcej kyseliny alebo silnejšej kyseliny prijatej v deficite:
CaCO 3 + H 2 CO 3 \u003d Ca (HCO 3) 2,
Na3P04 + HCl = Na2HP04 + NaCl.
Zásadité soli obsahujú ako súčasť zvyšku zásady hydroxoskupina, napríklad CuOHNO 3, Fe (OH) 2 Cl. V názve bázickej soli je hydroxoskupina označená predponou hydroxo-, napríklad názvy vyššie uvedených solí: hydroxonitrát meďnatý, dihydroxochlorid železitý.
Zásadité soli sú
interakcia polykyseliny (obsahujúcej vo svojom zložení viac ako jednu hydroxoskupinu) zásady a kyseliny s nadbytkom zásady:
Cu(OH)2 + HN03 = CuOHN03 + H20;
interakcia soli tvorenej polykyselinovou zásadou a zásadou prijatou v deficite:
FeCl 3 + NaOH = FeOHCl 2 + NaCl,
FeCl3 + 2NaOH \u003d Fe (OH)2Cl + 2NaCl.
Kyslé a zásadité soli majú všetky vlastnosti solí. Pri reakciách s alkáliami, kyslými soľami a s kyselinami sa zásadité soli menia na stredné.
Na2HP04 + NaOH = Na3P04 + H20,
Na2HP04 + 2HCl \u003d H3P04 + 2NaCl,
FeOHCl2 + HCl \u003d FeCl3 + H20,
FeOHCl 2 + 2NaOH \u003d Fe (OH) 3 + 2NaCl.
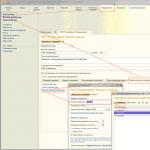
Príklad 1. Vytvorte vzorce pre všetky soli, ktoré môžu byť tvorené zásadou Mg (OH) 2 a kyselinou H 2 SO 4.
rozhodnutie
Vzorce soli sú zložené z možných zásaditých a kyslých zvyškov, pričom sa dodržiava pravidlo elektrickej neutrality. Možné zásadité zvyšky sú Mg 2+ a MgOH +, kyslé zvyšky sú SO 4 2- a HSO 4 -. Náboje komplexných zásaditých a kyslých zvyškov sa rovnajú súčtu oxidačných stavov ich základných atómov. Kombináciou zásaditých a kyslých zvyškov zostavíme vzorce možných solí: MgSO 4 - priemerná soľ - síran horečnatý; magnézium(HS04)2 - soľ kyseliny - hydrosíran horečnatý; (MgOH) 2 SO 4 - hlavná soľ je hydroxosíran horečnatý.
Príklad 2 Napíšte reakcie tvorby solí pri interakcii oxidov
a) PbO a N205; b) PbO a Na20.
rozhodnutie
Pri reakciách medzi oxidmi vznikajú soli, ktorých hlavné zvyšky vznikajú zo zásaditých oxidov, kyslé zvyšky z kyslých oxidov.
a) Pri reakcii s kyslým oxidom N 2 O 5 vykazuje amfotérny oxid PbO vlastnosti zásaditého oxidu, preto je hlavným zvyškom výslednej soli Pb 2+ (náboj olovnatého katiónu je rovný oxidačný stav olova v oxide), zvyšok kyseliny je NO 3 (zvyšok kyseliny zodpovedajúci danému kyslému oxidu dusičnej). Reakčná rovnica
PbO + N205 \u003d Pb (NO 3) 2.
b) Pri reakcii so zásaditým oxidom Na 2 O vykazuje amfotérny oxid PbO vlastnosti kyslého oxidu, kyslý zvyšok výslednej soli (PbO 2 2 ) sa nachádza v kyslej forme zodpovedajúceho amfotérneho hydroxidu Pb. (OH)2 \u003d H2Pb02. Reakčná rovnica
Draslík, sodík alebo lítium môžu interagovať s vodou. V tomto prípade sa v produktoch reakcie nachádzajú zlúčeniny príbuzné hydroxidom. Vlastnosti týchto látok, znaky priebehu chemických procesov, na ktorých sa zúčastňujú zásady, sú spôsobené prítomnosťou hydroxylovej skupiny v ich molekulách. Takže v reakciách elektrolytickej disociácie sa zásady rozdeľujú na kovové ióny a OH - anióny. Ako zásady interagujú s oxidmi nekovov, kyselinami a soľami, zvážime v našom článku.
Nomenklatúra a štruktúra molekuly
Pre správne pomenovanie bázy je potrebné k názvu kovového prvku pridať slovo hydroxid. Uveďme konkrétne príklady. Hliníková báza patrí k amfotérnym hydroxidom, ktorých vlastnosti sa budeme zaoberať v článku. Povinná prítomnosť hydroxylovej skupiny spojenej s katiónom kovu typom iónovej väzby v základných molekulách môže byť stanovená pomocou indikátorov, napríklad fenolftaleínu. Vo vodnom prostredí je nadbytok OH - iónov určený zmenou farby roztoku indikátora: bezfarebný fenolftaleín sa stáva karmínovým. Ak kov vykazuje viacero mocností, môže tvoriť viacero báz. Napríklad železo má dve bázy, v ktorých sa rovná 2 alebo 3. Prvá zlúčenina sa vyznačuje znakmi druhej - amfotérnej. Preto sa vlastnosti vyšších hydroxidov líšia od zlúčenín, v ktorých má kov nižší stupeň valencie.

Fyzická charakteristika
Základy sú pevné látky, ktoré sú odolné voči teplu. Vo vzťahu k vode sa delia na rozpustné (zásady) a nerozpustné. Prvú skupinu tvoria chemicky aktívne kovy – prvky prvej a druhej skupiny. Látky nerozpustné vo vode sú zložené z atómov iných kovov, ktorých aktivita je nižšia ako aktivita sodíka, draslíka alebo vápnika. Príkladmi takýchto zlúčenín sú železné alebo medené zásady. Vlastnosti hydroxidov budú závisieť od toho, do ktorej skupiny látok patria. Zásady sú teda tepelne stabilné a pri zahrievaní sa nerozkladajú, zatiaľ čo vo vode nerozpustné zásady sa pôsobením vysokej teploty zničia, pričom sa vytvorí oxid a voda. Napríklad medená báza sa rozkladá takto:
Cu(OH)2 \u003d CuO + H20

Chemické vlastnosti hydroxidov
Interakcia medzi dvoma najdôležitejšími skupinami zlúčenín – kyselinami a zásadami – sa v chémii nazýva neutralizačná reakcia. Tento názov možno vysvetliť tým, že chemicky agresívne hydroxidy a kyseliny tvoria neutrálne produkty – soli a vodu. Keďže ide v skutočnosti o proces výmeny medzi dvoma komplexnými látkami, neutralizácia je charakteristická pre alkálie aj pre vo vode nerozpustné zásady. Tu je rovnica pre neutralizačnú reakciu medzi hydroxidom draselným a kyselinou chlorovodíkovou:
KOH + HCl \u003d KCl + H20
Dôležitou vlastnosťou zásad alkalických kovov je ich schopnosť reagovať s kyslými oxidmi, čoho výsledkom je soľ a voda. Napríklad prechodom oxidu uhličitého cez hydroxid sodný môžete získať jeho uhličitan a vodu:
2NaOH + CO2 \u003d Na2C03 + H20
Reakcie iónovej výmeny zahŕňajú interakciu medzi zásadami a soľami, čo vedie k tvorbe nerozpustných hydroxidov alebo solí. Takže naliatím roztoku po kvapkách do roztoku síranu meďnatého môžete získať modrú želé podobnú zrazeninu. Je to medená báza, nerozpustná vo vode:
CuS04 + 2NaOH \u003d Cu (OH)2 + Na2S04
Chemické vlastnosti hydroxidov, ktoré sú nerozpustné vo vode, sa líšia od alkálií tým, že pri miernom zahriatí strácajú vodu - dehydratujú sa a prechádzajú do formy zodpovedajúceho zásaditého oxidu.
Bázy vykazujúce dvojaké vlastnosti
Ak prvok alebo môže reagovať s kyselinami aj zásadami, nazýva sa amfotérny. Patria sem napríklad zinok, hliník a ich bázy. Vlastnosti amfotérnych hydroxidov umožňujú zapísať ich molekulové vzorce ako pri izolácii hydroxoskupiny, tak aj vo forme kyselín. Uveďme niekoľko rovníc pre reakcie hlinitej zásady s kyselinou chlorovodíkovou a hydroxidom sodným. Ilustrujú špeciálne vlastnosti amfotérnych hydroxidov. Druhá reakcia prebieha s rozpadom alkálie:
2Al(OH)3 + 6HCl = 2AlCl3 + 3H20
Al(OH)3 + NaOH = NaAl02 + 2H20
Produktmi procesov budú voda a soli: chlorid hlinitý a hlinitan sodný. Všetky amfotérne zásady sú nerozpustné vo vode. Získavajú sa ako výsledok interakcie zodpovedajúcich solí a zásad.
Spôsoby získavania a aplikácie
V priemysle, ktorý vyžaduje veľké objemy alkálií, sa získavajú elektrolýzou solí obsahujúcich katióny aktívnych kovov prvej a druhej skupiny periodického systému. Surovinou na extrakciu, napríklad hydroxid sodný, je roztok kuchynskej soli. Reakčná rovnica bude:
2NaCl + 2H20 \u003d 2NaOH + H2 + Cl2
Základy nízkoaktívnych kovov v laboratóriu sa získavajú interakciou alkálií s ich soľami. Reakcia patrí k typu iónovej výmeny a končí vyzrážaním zásady. Jednoduchým spôsobom získania alkálií je substitučná reakcia medzi aktívnym kovom a vodou. Je sprevádzané zahrievaním reakčnej zmesi a patrí k exotermickému typu.

Vlastnosti hydroxidov sa využívajú v priemysle. Osobitnú úlohu tu zohrávajú alkálie. Používajú sa ako čistiace prostriedky na petrolej a benzín, na výrobu mydla, spracovanie prírodnej kože, ako aj v technológiách výroby umelého hodvábu a papiera.
DEFINÍCIA
Hydroxidy nazývajú sa komplexné látky, ktoré zahŕňajú atómy kovov spojené s jednou alebo viacerými hydroxoskupinami.
Väčšina báz sú pevné látky s rôznou rozpustnosťou vo vode. Hydroxid meďný (II) je modrý (obr. 1), hydroxid železitý (III) je hnedý, väčšina ostatných je biela.
Ryža. 1. Hydroxid meďný (II). Vzhľad.
Získanie hydroxidov
Rozpustné zásady (alkálie) v laboratóriu možno získať interakciou aktívnych kovov a ich oxidov s vodou:
CaO + H20 \u003d Ca (OH) 2.
Alkálie hydroxid sodný a hydroxid vápenatý sa získavajú elektrolýzou vodných roztokov chloridu sodného a chloridu draselného.
Vo vode nerozpustné zásady sa získavajú reakciou solí s alkáliami vo vodných roztokoch:
FeCl3 + 3NaOH vodný \u003d Fe (OH)3↓ + 3NaCl.
Chemické vlastnosti hydroxidov
Rozpustné a nerozpustné zásady majú spoločnú vlastnosť: reagujú s kyselinami za vzniku solí a vody (neutralizačná reakcia):
NaOH + HCl \u003d NaCl + H20;
Cu(OH)2 + 2HCl = CuCl2 + H20.
Alkalické roztoky menia farbu niektorých látok – lakmusu, fenolftaleínu a metyloranže, nazývaných indikátory (tabuľka 1).
Tabuľka 1. Zmena farby indikátorov pod vplyvom roztokov kyselín a zásad.
Okrem všeobecných vlastností majú alkálie a vo vode nerozpustné zásady aj špecifické. Napríklad, keď sa zahreje modrá zrazenina hydroxidu meďnatého (II), vytvorí sa čierna látka - toto je oxid meďnatý:
Cu (OH)2 \u003d CuO + H20.
Zásady, na rozdiel od nerozpustných zásad, sa pri zahrievaní zvyčajne nerozkladajú. Ich roztoky pôsobia na indikátory, korodujú organické látky, reagujú s roztokmi solí (ak obsahujú kov schopný tvoriť nerozpustnú zásadu) a kyslými oxidmi:
Fe2(S04)3 + 6KOH \u003d 2Fe (OH)3↓ + 3K2S04;
2KOH + CO2 \u003d K2C03 + H20.
Aplikácia hydroxidov
Hydroxidy sú široko používané v priemysle a každodennom živote. Veľký význam má napríklad hydroxid vápenatý. Je to biely sypký prášok. Po zmiešaní s vodou vzniká takzvané vápenné mlieko. Keďže hydroxid vápenatý je vo vode málo rozpustný, po prefiltrovaní vápenného mlieka sa získa číry roztok – vápenná voda, ktorá sa pri prechode oxidu uhličitého zakalí. Hydratované vápno sa používa na prípravu zmesi Bordeaux - prostriedok na boj proti chorobám rastlín a škodcom. Vápenné mlieko sa široko používa v chemickom priemysle, napríklad pri výrobe cukru, sódy a iných látok.
Hydroxid sodný sa používa na rafináciu ropy, výrobu mydla a v textilnom priemysle. V batériách sa používa hydroxid draselný a hydroxid lítny.
Príklady riešenia problémov
PRÍKLAD 1
| Cvičenie | V jednom z hydroxidov cínu sa hmotnostný zlomok prvkov rovná: cínu - 63,6%; kyslík - 34,2 %; vodík - 2,2 %. Určte vzorec pre tento hydroxid. |
| rozhodnutie | Hmotnostný podiel prvku X v molekule zloženia HX sa vypočíta podľa tohto vzorca: ω (X) = n × Ar (X) / M (HX) × 100 %. Označme počet mólov prvkov, ktoré tvoria zlúčeninu, „x“ (cín), „y“ (kyslík) a „z“ (vodík). Potom bude molárny pomer vyzerať takto (hodnoty relatívnych atómových hmotností prevzaté z periodickej tabuľky D.I. Mendelejeva budú zaokrúhlené na celé čísla): x:y:z = co(Sn)/Ar(Sn): co(0)/Ar(0): co(H)/Ar(H); x:y:z = 63,6/119: 34,2/16: 2,1/1; x:y:z = 0,53: 2,14: 2,1 = 1:4:4. Takže vzorec hydroxidu cínatého je Sn(OH)4. |
| Odpoveď | Vzorec hydroxidu cínatého je Sn(OH)4 |
PRÍKLAD 2
| Cvičenie | Stanovte hmotnostný zlomok hydroxidu bárnatého v roztoku získanom zmiešaním vody s hmotnosťou 50 g a oxidu bárnatého s hmotnosťou 1,2 g. |
| rozhodnutie | Hmotnostný podiel látky X v roztoku sa vypočíta podľa tohto vzorca: ω (X) = m(X)/m roztoku × 100 %. Hmotnosť roztoku je súčtom hmotností rozpustenej látky a rozpúšťadla: m roztok = m(H20) + m(BaO) = 50 + 1,2 = 51,2 g. Napíšeme reakčnú rovnicu na získanie hydroxidu bárnatého: BaO + H20 \u003d Ba (OH) 2. Vypočítajte počet mólov východiskových látok: n(H20) = m(H20)/M(H20); M(H20) = 18 g/mol; n(H20) \u003d 50/18 \u003d 2,8 mol. n(BaO) = m(BaO)/M(BaO); M(BaO) = 153 g/mol; n(BaO) \u003d 1,2 / 153 \u003d 0,008 mol. Výpočet sa vykonáva pre zlúčeninu, ktorej je nedostatok (oxid bárnatý). Podľa rovnice n(BaO) :n(Ba(OH)2) = 1:1, t.j. n (Ba (OH) 2) \u003d n (BaO) \u003d 1,04 mol. Potom sa hmotnosť vytvoreného hydroxidu bárnatého bude rovnať: m (Ba (OH) 2) \u003d n (Ba (OH) 2) x M (Ba (OH) 2); M (Ba (OH) 2) \u003d 171 g/mol; m (Ba (OH) 2) \u003d 0,008 × 171 \u003d 1,368 g. Nájdite hmotnostný zlomok hydroxidu bárnatého v roztoku: ω (Ba (OH) 2) \u003d 1,368 / 51,2 × 100 % \u003d 2,67 %. |
| Odpoveď | Hmotnostný podiel hydroxidu bárnatého je 2,67 % |
oxidy - Sú to zložité látky pozostávajúce z nejakého prvku a kyslíka s oxidačným stavom -2.
Napríklad: K2O, CaO, Fe2O3, CO2, P2O5, SO3, Cl2O7, OsO4. Oxidy tvoria všetky chemické prvky okrem He, Ne, Ar. Chemická väzba medzi kyslíkom a iným prvkom je buď iónová alebo kovalentná. Podľa chemických vlastností sa oxidy delia na soľotvorné a nesolitvorné. Posledne uvedené zahŕňajú napríklad N20, NO, N02, SiO, SO.
Oxidy tvoriace soli sa delia na zásadité, kyslé a amfotérne.
Zásadité oxidy. Oxidy, ktorých hydráty sú zásadami, sa nazývajú zásadité oxidy. Napríklad Na2O, CuO sú zásadité oxidy, keďže zásadám zodpovedajú NaOH, Cu(OH)2. Základnými oxidmi môžu byť spravidla oxidy kovov s oxidačným stavom +1, +2. Chemická väzba je tu iónová.
Oxidy alkalických (Li, Na, K, Rb, Cs, Fr) a kovov alkalických zemín (Ca, Sr, Ba, Ra), ktoré interagujú s vodou, poskytujú zásady. Napríklad:
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
Zvyšné zásadité oxidy prakticky neinteragujú s vodou. Zásadité oxidy reagujú s kyselinami a poskytujú soľ a vodu:
Fe203 + 3H2S04 \u003d Fe2 (S04)3 + 3H20
Fe203 + 6H+ = 2Fe 3 + + 3H20
Zásadité oxidy reagujú s kyslými oxidmi a poskytujú soli:
FeO + SiO 2 \u003d FeSiO 3 (t)
Kyslé oxidy. Oxidy, ktorých hydráty sú kyseliny, sa nazývajú kyslé. Kyslé oxidy zahŕňajú nekovy a oxidy kovov s oxidačným stavom +4, +5, +6, +7. Napríklad N203, P205 , CrO 3 , Mn207, CO2, V205, SO3, Cl207 - kyslých oxidov, keďže kyselinám zodpovedajú HNO 2, H 3 PO 4, H 2 CrO 4, HMnO 4 atď. (chemická väzba je tu kovalentná a iónová). Väčšina kyslých oxidov reaguje s vodou a vytvára kyseliny. Napríklad:
S03 + H20 = H2S04
Мn2O7 + H2O = 2HMnO4
Si02 + H2O ≠
Oxidy kyselín reagujú so zásadami (zásadami) a poskytujú soľ a vodu:
N205 + Ca (OH) 2 \u003d Ca (N03) 2 + H20
N205 + 2OH‾ = 2NO3 + H20
Amfotérne oxidy. Oxidy kovov s oxidačným stavom +3, +4 a niekedy +2, ktoré v závislosti od prostredia vykazujú zásadité alebo kyslé vlastnosti, to znamená, že reagujú s kyselinami a zásadami, sa nazývajú amfotérne. Zodpovedajú hydrátom, kyselinám a zásadám. Napríklad:
Zn(OH)2 ← ZnO → H2ZnO2
H2O Al(OH) 3 ← Al 2 O 3 → H 3 AlO 3 → HalO 2
Amfotérne oxidy reagujú s kyselinami a zásadami:
Al2Oz + 3H2S04 = Al2(S04)3 + 3H20
Al20z + 6H+ = 2Al3+ + 3H20
Al2Oz + 2NaOH + 3H20 = 2Na
Al2Oz + 2OH‾ + 3H2O = 2[Al(OH)4]‾
Pri tavení Al2O3 s alkáliami vznikajú metahlinitany:
fúzia Al2O3 + 2NaOH → 2NaAlO2 + H2O
metaaluminát sodný
Al2Oz + 2OH‾ = 2Al O2‾ + H2O
Amfotérne oxidy sa priamo nezlučujú s vodou.
Hydroxidy
Chemické zlúčeniny všeobecného vzorcaR(Oh) nnazývané hydroxidy, kdeR - atóm alebo skupina atómov s kladným nábojom.
V závislosti od typu elektrolytickej disociácie sa hydroxidy delia do troch skupín: zásady, kyseliny a amfotérne hydroxidy. Napríklad:
Ba(OH)2 ↔ Ba2 + + 2OH‾ báza
H2SO4 ↔ 2H + + SO2 2 ‾ kys
Pb 2 + + 2OH‾ ↔ Pb(OH)2 ↔2H + + PbO2 2 ‾ amfotérny hydroxid