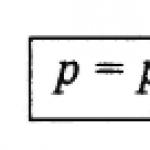Përzierjet e gazit. Ligji i Daltonit
Presioni i pjesshëm është ajo pjesë e presionit total të një përzierjeje gazi që është për shkak të një gazi ose avulli të caktuar. Gazi i pjesshëm në përzierje është i barabartë me presionin e gazit në përzierje që do të kishte vetëm, duke zënë të njëjtin vëllim me përzierjen që zë në të njëjtën temperaturë.
Ligji i Daltonit.Në mungesë të reaksioneve kimike, presioni total i përzierjes së gazit P total është i barabartë me shumën e presioneve të pjesshme të të gjithë gazrave të përfshirë në të p 1, p 2, p 3 ..., p n ˸
P total = p 1 + p 2 + ... + p n. (62)
Presioni i pjesshëm i një gazi të caktuar është proporcional me fraksionin ᴇᴦο të molekulave nga numri i përgjithshëm i molekulave të përzierjes (fraksioni mol)˸
p i = P total ·X i = P total · . (63)
Pjesa mole X i është raporti i numrit të moleve të një substance të caktuar - n i (ose një lloj i caktuar grimce) me numrin total të moleve të substancës (ose grimcave) të vendosura në sistemin n i.
Fraksioni mol mund t'i atribuohet ose të gjithë sistemit ose ndonjë faze. Në rastin e fundit, merret raporti i numrit të moleve të një lënde të caktuar në këtë fazë me numrin e përgjithshëm të moleve të substancës që formon një fazë të caktuar. Shuma e fraksioneve mole të të gjitha substancave që formojnë një sistem (ose fazë) është e barabartë me unitetin.
Përbërja e përzierjeve të gazit mund të shprehet gjithashtu duke përdorur peshë dhe pjesë vëllimore. Pjesa e peshës së një gazi të caktuar në një përzierje është raporti i masës së këtij gazi me masën e përzierjes së gazit. Nëse fraksionet e peshës së gazeve i shënojmë me G 1, G 2, G 3, ..., G i; dhe masat e gazeve në përzierje - përmes m 1, m 2, m 3, ..., m i dhe masa e përgjithshme e përzierjes së gazit - përmes m, atëherë marrim˸
G 1 = G 2 = G 3 = … G n = (64)
G 1 + G 2 + G 3 + … + G n =1
m 1 + m 2 + m 3 + … + m n = m.
Për të shprehur përbërjen e një përzierjeje gazi në njësi vëllimore, është e nevojshme të sillni vëllimet e gazeve që përbëjnë përzierjen në të njëjtën presion dhe temperaturë. Vëllimi i një gazi individual të përfshirë në një përzierje të reduktuar në presionin e përzierjes quhet vëllim i reduktuar. Për të gjetur vëllimin e reduktuar të gazit në presionin e përzierjes së gazit Ptot dhe temperaturës T, është e nevojshme të përdoret ligji Boyle-Mariotte˸
p 1 V total = v 1 P total; p 2 V total = v 2 P total; p 3 V total = v 3 P total; ... ; p n V total = v n P total,
ku v 1, v 2, v 3, ..., v n janë vëllimet e reduktuara të gazeve individuale që përbëjnë përzierjen; р 1, р 2, р 3, …, р n – presionet e pjesshme të gazeve individuale;
v 1 = v 2 = v 3 = …; v n = (65)
Shuma e vëllimeve të reduktuara të gazeve individuale është e barabartë me vëllimin e përgjithshëm të përzierjes˸
v 1 + v 2 + v 3 + … + v n = V total.
Raporti i vëllimeve të reduktuara të gazeve individuale ndaj vëllimit të përgjithshëm të përzierjes quhet fraksion vëllimor dhe shprehet përmes r˸
r 1 = r 2 = r 3 = ...; r n = (66)
Për përzierjet e gazit, përbërja e shprehur me vëllim dhe fraksione mole është e njëjtë, d.m.th.
Përzierjet e gazit. Ligji i Daltonit - koncepti dhe llojet. Klasifikimi dhe veçoritë e kategorisë "Përzierjet e gazit. Ligji i Daltonit" 2015, 2017-2018.
Vlen të përmenden edhe dy ligje të tjera për gazin. Njëra prej tyre ka të bëjë me numrin e molekulave të gazeve të ndryshme në të njëjtat presione dhe temperatura, dhe tjetra ka të bëjë me përzierjen e gazrave.
Ligji i Avogadros
Në fillim të shekullit të 19-të. u vendos rregulli i raporteve të shumëfishta për gazrat që hyjnë në një reaksion kimik. Nëse temperaturat dhe presionet e gazeve që kombinohen me njëri-tjetrin janë të barabarta, atëherë vëllimet e tyre janë në raporte të thjeshta: 1:1, 1:2, 1:3, etj. Bazuar në këtë rregull, Avogadro në 1811 shprehu një deklaratë të guximshme për këtë. hipoteza e kohës: Vëllimet e barabarta të gazeve në të njëjtat temperatura dhe presione përmbajnë të njëjtin numër molekulash. Në një raport 1:1, molekulat e gazeve që reagojnë janë të lidhura në çifte. Nëse raporti i vëllimit është 1:2, atëherë secila molekulë e gazit të parë i bashkon vetes dy molekula të të dytit, etj.
Aktualisht, hamendësimi i Avogadro-s është vërtetuar rreptësisht dhe quhet ligji i Avogadro-s.
Sipas ligjit të Avogadros gazra të ndryshëm, të marrë në një sasi prej 1 mol, kanë të njëjtat vëllime në të njëjtat presioneR dhe temperaturatt , meqenëse numri i molekulave në to është i njëjtë. Në kushte normale, pra në një temperaturë prej 0 °C dhe një presion atmosferik prej 101,325 Pa, ky vëllim, siç tregojnë matjet, është i barabartë me
Vëllimi V M 0 quajtur molare.
Pse ndodh që në vëllime të barabarta gazesh në të njëjtat presione dhe temperatura gjendet gjithmonë i njëjti numër molekulash, pavarësisht se cili gaz merret? Kjo mund të shpjegohet vetëm duke përdorur energjinë kinetike molekulare (shih §4.5).
Ligji i Daltonit
Më shpesh ata nuk merren me gaz të pastër - oksigjen, hidrogjen, etj., Por me një përzierje gazesh. Ajri atmosferik, në veçanti, është një përzierje e azotit, oksigjenit dhe shumë gazrave të tjerë. Secili prej gazeve në përzierje jep "kontributin" e vet në presionin total në muret e enës. Presioni që do të kishte secili prej gazrave që përbëjnë përzierjen nëse gazrat e mbetur hiqen nga ena quhet presion i pjesshëm (d.m.th. privat).
Supozimi më i thjeshtë që mund të bëhet është se presioni i përzierjes së gazit R e barabartë me shumën e presioneve të pjesshme të të gjithave gazet p 1 , R 2 , R 3 ...:
 (3.8.2)
(3.8.2)
Kimisti anglez D. Dalton zbuloi se për gazet mjaft të rralluar ky është pikërisht rasti në realitet. Marrëdhënia (3.8.2) quhet ligji i Daltonit.
Nga pikëpamja e teorisë kinetike molekulare, ligji i Daltonit është i kënaqur sepse bashkëveprimi ndërmjet molekulave të një gazi ideal është i papërfillshëm. Prandaj, çdo gaz ushtron të njëjtin presion në murin e enës sikur të mos kishte gazra të tjerë.
Një mol i çdo gazi në kushte normale zë një vëllim 22,4 l. Kjo vlerë vëllimi u përcaktua eksperimentalisht. Në një përzierje gazesh, secili prej tyre ushtron presion në muret e enës, pavarësisht nga prania e gazrave të tjerë.
§ 3.9. Ekuacioni i gjendjes së gazit ideal
Gjendja e një mase të caktuar gazi karakterizohet nga tre parametra makroskopikë: presioni p, vëllimiVdhe temperatura T. Tani do të gjejmë lidhjen ndërmjet tyre.
Ekuacioni i gjendjes
Në § 3.5 dhe 3.6 jeni njohur me sjelljen e një gazi ideal në kushte të krijuara posaçërisht. Dy parametra nga tre (p, V ose V, T) ndryshuar në një vlerë konstante të së tretës (G ose R). Në mënyrë tipike, në natyrë dhe teknologji, gazi ndryshon të tre parametrat menjëherë. Për shembull, kur ajri i ngrohur në sipërfaqen e Tokës ngrihet, ai zgjerohet, presioni i tij ulet dhe temperatura ulet.
Duke përdorur ligjet e gazit (3.5.2) dhe (3.7.8), mund të marrim një ekuacion që lidh të tre parametrat fq, V Dhe T, që karakterizon gjendjen e një gazi të një mase të caktuar. Ky ekuacion quhet ekuacioni i gjendjes së gazit ideal.
Nëse një gaz përbëhet nga një përzierje e disa gazeve, atëherë ligji i Daltonit do të ndihmojë në llogaritjen e presionit të përzierjes.
Ku p v fq 2 , ръ - presione të pjesshme gazrat e përfshirë në përzierje.
Presion i pjesshëm Ata e quajnë presionin që do të kishte një gaz nëse i vetëm do të zinte të gjithë vëllimin e disponueshëm.
Teoria kinetike molekulare(MKT) u ngrit në shekullin e 19-të. dhe paraqiti strukturën e materies (kryesisht gazeve) nga këndvështrimi i tre dispozitave:
- të gjithë trupat përbëhen nga grimcat: atomet dhe molekulat;
- grimcat janë në lëvizje të vazhdueshme kaotike (termike);
- grimcat ndërveprojnë me njëra-tjetrën përmes përplasjeve krejtësisht elastike.
MCT është bërë një nga teoritë fizike më të suksesshme dhe është konfirmuar nga një numër faktesh eksperimentale. Një konfirmim i qartë eksperimental i lëvizjes termike kaotike të atomeve dhe molekulave ishte Lëvizja Browniane.
Lëvizja Browniane - ky fenomen u zbulua nga Robert Brown 1 në 1827. Duke vëzhguar përmes një mikroskopi lëvizjen e polenit të luleve të pezulluara në ujë, ai pa trajektore zigzag të çrregullta të grimcave.
Shkaku i lëvizjes Brownian është lëvizja termike e molekulave të mediumit, e cila shkaktohet nga luhatjet e presionit. Ndikimet e molekulave të mediumit e çojnë grimcën në lëvizje të rastësishme: shpejtësia e saj ndryshon shpejt në madhësi dhe drejtim. Një teori e plotë e lëvizjes Brownian u dha më vonë nga Albert Einstein dhe Marian Smoluchowski.
Ekuacioni bazë MKT. Presioni i një gazi në murin e një ene përcaktohet nga impulsi që molekulat e gazit i japin murit të enës kur përplasen me të. Sa më e madhe të jetë shpejtësia e molekulës, aq më i madh është impulsi që mbart, aq më i fortë vepron në mur, d.m.th. R ~ v. Përveç kësaj, aq më e madhe është masa e molekulës T, sa më i lartë të jetë impulsi, R ~ T. Sa më i lartë të jetë përqendrimi i molekulave P, aq më shpesh ndodhin përplasjet, prandaj, R ~ P. Duke supozuar se presioni shpërndahet në mënyrë të barabartë në të gjitha drejtimet në hapësirë (x, z/, z), në fund shkruajmë

Energjia kinetike e një molekule E = mv / 2. Duke lidhur dy ekuacionet e fundit me njëri-tjetrin, marrim

Ekuacioni i fundit quhet ekuacioni bazë i MKT. Ky ekuacion tregon se energjia mesatare kinetike e molekulave ideale të gazit (E) proporcionale me temperaturën e saj T. Vini re se ekuacioni është shkruar për një gaz ideal monatomik. Për një gaz poliatomik ai do të marrë formën

Ku une - numri i shkallëve të lirisë së një molekule tashmë të njohur për ju. Nga barazia

vijon se shpejtësia mesatare katrore e rrënjës molekulat e një gazi monatomik është e barabartë me

Shpërndarja Maxwell 1 është një shpërndarje probabiliteti, që shpesh gjendet në pjesë të barabarta të fizikës (dhe jo vetëm), dhe qëndron në themel të MCT. Shpërndarja Maxwell është gjithashtu e zbatueshme për proceset e transferimit elektronik, për të përshkruar vetitë e molekulave individuale në një gaz. Në mënyrë tipike, kjo shpërndarje i referohet shpërndarjes së energjive të molekulave në një gaz, por mund të zbatohet gjithashtu për shpërndarjen e shpejtësive, momentit dhe modulit të molekulave. Mund të shprehet gjithashtu si një shpërndarje diskrete mbi shumë nivele diskrete të energjisë ose si një shpërndarje e vazhdueshme mbi disa vazhdimësi të energjisë.
Ne do të kufizohemi në shqyrtimin e vetëm një aplikimi të shpërndarjes Maxwell - shpërndarjen e shpejtësisë së molekulave të gazit.
Matematikisht, funksioni i shpërndarjes Maxwell (Fig. 4.1) shkruhet si më poshtë:


Oriz. 4.1.
Le të shpjegojmë kuptimin matematikor të funksionit të shpërndarjes. Çdo funksion i shpërndarjes (përfshirë Maxwell's) tregon probabilitetin që një sasi e caktuar (në rastin tonë, shpejtësia e molekulave të gazit v) merr një vlerë të caktuar të caktuar. Funksioni i shpërndarjes së shpejtësisë Maxwell f(v) tregon probabilitetin që shpejtësia e një molekule të gazit është v.
Në Fig. 4.1 në kurbën e shpërndarjes së shpejtësisë, janë shënuar tre pika karakteristike: o - me shumë gjasa shpejtësia e molekulës (korrespondon me maksimumin, pasi ka probabilitetin më të lartë, prandaj emri), r> sr - Shpejtësia mesatare molekulat (probabiliteti i tij është pak më i vogël) dhe g; kv - katror mesatar shpejtësi (me më pak probabilitet).
Le të përcaktojmë shprehjet matematikore për të tre shpejtësitë. Për të gjetur shpejtësinë më të mundshme që korrespondon me vlerën maksimale /( v), duhet të llogaritet df/dv, vendoseni atë të barabartë me zero dhe zgjidhni për v

James Clerk Maxwell (1831 - 1879) - fizikan dhe matematikan britanik. Ai hodhi themelet e elektrodinamikës moderne klasike (ekuacionet e Maxwell), futi konceptet e rrymës zhvendosëse dhe fushës elektromagnetike në fizikë, parashikoi ekzistencën e valëve elektromagnetike, natyrën elektromagnetike të dritës, është një nga themeluesit e teorisë kinetike të gazeve dhe autori i parimit të fotografisë me ngjyra.
Formulimi i ligjeve
Ligji për presionin total të një përzierje gazesh
Ligji për tretshmërinë e përbërësve të përzierjes së gazit
Në një temperaturë konstante, tretshmëria në një lëng të caktuar e secilit prej përbërësve të përzierjes së gazit të vendosur mbi lëng është proporcionale me presionin e tyre të pjesshëm.
Kufijtë e zbatueshmërisë
Të dy ligjet e Daltonit janë rreptësisht të kënaqura për gazet ideale. Për gazet reale, këto ligje janë të zbatueshme me kusht që tretshmëria e tyre të jetë e ulët dhe sjellja e tyre të jetë afër asaj të një gazi ideal.
Historia e zbulimit
Ligji i shtimit të presioneve të pjesshme u formulua në 1801. Në të njëjtën kohë, arsyetimi i saktë teorik, bazuar në teorinë kinetike molekulare, u bë shumë më vonë.
Shënime
Fondacioni Wikimedia. 2010.
Shihni se çfarë janë "Ligjet e Daltonit" në fjalorë të tjerë:
LIGJET E DALTONIT- (Dalton Dalton): ligji i parë, presioni total i një përzierjeje gazesh ideale që nuk ndërveprojnë kimikisht me njëri-tjetrin është i barabartë me shumën e gazeve të pjesshme (shih) individuale që përbëjnë përzierjen, d.m.th., presionet që çdo gaz do të prodhonte në ... ... Enciklopedia e Madhe Politeknike
Ligjet e Daltonit- zbuluar nga fizikani dhe kimisti anglez J. Dalton (1766 1844) në 1801 dhe 1803. 1) presioni i një përzierjeje të gazeve ideale kimikisht jo bashkëvepruese është i barabartë me shumën e presioneve të pjesshme. Le të aplikojmë për gazet reale në temperatura dhe presione... ... Konceptet e shkencës moderne natyrore. Fjalor i termave bazë
Ligjet bazë të kimisë mund të ndahen në cilësore dhe sasiore. Përmbajtja 1 Ligjet cilësore 1.1 I. Ligji i fazës së Gibbs ... Wikipedia
LIGJET E DALTONIT- (më saktë Dalton, Dalton). 1. Ligji i raporteve të shumëfishta, i zbuluar nga D., është se elementët përfshihen në një kimikat. lidhjet në raporte që janë gjithmonë shumëfisha të disa numrave të thjeshtë. Pra, nëse kanë ujë, atëherë për një pjesë të peshës hidrogjen... ... Enciklopedia e Madhe Mjekësore
LIGJET E DALTONIT: 1) presioni i një përzierje gazesh që nuk ndërveprojnë kimikisht me njëri-tjetrin është i barabartë me shumën e presioneve të tyre të pjesshme 2) tretshmëria e një përbërësi të një përzierjeje gazi në një lëng të caktuar në një temperaturë konstante është; proporcionale me të pjesshmen...... Fjalori i madh enciklopedik
1) presioni i një përzierjeje të gazeve ideale kimikisht jo bashkëvepruese është i barabartë me shumën e presioneve të pjesshme. Përafërsisht i zbatueshëm për gazet reale në temperatura p dhe presione larg nga kritike. 2) Në konstante shkalla e tretshmërisë në një lëng të caktuar... ... Enciklopedi fizike
1) presioni i një përzierjeje të gazeve ideale kimikisht jo bashkëvepruese është i barabartë me shumën e presioneve të pjesshme. Përafërsisht i zbatueshëm për gazet reale në temperatura dhe presione larg nga kritike. 2) Në konstante Tretshmëria në temperaturë në një ... Enciklopedi fizike
LIGJET E DALTONIT: 1) presioni i një përzierje gazesh që nuk ndërveprojnë kimikisht me njëri-tjetrin është i barabartë me shumën e presioneve të tyre të pjesshme; 2) tretshmëria e një përbërësi të një përzierjeje gazi në një lëng të caktuar në një temperaturë konstante është në përpjesëtim me pjesshëm... ... fjalor enciklopedik
Përshkruani proceset që ndodhin në sistemet ekuilibër "tretësirë të lëngët-avull" nën ndikimin e temperaturës ose presionit. Përmbajtja 1 Ligji i parë i Konovalovit 2 Ligji i dytë i Konovalov ... Wikipedia
Ky artikull ose seksion ka nevojë për rishikim. Ju lutemi përmirësoni artikullin në përputhje me rregullat për shkrimin e artikujve. E gjithë ... Wikipedia
Përzierjet e gazit në të cilat përbërësit nuk ndërveprojnë me njëri-tjetrin mund të përshkruhen duke përdorur ligjin e Daltonit. Ai lidh presionet e pjesshme të përbërësve dhe fraksionet e tyre mole në një ekuacion. Le të hedhim një vështrim më të afërt në këtë ligj, dhe gjithashtu të tregojmë se si mund të përdoret duke përdorur shembuj specifikë.
Gazrat ideale
Ligji i Daltonit në fizikë rezulton të jetë i vlefshëm ekskluzivisht për gazet ideale. Këto janë gazra, grimcat përbërëse të të cilave (atomet, molekulat) nuk ndërveprojnë me njëra-tjetrën. Për një gaz ideal me një numër konstant të molekulave (atomeve) në të (n = konst), vlen një barazi që lidh tre parametra makroskopikë (presioni P, vëllimi V dhe temperatura T):
P*V = n*R*T, R = 8,314 J/(K*mol) është një vlerë konstante.
Të gjithë gazrat realë në presione të disa atmosferave dhe temperatura të rendit të temperaturës së dhomës dhe më lart mund të konsiderohen ideale me saktësi të mirë, domethënë barazia e mësipërme është e vlefshme për ta.
Presioni i pjesshëm i komponentit
Për të kuptuar thelbin e ligjit të Daltonit, është e nevojshme të kuptohet koncepti i "presionit të pjesshëm".
Meqenëse molekulat e gazrave të ndryshëm nuk e "ndiejnë" njëra-tjetrën, për çdo përbërës kimik i në përzierjen e gazit barazia do të jetë e vërtetë:
Presioni Pi quhet i pjesshëm për komponentin i-të. Me fjalë të tjera, presioni i pjesshëm është presioni që vetëm komponenti i-të krijon në muret e enës. Quhet i pjesshëm sepse është pjesë e presionit total, ose pjesës së tij.
Deklarata e ligjit të Daltonit

Në vitet e para të shekullit të 19-të, ndërsa studionte sjelljen e përzierjeve të ndryshme të gazit, shkencëtari britanik John Dalton konstatoi faktin e mëposhtëm: nëse përmbledhni të gjitha presionet e pjesshme të përbërësve të një përzierjeje gazi, ju merrni një presion total që mund të matet me një barometër, matës presioni ose pajisje tjetër të krijuar për këtë. Ky është ligji i Daltonit. Le ta shkruajmë në formën e një barazie matematikore:
Ju mund ta kuptoni pse kjo barazi është e vërtetë nëse mbani mend se përbërësit e përzierjes krijojnë presion në mënyrë të pavarur nga njëri-tjetri.
Duke marrë parasysh që presioni i pjesshëm Pi është drejtpërdrejt proporcional me sasinë e substancës ni komponenti i, e cila është gjithmonë e vërtetë kur T = konst dhe V = konst, atëherë vijmë në një barazi tjetër:
Sasia xi quhet fraksion mol. Ajo lidhet me përqindjet atomike ai të komponentit me një lidhje të thjeshtë:
Një shprehje që lejon dikë të përcaktojë fraksionin mol të një komponenti përmes presionit të tij të pjesshëm dhe anasjelltas quhet gjithashtu ligji i Daltonit.

Nuk duhet harruar se ligji i konsideruar vlen jo vetëm në rastin e gazeve ideale, por edhe në mungesë të reaksioneve kimike në to. Këto të fundit çojnë në ndryshime në përbërjen përbërëse dhe molare, gjë që shkel ligjin për presionin e përzierjes së gazit.
Shembuj të zgjidhjes së problemeve
Në këtë paragraf, ne do të shqyrtojmë shembuj të zbatimit të ligjit të Daltonit për zgjidhjen e problemeve praktike.
Detyra 1. Është e nevojshme të përcaktohet presioni i pjesshëm i tre komponentëve kryesorë në ajrin e thatë.
Nga literatura, mund të zbuloni se meqenëse ajri është i thatë, përbërësit kryesorë të tij do të jenë azoti (rreth 78%), oksigjeni (rreth 21%) dhe gazi fisnik argon (rreth 1%). Duke marrë parasysh që presioni total i ajrit në nivelin e detit është 1 atmosferë, dhe duke konvertuar përqindjet atomike në fraksione mole, marrim presionet e pjesshme për secilin përbërës:
Pi = Ptot*xiPN2 = 1 *0.78 = 0.78 atm.PO2 = 1*0.21 = 0.21 atm.PAR = 1*0.01 = 0.01 atm.
Problemi 2. Ka dy cilindra me gazra të pastër. Cilindri i parë përmban azot me temperaturë 300 K, vëllim 10 litra dhe presion 2 atmosfera. Cilindri i dytë përmban oksigjen me një temperaturë prej 300 K, por me një vëllim prej 15 litrash dhe një presion prej 1.5 atmosferash. Të dy cilindrat ishin të lidhur me njëri-tjetrin. Është e nevojshme të llogaritet presioni i pjesshëm i secilit komponent në përzierjen që rezulton.

Le të fillojmë ta zgjidhim këtë problem duke llogaritur sasinë e substancës për azotin dhe oksigjenin. Duke përdorur ekuacionin ideal të gazit, marrim:
PN2*VN2 = nN2*R*T =>nN2 = PN2*VN2/R*T = 2*101325*10-2/(8.314*300) = 0.812 mol nO2 = PO2*VO2/R*T = 1, 5*101325*1.5*10-2/(8.314*300) = 0.914 mol.
Kur lidhen dy cilindra, gazrat përzihen në mënyrë që secili komponent të zërë të gjithë vëllimin e dy cilindrave. Presioni total që do të jetë në sistem mund të llogaritet duke përdorur edhe ekuacionin e gjendjes së një gazi ideal:
Vtot = VN2+VO2 = 2,5*10-2 m3 n = nN2+nO2 = 0,812+0,914 = 1,726 mol = n*R*T/Vtot = 1,726*8,314*300/(2,5)*. 172199.568 Pa ose 1.7 atm.
Tani mund të aplikoni formulat e ligjit të Daltonit për të llogaritur presionet e pjesshme të oksigjenit dhe azotit:
PN2 = Ptot*nN2/n = 1,7*0,812/1,726 = 0,8 atm = Ptot - PN2 = 1,7 - 0,8 = 0,9 atm;
Raporti i presioneve të pjesshme rezultuese të gazeve është i barabartë me raportin e sasive të substancës për to.