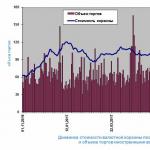
Dado que los óxidos de d-metales son insolubles en agua, sus hidróxidos se obtienen indirectamente a través de reacciones de intercambio entre sus sales y soluciones alcalinas:
ZnCl 2 + 2NaOH \u003d Zn (OH) 2 + 2NaCl;
MnCl 2 + 2NaOH = Mn(OH) 2 + 2NaCl (en ausencia de oxígeno);
FeSO 4 + 2KOH \u003d Fe (OH) 2 + K 2 SO 4 (en ausencia de oxígeno).
Los hidróxidos de elementos d en los estados de oxidación más bajos son bases débiles; Son insolubles en agua, pero solubles en ácidos:
Cu(OH)2 + 2HCl = CuCl2 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + H2O
Los hidróxidos de elementos D en estados de oxidación intermedios y el hidróxido de zinc se disuelven no solo en ácidos, sino también en soluciones alcalinas en exceso con la formación de complejos hidroxo (es decir, exhiben propiedades anfóteras), por ejemplo:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
Zn (OH) 2 + 2NaOH \u003d Na 2;
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O;
Cr(OH)3 + 3KOH = K3.
En estados de oxidación más altos, los metales de transición forman hidróxidos que exhiben propiedades ácidas o propiedades anfóteras con predominio de ácido:
Con un aumento en el grado de oxidación del elemento, las propiedades básicas de los óxidos e hidróxidos se debilitan y aumentan las propiedades ácidas.
Por lo tanto, a lo largo del período de izquierda a derecha, hay un aumento en las propiedades ácidas de los hidróxidos de d-metal en estados de oxidación superiores al subgrupo Mn, luego las propiedades ácidas se debilitan:
Sc(OH) 3 - TiO 2 xH 2 O - V 2 O 5 xH 2 O - H 2 CrO 4 - HMnO 4
Fortalecimiento de las propiedades ácidas
Fe(OH) 3 - Co(OH) 2 - Cu(OH) 2 - Zn(OH) 2
Debilitamiento lento de las propiedades ácidas
Considere el cambio en las propiedades de los hidróxidos de d-metal en subgrupos. De arriba a abajo en el subgrupo, aumentan las propiedades básicas de los hidróxidos de elementos d en estados de oxidación más altos, disminuyen las propiedades ácidas. Por ejemplo, para el sexto grupo de d-metales:
H 2 CrO 4 - bruscamente - MoO 3 H 2 O - débilmente - WO 3 H 2 O
Las propiedades ácidas disminuyen
Propiedades redox de compuestos de elementos d
Conexiones de d - elementos en estados de oxidación más bajos muestran principalmente, propiedades reductoras, especialmente en un ambiente alcalino. Así, por ejemplo, los hidróxidos Mn(+2), Cr(+2), Fe(+2) son muy inestables y se oxidan rápidamente por el oxígeno atmosférico:
2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4;
4Cr(OH)2 + O2 + 2H2O = 4Cr(OH)3
Para convertir el hidróxido de cobalto (II) o níquel (II) en Co (OH) 3 o Ni (OH) 3, es necesario usar un agente oxidante más fuerte, por ejemplo, peróxido de hidrógeno H 2 O 2 en un medio alcalino. o bromo Br 2:
2Co(OH)2 + H2O2 = 2Co(OH)3;
2 Ni(OH) 2 + Br 2 +2NaOH = 2 Ni(OH) 3 + 2NaBr
Los derivados de Ti(III), V(III), V(II), Cr(II) se oxidan fácilmente en el aire, algunas sales se pueden oxidar incluso con agua:
2Ti 2 (SO 4) 3 + O 2 + 2H 2 O \u003d 4TiOSO 4 + 2H 2 SO 4;
2CrCl 2 + 2H 2 O \u003d 2Cr (OH) Cl 2 + H 2
Compuestos de elementos d en estados de oxidación superiores (de +4 a +7) normalmente exhibir propiedades oxidantes. Sin embargo, los compuestos de Ti (IV) y V (V) son siempre estables y, por lo tanto, tienen propiedades oxidantes relativamente débiles:
TiOSO4 + Zn + H2SO4 = Ti2 (SO4)3 + ZnSO4 + H2O;
Na 3 VO 4 + Zn + H 2 SO 4 = VOSO 4 + ZnSO 4 + H 2 O
La recuperación tiene lugar en condiciones duras, con hidrógeno atómico en el momento de su liberación (Zn + 2H + = 2H+ + Zn 2+).
Y los compuestos de cromo en estados de oxidación más altos son agentes oxidantes fuertes, especialmente en un ambiente ácido:
K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O;
2CrO 3 + C 2 H 5 OH \u003d Cr 2 O 3 + CH 3 COH + H 2 O
Los compuestos de Mn(VI), Mn(VII) y Fe(VI) exhiben propiedades oxidantes aún más fuertes:
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH;
4K 2 FeO 4 + 10H 2 SO 4 \u003d 2Fe 2 (SO 4) 3 + 3O 2 + 10H 2 O + 4K 2 SO 4
De este modo, las propiedades oxidantes de los compuestos de elementos d en estados de oxidación más altos aumentan de izquierda a derecha a lo largo del período.
La capacidad oxidante de los compuestos de elementos d en estados de oxidación más altos en un subgrupo de arriba a abajo se debilita. Por ejemplo, en el subgrupo de cromo: el dicromato de potasio K 2 Cr 2 O 7 interactúa incluso con un agente reductor tan débil como el SO 2. Para restaurar los iones de molibdato o tungstato, se necesita un agente reductor muy fuerte, por ejemplo, una solución de ácido clorhídrico de cloruro de estaño (II):
K 2 Cr 2 O 7 + SO 2 + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO 4 + H 2 O
3 (NH 4) 2 MoO 4 + НSnCl 3 + 9HCl = MoO 3 MoO 5 + H 2 SnCl 6 + 4H 2 O + 6NH 4 Cl
La última reacción ocurre cuando se calienta y el estado de oxidación del elemento d disminuye muy levemente.
Los compuestos de metales d en un estado de oxidación intermedio tienen dualidad redox. Por ejemplo, los compuestos de hierro (III), dependiendo de la naturaleza de la sustancia asociada, pueden exhibir las propiedades de un agente reductor:
2FeCl3 + Br2 + 16KOH = 2K2FeO4 + 6KBr + 6KCl + 8H2O,
y propiedades oxidantes:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
2NaOH + CO 2 \u003d Na 2 CO 3 + H 2 O,
sal ácida básica
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O,
sal ácida básica
2NaOH + PbO \u003d Na 2 PbO 2 + H 2 O,
sal anfótera base
2NaOH + Pb(OH) 2 = Na 2 PbO 2 + 2H 2 O,
sal anfótera base
hidróxido
2H 3 PO 4 + 3Na 2 O \u003d 2Na 3 PO 4 + 3H 2 O,
sal base ácida
H 2 SO 4 + SnO \u003d SnSO 4 + H 2 O,
sal anfótera ácida
H 2 SO 4 + Sn (OH) 2 \u003d SnSO 4 + 2H 2 O.
sal anfótera ácida
hidróxido
Los hidróxidos anfóteros en reacciones con ácidos exhiben las principales propiedades:
2Al (OH) 3 + 3H 2 SO 4 \u003d Al 2 (SO 4) 3 + 6H 2 O,
con álcalis (bases) - propiedades ácidas:
H 3 AlO 3 + 3NaOH \u003d Na 3 AlO 3 + 3H 2 O,
o H 3 AlO 3 + NaOH = NaAlO 2 + 2H 2 O.
Las bases y los ácidos reaccionan con las sales si el resultado es un precipitado o un electrolito débil. Ácidos débiles: H 3 PO 4, H 2 CO 3, H 2 SO 3, H 2 SiO 3 y otros.
2NaOH + NiSO 4 \u003d Ni (OH) 2 + Na 2 SO 4,
base de sal
3H2SO4 + 2Na3PO4 = 2H3PO4 + 3Na2SO4
sal ácida
Los ácidos anóxicos entran en las mismas reacciones que los ácidos que contienen oxígeno considerados anteriormente.
Ejemplo. Hacer fórmulas de hidróxidos correspondientes a óxidos: a) FeO; b) N2O3; c) Cr2O3. Nombra las conexiones.
Solución
a) FeO es el óxido básico, por tanto, el hidróxido correspondiente es la base, en la fórmula base el número de grupos hidroxi (OH) es igual al estado de oxidación del átomo metálico; la fórmula del hidróxido de hierro (II) es Fe (OH) 2.
b) N 2 O 3 es un óxido ácido, por lo tanto, el hidróxido correspondiente es un ácido. La fórmula de un ácido se puede obtener a partir de la representación del ácido como hidrato del óxido correspondiente:
N2O3. H 2 O \u003d (H 2 N 2 O 4) \u003d 2HNO 2 - ácido nitroso.
c) Cr 2 O 3 es un óxido anfótero, por lo tanto, el hidróxido correspondiente es anfótero. Los hidróxidos anfóteros se escriben en forma de bases - Cr (OH) 3 - hidróxido de cromo (III).
sal
sal- sustancias que consisten en residuos básicos y ácidos. Por lo tanto, la sal CuSO 4 consiste en el residuo principal, el catión metálico Cu 2+ y el residuo ácido, SO 4 2 .
De acuerdo con la nomenclatura tradicional, los nombres de las sales de los ácidos de oxígeno son los siguientes: la terminación se agrega a la raíz del nombre latino del átomo central del residuo ácido: a(en estados de oxidación más altos del átomo central) o - eso(para un estado de oxidación más bajo) y luego - el resto de la base en caso genitivo, por ejemplo: Na 3 PO 4 - fosfato de sodio, BaSO 4 - sulfato de bario, BaSO 3 - sulfito de bario. Los nombres de sales de ácidos libres de oxígeno se forman agregando el sufijo a la raíz del nombre latino del no metal: identificación y el nombre ruso del metal (residuo de la base), por ejemplo CaS - sulfuro de calcio.
Sales medianas no contiene en su composición, iones de hidrógeno y grupos hidroxo susceptibles de ser sustituidos por metales, por ejemplo CuCl 2 , Na 2 CO 3 y otros.
Propiedades químicas de las sales.
Las sales medianas entran en reacciones de intercambio con álcalis, ácidos, sales. Véase más arriba para ejemplos de reacciones relevantes.
Sales de ácido contener como parte del residuo ácido, un ion hidrógeno, por ejemplo NaHCO 3, CaHPO 4, NaH 2 PO 4, etc. En el nombre de una sal ácida, el ion hidrógeno se denota con el prefijo hidro-, antes de lo cual indicar el número de átomos de hidrógeno en la molécula de sal, si es mayor a uno. Por ejemplo, los nombres de las sales de la composición anterior, respectivamente, son bicarbonato de sodio, hidrogenofosfato de calcio, dihidrogenofosfato de sodio.
Las sales de ácido son
la interacción de la base y ácido polibásico con un exceso de ácido:
Ca(OH)2 + H3PO4 = CaHPO4 + 2H2O;
la interacción de la sal promedio de un ácido polibásico y el ácido correspondiente o un ácido más fuerte tomado en deficiencia:
CaCO 3 + H 2 CO 3 \u003d Ca (HCO 3) 2,
Na 3 PO 4 + HCl = Na 2 HPO 4 + NaCl.
Sales básicas contener como parte del resto de la base, un grupo hidroxo, por ejemplo CuOHNO 3, Fe (OH) 2 Cl. En el nombre de la sal básica, el grupo hidroxo se denota con el prefijo hidroxo-, por ejemplo, los nombres de las sales anteriores, respectivamente: hidroxonitrato de cobre (II), dihidroxocloruro de hierro (III).
Las sales básicas son
la interacción de un poliácido (que contiene más de un grupo hidroxo en su composición) base y ácido con un exceso de base:
Cu(OH)2 + HNO3 = CuOHNO3 + H2O;
la interacción de una sal formada por una base poliácida y una base tomada en deficiencia:
FeCl 3 + NaOH = FeOHCl 2 + NaCl,
FeCl 3 + 2NaOH \u003d Fe (OH) 2 Cl + 2NaCl.
Las sales ácidas y básicas tienen todas las propiedades de las sales. En reacciones con álcalis, sales ácidas y con ácidos, las sales básicas se convierten en sales medianas.
Na 2 HPO 4 + NaOH = Na 3 PO 4 + H 2 O,
Na 2 HPO 4 + 2HCl \u003d H 3 PO 4 + 2NaCl,
FeOHCl 2 + HCl \u003d FeCl 3 + H 2 O,
FeOHCl 2 + 2NaOH \u003d Fe (OH) 3 + 2NaCl.
Ejemplo 1. Haz fórmulas para todas las sales que se pueden formar con la base Mg (OH) 2 y el ácido H 2 SO 4.
Solución
Las fórmulas de sal están compuestas por posibles residuos básicos y ácidos, observando la regla de la neutralidad eléctrica. Los posibles residuos básicos son Mg 2+ y MgOH +, los residuos ácidos son SO 4 2- y HSO 4 -. Las cargas de los residuos básicos y ácidos complejos son iguales a la suma de los estados de oxidación de sus átomos constituyentes. Al combinar residuos básicos y ácidos, elaboramos las fórmulas de posibles sales: MgSO 4 - sal promedio - sulfato de magnesio; Mg (HSO 4) 2 - sal ácida - hidrosulfato de magnesio; (MgOH) 2 SO 4 - la sal principal es hidroxosulfato de magnesio.
Ejemplo 2 Escriba las reacciones de formación de sales durante la interacción de los óxidos.
a) PbO y N 2 O 5; b) PbO y Na2O.
Solución
En las reacciones entre óxidos se forman sales cuyos residuos principales se forman a partir de óxidos básicos, los residuos ácidos a partir de óxidos ácidos.
a) En la reacción con el óxido ácido N 2 O 5, el óxido anfótero PbO exhibe las propiedades del óxido básico, por lo tanto, el residuo principal de la sal resultante es Pb 2+ (la carga del catión plomo es igual a la estado de oxidación del plomo en el óxido), el residuo ácido es NO 3 (residuo ácido correspondiente a un óxido de ácido nítrico ácido dado). Ecuación de reacción
PbO + N 2 O 5 \u003d Pb (NO 3) 2.
b) En la reacción con el óxido básico Na 2 O, el óxido anfótero PbO exhibe las propiedades de un óxido ácido, el residuo ácido de la sal resultante (PbO 2 2 ) se encuentra a partir de la forma ácida del correspondiente hidróxido anfótero Pb (OH) 2 \u003d H 2 PbO 2. Ecuación de reacción
El potasio, el sodio o el litio pueden interactuar con el agua. En este caso, los compuestos relacionados con los hidróxidos se encuentran en los productos de reacción. Las propiedades de estas sustancias, las características del curso de los procesos químicos en los que están involucradas las bases, se deben a la presencia de un grupo hidroxilo en sus moléculas. Entonces, en las reacciones de disociación electrolítica, las bases se dividen en iones metálicos y aniones OH -. Cómo las bases interactúan con los óxidos, ácidos y sales no metálicos, lo consideraremos en nuestro artículo.
Nomenclatura y estructura de la molécula.
Para nombrar correctamente la base, debe agregar la palabra hidróxido al nombre del elemento metálico. Pongamos ejemplos concretos. La base de aluminio pertenece a los hidróxidos anfóteros, cuyas propiedades consideraremos en el artículo. La presencia obligatoria en las moléculas base de un grupo hidroxilo asociado al catión metálico por un tipo de enlace iónico puede determinarse utilizando indicadores, por ejemplo, fenolftaleína. En un medio acuoso, un exceso de iones OH - se determina por un cambio en el color de la solución indicadora: la fenolftaleína incolora se vuelve carmesí. Si un metal exhibe múltiples valencias, puede formar múltiples bases. Por ejemplo, el hierro tiene dos bases, en las que es igual a 2 o 3. El primer compuesto se caracteriza por los signos del segundo: anfótero. Por tanto, las propiedades de los hidróxidos superiores difieren de las de los compuestos en los que el metal tiene un grado de valencia inferior.

Característica física
Las bases son sólidos resistentes al calor. En relación al agua, se dividen en solubles (alcalinos) e insolubles. El primer grupo está formado por metales químicamente activos, elementos del primer y segundo grupo. Las sustancias insolubles en agua están compuestas por átomos de otros metales, cuya actividad es inferior a la del sodio, potasio o calcio. Ejemplos de tales compuestos son bases de hierro o cobre. Las propiedades de los hidróxidos dependerán del grupo de sustancias al que pertenezcan. Entonces, los álcalis son térmicamente estables y no se descomponen cuando se calientan, mientras que las bases insolubles en agua se destruyen bajo la acción de altas temperaturas, formando óxido y agua. Por ejemplo, una base de cobre se descompone de la siguiente manera:
Cu(OH) 2 \u003d CuO + H 2 O

Propiedades químicas de los hidróxidos
La interacción entre los dos grupos más importantes de compuestos, ácidos y bases, se denomina en química reacción de neutralización. Este nombre puede explicarse por el hecho de que los hidróxidos y ácidos químicamente agresivos forman productos neutros: sales y agua. Siendo, de hecho, un proceso de intercambio entre dos sustancias complejas, la neutralización es característica tanto de los álcalis como de las bases insolubles en agua. Aquí está la ecuación para la reacción de neutralización entre la potasa cáustica y el ácido clorhídrico:
KOH + HCl \u003d KCl + H2O
Una propiedad importante de las bases de metales alcalinos es su capacidad para reaccionar con óxidos ácidos, dando como resultado sal y agua. Por ejemplo, al pasar dióxido de carbono a través de hidróxido de sodio, puede obtener su carbonato y agua:
2NaOH + CO 2 \u003d Na 2 CO 3 + H 2 O
Las reacciones de intercambio iónico incluyen la interacción entre los álcalis y las sales, lo que conduce a la formación de hidróxidos o sales insolubles. Entonces, al verter la solución gota a gota en una solución de sulfato de cobre, puede obtener un precipitado azul gelatinoso. Es una base de cobre, insoluble en agua:
CuSO 4 + 2NaOH \u003d Cu (OH) 2 + Na 2 SO 4
Las propiedades químicas de los hidróxidos, insolubles en agua, difieren de los álcalis en que pierden agua con un ligero calentamiento: se deshidratan y se convierten en la forma del óxido básico correspondiente.
Bases que exhiben propiedades duales
Si un elemento puede reaccionar tanto con ácidos como con álcalis, se le llama anfótero. Estos incluyen, por ejemplo, zinc, aluminio y sus bases. Las propiedades de los hidróxidos anfóteros permiten escribir sus fórmulas moleculares tanto aislando el grupo hidroxo como en forma de ácidos. Presentemos varias ecuaciones para las reacciones de una base de aluminio con ácido clorhídrico e hidróxido de sodio. Ilustran las propiedades especiales de los hidróxidos anfóteros. La segunda reacción tiene lugar con la descomposición del álcali:
2Al(OH)3 + 6HCl = 2AlCl3 + 3H2O
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O
Los productos de los procesos serán agua y sales: cloruro de aluminio y aluminato de sodio. Todas las bases anfóteras son insolubles en agua. Se obtienen como resultado de la interacción de las correspondientes sales y álcalis.
Métodos de obtención y aplicación.
En la industria que requiere grandes volúmenes de álcalis, se obtienen por electrólisis de sales que contienen cationes de metales activos del primer y segundo grupo del sistema periódico. La materia prima para la extracción, por ejemplo, sodio cáustico, es una solución de sal común. La ecuación de reacción será:
2NaCl + 2H 2 O \u003d 2NaOH + H 2 + Cl 2
Las bases de los metales de baja actividad en el laboratorio se obtienen por la interacción de los álcalis con sus sales. La reacción pertenece al tipo de intercambio iónico y termina con la precipitación de la base. Una forma sencilla de obtener álcalis es una reacción de sustitución entre el metal activo y el agua. Se acompaña de calentamiento de la mezcla reaccionante y pertenece al tipo exotérmico.

Las propiedades de los hidróxidos se aprovechan en la industria. Los álcalis juegan aquí un papel especial. Se utilizan como limpiadores para queroseno y gasolina, para la producción de jabón, procesamiento de cuero natural, así como en tecnologías para la producción de rayón y papel.
DEFINICIÓN
Hidróxidos Se denominan sustancias complejas, a las que incluyen átomos metálicos conectados a uno o más grupos hidroxi.
La mayoría de las bases son sólidos con solubilidad variable en agua. El hidróxido de cobre (II) es azul (Fig. 1), el hidróxido de hierro (III) es marrón, la mayoría de los demás son blancos.
Arroz. 1. Hidróxido de cobre (II). Apariencia.
Obtención de hidróxidos
Las bases solubles (álcalis) en el laboratorio se pueden obtener mediante la interacción de metales activos y sus óxidos con agua:
CaO + H 2 O \u003d Ca (OH) 2.
Los álcalis hidróxido de sodio e hidróxido de calcio se obtienen por electrólisis de soluciones acuosas de cloruro de sodio y cloruro de potasio.
Las bases insolubles en agua se obtienen por reacción de sales con álcalis en soluciones acuosas:
FeCl 3 + 3NaOH aq \u003d Fe (OH) 3 ↓ + 3NaCl.
Propiedades químicas de los hidróxidos
Las bases solubles e insolubles tienen una propiedad común: reaccionan con los ácidos para formar sales y agua (reacción de neutralización):
NaOH + HCl \u003d NaCl + H2O;
Cu(OH)2 + 2HCl = CuCl2 + H2O.
Las soluciones alcalinas cambian el color de algunas sustancias: tornasol, fenolftaleína y naranja de metilo, llamados indicadores (Tabla 1).
Tabla 1. Cambio de color de los indicadores bajo la influencia de soluciones de ácidos y bases.
Además de las propiedades generales, los álcalis y las bases insolubles en agua también tienen propiedades específicas. Por ejemplo, cuando se calienta un precipitado azul de hidróxido de cobre (II), se forma una sustancia negra, esto es óxido de cobre (II):
Cu (OH) 2 \u003d CuO + H 2 O.
Los álcalis, a diferencia de las bases insolubles, por lo general no se descomponen cuando se calientan. Sus soluciones actúan sobre indicadores, corroen sustancias orgánicas, reaccionan con soluciones salinas (si contienen un metal capaz de formar una base insoluble) y óxidos ácidos:
Fe 2 (SO 4) 3 + 6KOH \u003d 2Fe (OH) 3 ↓ + 3K 2 SO 4;
2KOH + CO 2 \u003d K 2 CO 3 + H 2 O.
Aplicación de hidróxidos
Los hidróxidos se utilizan ampliamente en la industria y en la vida cotidiana. Por ejemplo, el hidróxido de calcio es de gran importancia. Es un polvo suelto blanco. Cuando se mezcla con agua, se forma la llamada leche de cal. Dado que el hidróxido de calcio es ligeramente soluble en agua, después de filtrar la lechada de cal, se obtiene una solución clara: agua de cal, que se vuelve turbia cuando pasa dióxido de carbono a través de ella. La cal apagada se usa para preparar la mezcla de Burdeos, un medio para combatir enfermedades y plagas de las plantas. La leche de lima se usa ampliamente en la industria química, por ejemplo, en la producción de azúcar, refrescos y otras sustancias.
El hidróxido de sodio se utiliza para la refinación de petróleo, la producción de jabón y en la industria textil. El hidróxido de potasio y el hidróxido de litio se utilizan en las baterías.
Ejemplos de resolución de problemas
EJEMPLO 1
| Ejercicio | En uno de los hidróxidos de estaño, la fracción de masa de elementos es igual a: estaño - 63,6%; oxígeno - 34,2%; hidrógeno - 2,2%. Determine la fórmula de este hidróxido. |
| Solución | La fracción de masa del elemento X en la molécula de la composición HX se calcula mediante la siguiente fórmula: ω (X) = n × Ar (X) / M (HX) × 100%. Denotemos el número de moles de elementos que componen el compuesto por "x" (estaño), "y" (oxígeno) y "z" (hidrógeno). Entonces, la relación molar se verá así (los valores de masas atómicas relativas tomados de la Tabla Periódica de D.I. Mendeleev se redondearán a números enteros): x:y:z = ω(Sn)/Ar(Sn) : ω(O)/Ar(O) : ω(H)/Ar(H); x:y:z = 63,6/119: 34,2/16: 2,1/1; x:y:z = 0,53: 2,14: 2,1 = 1: 4: 4. Entonces, la fórmula del hidróxido de estaño es Sn(OH) 4 . |
| Responder | La fórmula del hidróxido de estaño es Sn(OH) 4 |
EJEMPLO 2
| Ejercicio | Determine la fracción de masa de hidróxido de bario en una solución obtenida mezclando agua con una masa de 50 g y óxido de bario con una masa de 1,2 g. |
| Solución | La fracción de masa de la sustancia X en solución se calcula mediante la siguiente fórmula: ω (X) = m(X) / m solución × 100%. La masa de la disolución es la suma de las masas del soluto y del disolvente: solución m = m(H 2 O) + m(BaO) = 50 + 1,2 = 51,2 g. Escribimos la ecuación de reacción para obtener hidróxido de bario: BaO + H 2 O \u003d Ba (OH) 2. Calcular el número de moles de sustancias de partida: n(H2O) = m(H2O) / M(H2O); M(H2O) = 18 g/mol; n(H2O) \u003d 50/18 \u003d 2,8 mol. n(BaO) = m(BaO) / M(BaO); M(BaO) = 153 g/mol; n(BaO) \u003d 1.2 / 153 \u003d 0.008 mol. El cálculo se realiza para un compuesto que escasea (óxido de bario). Según la ecuación n(BaO) :n(Ba(OH)2) = 1:1, es decir n (Ba (OH) 2) \u003d n (BaO) \u003d 1,04 mol. Entonces la masa de hidróxido de bario formada será igual a: m (Ba (OH) 2) \u003d n (Ba (OH) 2) × M (Ba (OH) 2); M (Ba (OH) 2) \u003d 171 g / mol; m (Ba (OH) 2) \u003d 0.008 × 171 \u003d 1.368 g. Encuentre la fracción de masa de hidróxido de bario en solución: ω (Ba (OH) 2) \u003d 1.368 / 51.2 × 100% \u003d 2.67%. |
| Responder | La fracción de masa de hidróxido de bario es 2,67% |
óxidos - Son sustancias complejas formadas por algún elemento y oxígeno con un estado de oxidación -2.
Por ejemplo: K2O, CaO, Fe2O3, CO2, P2O5, SO3, Cl2O7, OsO4. Los óxidos forman todos los elementos químicos, excepto He, Ne, Ar. El enlace químico entre el oxígeno y otro elemento es iónico o covalente. Según sus propiedades químicas, los óxidos se dividen en formadores de sal y no formadores de sal. Estos últimos incluyen, por ejemplo, N2O, NO, NO2, SiO, SO.
Los óxidos formadores de sal se dividen en básicos, ácidos y anfóteros.
Óxidos básicos. Los óxidos cuyos hidratos son bases se denominan óxidos básicos. Por ejemplo, Na2O, CuO son óxidos básicos, ya que corresponden a las bases NaOH, Cu(OH)2. Por regla general, los óxidos básicos pueden ser óxidos de metales con un estado de oxidación de +1, +2. El enlace químico aquí es iónico.
Los óxidos de metales alcalinos (Li, Na, K, Rb, Cs, Fr) y alcalinotérreos (Ca, Sr, Ba, Ra), al interactuar con el agua, dan bases. Por ejemplo:
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
Los óxidos básicos restantes prácticamente no interactúan con el agua. Los óxidos básicos reaccionan con los ácidos y dan sal y agua:
Fe 2 O 3 + 3H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3H2O
Fe 2 O 3 + 6H + = 2Fe 3 + + 3H2O
Los óxidos básicos reaccionan con los óxidos ácidos y dan sales:
FeO + SiO 2 \u003d FeSiO 3 (t)
Óxidos ácidos. Los óxidos cuyos hidratos son ácidos se llaman ácidos. Los óxidos ácidos incluyen óxidos metálicos y no metálicos con un estado de oxidación de +4, +5, +6, +7. Por ejemplo, N 2 O 3, P 2 O 5 , Cro 3 , Mn 2 O 7, CO 2, V 2 O 5, SO 3, Cl 2 O 7 - óxidos de ácido, ya que los ácidos corresponden a HNO 2, H 3 PO 4, H 2 CrO 4, HMnO 4, etc. (el enlace químico aquí es covalente e iónico). La mayoría de los óxidos ácidos reaccionan con el agua y forman ácidos. Por ejemplo:
SO3 + H2O = H2SO4
Мn2O7 + H2O = 2HMnO4
SiO2 + H2O ≠
Los óxidos de ácido reaccionan con bases (álcalis) y dan sal y agua:
N 2 O 5 + Ca (OH) 2 \u003d Ca (NO 3) 2 + H 2 O
N 2 O 5 + 2OH‾ = 2NO 3 ‾ + H 2 O
Óxidos anfóteros. Los óxidos metálicos con un estado de oxidación de +3, +4 ya veces +2 que, según el medio, presentan propiedades básicas o ácidas, es decir, reaccionan con ácidos y bases, se denominan anfóteros. Corresponden a hidratos, ácidos y bases. Por ejemplo:
Zn(OH)2 ← ZnO → H2ZnO2
H2O Al(OH) 3 ← Al 2 O 3 → H 3 AlO 3 → HalO 2
Los óxidos anfóteros reaccionan con ácidos y bases:
Al2Oz + 3H2SO4 = Al2 (SO4)3 + 3H2O
Al2Oz + 6H + = 2Al3+ + 3H2O
Al2Oz + 2NaOH + 3H2O = 2Na
Al2Oz + 2OH‾ + 3H2O = 2[Al(OH)4]‾
Cuando Al2O3 se fusiona con álcalis, se forman metaaluminatos:
fusión de Al2O3 + 2NaOH → 2NaAlO2 + H2O
metaaluminato de sodio
Al2Oz + 2OH‾ = 2Al O2‾ + H2O
Los óxidos anfóteros no se combinan directamente con el agua.
Hidróxidos
Compuestos químicos con fórmula generalR(Vaya) nortellamados hidróxidos, dondeR - átomo o grupo de átomos con carga positiva.
Según el tipo de disociación electrolítica, los hidróxidos se dividen en tres grupos: bases, ácidos e hidróxidos anfóteros. Por ejemplo:
Ba(OH)2 ↔ Ba2 + + 2OH‾ base
H2SO4 ↔ 2H + + SO2 2 ‾ ácido
Pb 2 + + 2OH‾ ↔ Pb(OH)2 ↔2H + + PbO2 2 ‾ hidróxido anfótero