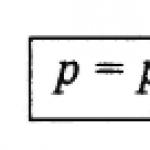Zmesi plynov. Daltonov zákon
Parciálny tlak je tá časť celkového tlaku zmesi plynov, ktorá je spôsobená daným plynom alebo parou.Čiastočný plyn v zmesi sa rovná tlaku plynu v zmesi, ktorý by mala samotná, pričom by zaberala rovnaký objem, aký zaberá zmes pri rovnakej teplote.
Daltonov zákon.Pri absencii chemických reakcií sa celkový tlak plynnej zmesi P total rovná súčtu parciálnych tlakov všetkých v nej obsiahnutých plynov p 1, p 2, p 3 ..., p n ˸
P celkom = p 1 + p 2 + ... + p n. (62)
Parciálny tlak daného plynu je úmerný podielu ᴇᴦο molekúl z celkového počtu molekúl zmesi (molárny zlomok)˸
p i = P celkom ·X i = P celkom · . (63)
Molový zlomok X i je pomer počtu mólov danej látky - n i (alebo určitého typu častíc) k celkovému počtu mólov látky (alebo častíc) nachádzajúcich sa v sústave n i.
Molárny zlomok možno pripísať buď celému systému alebo niektorej fáze. V druhom prípade sa berie pomer počtu mólov danej látky v tejto fáze k celkovému počtu mólov látky tvoriacej danú fázu. Súčet mólových zlomkov všetkých látok tvoriacich systém (alebo fázu) sa rovná jednotke.
Zloženie plynných zmesí možno vyjadriť aj pomocou hmotnostných a objemových dielov. Hmotnostný zlomok daného plynu v zmesi je pomer hmotnosti tohto plynu k hmotnosti zmesi plynov. Ak hmotnostné zlomky plynov označíme G 1, G 2, G 3, ..., G i; a hmotnosti plynov v zmesi - cez m 1, m 2, m 3, ..., m i a celkovú hmotnosť zmesi plynov - cez m, potom dostaneme˸
G1 = G2 = G3 = … Gn = (64)
G1 + G2 + G3 + ... + Gn = 1
m1 + m2 + m3 + … + m n = m.
Na vyjadrenie zloženia zmesi plynov v objemových jednotkách je potrebné uviesť objemy plynov tvoriacich zmes na rovnaký tlak a teplotu. Objem jednotlivého plynu obsiahnutého v zmesi znížený na tlak zmesi sa nazýva zmenšený objem. Na zistenie zmenšeného objemu plynu pri tlaku zmesi plynov Ptot a teplote T je potrebné použiť Boyleov-Mariottov zákon˸
p 1 V celkom = v 1 P celkom; p 2 V celkom = v 2 P celkom; p 3 V celkom = v 3 P celkom; ... ; p n V celkom = v n P celkom,
kde v 1, v 2, v 3, ..., v n sú zmenšené objemy jednotlivých plynov, ktoré tvoria zmes; р 1, р 2, р 3, …, р n – parciálne tlaky jednotlivých plynov;
v 1 = v 2 = v 3 = …; v n = (65)
Súčet redukovaných objemov jednotlivých plynov sa rovná celkovému objemu zmesi˸
v 1 + v 2 + v 3 + … + v n = V celk.
Pomer redukovaných objemov jednotlivých plynov k celkovému objemu zmesi sa nazýva objemový zlomok a vyjadruje sa prostredníctvom r˸
r1 = r2 = r3 = ...; r n = (66)
Pre zmesi plynov je zloženie vyjadrené objemom a molárnymi zlomkami rovnaké, t.j.˸
Zmesi plynov. Daltonov zákon - pojem a typy. Klasifikácia a vlastnosti kategórie "Zmesi plynov. Daltonov zákon" 2015, 2017-2018.
Za zmienku stoja ešte dva zákony o plyne. Jedna z nich sa týka počtu molekúl rôznych plynov pri rovnakých tlakoch a teplotách a druhá sa týka zmesi plynov.
Avogadrov zákon
Začiatkom 19. stor. pravidlo viacnásobných pomerov bolo zavedené pre plyny, ktoré vstupujú do chemickej reakcie. Ak sú teploty a tlaky plynov, ktoré sa navzájom kombinujú, rovnaké, ich objemy sú v jednoduchých pomeroch: 1:1, 1:2, 1:3 atď. Na základe tohto pravidla Avogadro v roku 1811 vyjadril odvážne tvrdenie. časová hypotéza: Rovnaké objemy plynov pri rovnakých teplotách a tlakoch obsahujú rovnaký počet molekúl. V pomere 1:1 sú molekuly reagujúcich plynov spojené do párov. Ak je objemový pomer 1:2, potom každá molekula prvého plynu k sebe pripojí dve molekuly druhého atď.
V súčasnosti je Avogadrova hypotéza prísne dokázaná a nazýva sa Avogadrovým zákonom.
Podľa Avogadrovho zákona rôzne plyny v množstve 1 mól majú rovnaké objemy pri rovnakých tlakochR a teplotyt , keďže počet molekúl v nich je rovnaký. Za normálnych podmienok, t.j. pri teplote 0 °C a atmosférickom tlaku 101 325 Pa, sa tento objem, ako ukazujú merania, rovná
Objem V M 0 nazývaný molár.
Prečo sa v rovnakých objemoch plynov pri rovnakých tlakoch a teplotách vždy nachádza rovnaký počet molekúl, bez ohľadu na to, ktorý plyn sa odoberá? To možno vysvetliť len pomocou molekulárnej kinetickej energie (pozri § 4.5).
Daltonov zákon
Častejšie sa nezaoberajú čistým plynom - kyslíkom, vodíkom atď., Ale zmesou plynov. Najmä atmosférický vzduch je zmesou dusíka, kyslíka a mnohých ďalších plynov. Každý z plynov v zmesi má svoj vlastný „príspevok“ k celkovému tlaku na stenách nádoby. Tlak, ktorý by mal každý z plynov tvoriacich zmes, keby sa zvyšné plyny odstránili z nádoby, sa nazýva parciálny (t. j. súkromný) tlak.
Najjednoduchší predpoklad, ktorý možno urobiť, je tlak plynnej zmesi R rovná súčtu parciálnych tlakov všetkých plyny p 1 , R 2 , R 3 ...:
 (3.8.2)
(3.8.2)
Anglický chemik D. Dalton zistil, že pre dostatočne riedke plyny je to presne tak aj v skutočnosti. Vzťah (3.8.2) sa nazýva Daltonov zákon.
Z hľadiska molekulárnej kinetickej teórie je Daltonov zákon splnený, pretože interakcia medzi molekulami ideálneho plynu je zanedbateľná. Preto každý plyn vyvíja na stenu nádoby rovnaký tlak, ako keby tam žiadne iné plyny neboli.
Mol akéhokoľvek plynu za normálnych podmienok zaberá určitý objem 22,4 l. Táto hodnota objemu bola stanovená experimentálne. V zmesi plynov každý z nich vyvíja tlak na steny nádoby bez ohľadu na prítomnosť iných plynov.
§ 3.9. Stavová rovnica ideálneho plynu
Stav danej hmotnosti plynu charakterizujú tri makroskopické parametre: tlak p, objemVa teplotou T. Teraz medzi nimi nájdeme súvislosť.
Stavová rovnica
V § 3.5 a 3.6 ste sa oboznámili so správaním ideálneho plynu za špeciálne vytvorených podmienok. Dva parametre z troch (p, V alebo V, T) zmenená pri konštantnej hodnote tretiny (G resp R). V prírode a technológii zvyčajne plyn mení všetky tri parametre naraz. Napríklad, keď vzduch ohriaty na povrchu Zeme stúpa, rozpína sa, jeho tlak klesá a teplota klesá.
Pomocou zákonov o plyne (3.5.2) a (3.7.8) môžeme získať rovnicu týkajúcu sa všetkých troch parametrov p, V A T, charakterizujúce stav plynu danej hmotnosti. Táto rovnica sa nazýva stavová rovnica ideálneho plynu.
Ak plyn pozostáva zo zmesi niekoľkých plynov, potom Daltonov zákon pomôže vypočítať tlak zmesi
Kde p v p 2 , ръ - parciálne tlaky plyny obsiahnuté v zmesi.
Čiastočný tlak je tlak, ktorý by mal plyn, keby sám zaberal celý dostupný objem.
Molekulárna kinetická teória(MKT) vznikli v 19. storočí. a predstavil štruktúru hmoty (hlavne plynov) z hľadiska troch ustanovení:
- všetky telesá pozostávajú z častíc: atómov a molekúl;
- častice sú v nepretržitom chaotickom pohybe (tepelnom);
- častice navzájom interagujú prostredníctvom dokonale elastických zrážok.
MCT sa stala jednou z najúspešnejších fyzikálnych teórií a bola potvrdená množstvom experimentálnych faktov. Jasné experimentálne potvrdenie chaotického tepelného pohybu atómov a molekúl bolo Brownov pohyb.
Brownov pohyb - tento jav objavil Robert Brown 1 v roku 1827. Pri pozorovaní pohybu peľu kvetov suspendovaného vo vode mikroskopom videl neusporiadané kľukaté trajektórie častíc.
Príčinou Brownovho pohybu je tepelný pohyb molekúl média, ktorý je spôsobený kolísaním tlaku. Nárazy molekúl média vedú časticu do náhodného pohybu: jej rýchlosť sa rýchlo mení vo veľkosti a smere. Kompletnú teóriu Brownovho pohybu poskytli neskôr Albert Einstein a Marian Smoluchowski.
Základná rovnica MKT. Tlak plynu na stene nádoby je určený impulzom, ktorý molekuly plynu odovzdajú stene nádoby, keď sa s ňou zrazia. Čím vyššia je rýchlosť molekuly, tým väčší impulz nesie, tým silnejšie pôsobí na stenu, t.j. R ~ v. Okrem toho, čím väčšia je hmotnosť molekuly Tčím vyšší je impulz, R ~ T.Čím vyššia je koncentrácia molekúl P tým častejšie dochádza ku kolíziám, preto R ~ P. Za predpokladu, že tlak je v priestore rozložený rovnomerne do všetkých smerov (x, z/, z), nakoniec píšeme

Kinetická energia jednej molekuly E = mv / 2. Spojením posledných dvoch rovníc medzi sebou dostaneme

Posledná rovnica sa nazýva základná rovnica MKT. Táto rovnica ukazuje, že priemerná kinetická energia molekúl ideálneho plynu (E)úmerné jeho teplote T. Všimnite si, že rovnica je napísaná pre monatomický ideálny plyn. Pre polyatómový plyn bude mať tvar

Kde ja- počet stupňov voľnosti molekuly, ktoré už poznáte. Z rovnosti

z toho vyplýva odmocnina stredná rýchlosť molekúl jednoatómového plynu sa rovná

Maxwellovo rozdelenie 1 je rozdelenie pravdepodobnosti, ktoré sa často vyskytuje v rovnakých častiach fyziky (a nielen) a je základom MCT. Maxwellova distribúcia je tiež použiteľná pre procesy elektronického prenosu, na opis vlastností jednotlivých molekúl v plyne. Táto distribúcia sa zvyčajne týka distribúcie energií molekúl v plyne, ale môže sa použiť aj na distribúciu rýchlostí, hybnosti a modulu molekúl. Môže sa tiež vyjadriť ako diskrétne rozdelenie na mnohých diskrétnych energetických úrovniach alebo ako spojité rozdelenie na určité kontinuum energie.
Obmedzíme sa na zváženie len jednej aplikácie Maxwellovho rozdelenia – rozloženia rýchlosti molekúl plynu.
Matematicky je Maxwellova distribučná funkcia (obr. 4.1) zapísaná takto:


Ryža. 4.1.
Vysvetlime si matematický význam distribučnej funkcie. Akákoľvek distribučná funkcia (vrátane Maxwellovej) ukazuje pravdepodobnosť, že určité množstvo (v našom prípade rýchlosť molekúl plynu v) nadobúda určitú špecifikovanú hodnotu. Maxwellova funkcia rozdelenia rýchlosti f(v) ukazuje pravdepodobnosť, že rýchlosť molekuly plynu je v.
Na obr. 4.1 na krivke rozloženia rýchlosti sú vyznačené tri charakteristické body: o - pravdepodobne rýchlosť molekuly (zodpovedá maximu, keďže má najväčšiu pravdepodobnosť, odtiaľ názov), r> sr - priemerná rýchlosť molekuly (jeho pravdepodobnosť je o niečo menšia) a g; kv - hlavné námestie rýchlosť (s ešte menšou pravdepodobnosťou).
Definujme matematické výrazy pre všetky tri rýchlosti. Ak chcete nájsť najpravdepodobnejšiu rýchlosť, ktorá zodpovedá maximálnej hodnote /( v), treba vypočítať df/dv, nastavte ju na nulu a vyriešte pre v

James Clerk Maxwell (1831 - 1879) - britský fyzik a matematik. Položil základy modernej klasickej elektrodynamiky (Maxwellove rovnice), zaviedol do fyziky pojmy posuvný prúd a elektromagnetické pole, predpovedal existenciu elektromagnetických vĺn, elektromagnetickú povahu svetla, je jedným zo zakladateľov kinetickej teórie plynov a autor princípu farebnej fotografie.
Formulácia zákonov
Zákon o celkovom tlaku zmesi plynov
Zákon o rozpustnosti zložiek plynnej zmesi
Pri konštantnej teplote je rozpustnosť každej zo zložiek plynnej zmesi nachádzajúcich sa nad kvapalinou v danej kvapaline úmerná ich parciálnemu tlaku.
Hranice použiteľnosti
Oba Daltonove zákony sú pre ideálne plyny prísne splnené. Pre skutočné plyny platia tieto zákony za predpokladu, že ich rozpustnosť je nízka a ich správanie sa blíži chovaniu ideálneho plynu.
História objavovania
Zákon o sčítaní parciálnych tlakov bol sformulovaný v roku 1801. Správne teoretické zdôvodnenie, založené na molekulárnej kinetickej teórii, bolo zároveň urobené oveľa neskôr.
Poznámky
Nadácia Wikimedia. 2010.
Pozrite sa, čo sú "Daltonove zákony" v iných slovníkoch:
DALTONOVE ZÁKONY- (Dalton Dalton): prvý zákon, celkový tlak zmesi ideálnych plynov, ktoré medzi sebou chemicky neinteragujú, sa rovná súčtu čiastkových (pozri) jednotlivých plynov, ktoré tvoria zmes, t.j. že každý plyn vyprodukuje v ... ... Veľká polytechnická encyklopédia
Daltonove zákony- objavil anglický fyzik a chemik J. Dalton (1766 1844) v rokoch 1801 a 1803. 1) tlak zmesi chemicky neinteragujúcich ideálnych plynov sa rovná súčtu parciálnych tlakov. Aplikujme na skutočné plyny pri teplotách a tlakoch... ... Pojmy moderných prírodných vied. Slovník základných pojmov
Základné zákony chémie možno rozdeliť na kvalitatívne a kvantitatívne. Obsah 1 Kvalitatívne zákony 1.1 I. Gibbsov fázový zákon ... Wikipedia
DALTONOVE ZÁKONY- (správnejšie Dalton, Dalton). 1. Zákon viacnásobných pomerov, ktorý objavil D., hovorí, že prvky sú zahrnuté v chemikálii. spojenia v pomeroch, ktoré sú vždy násobkami určitých prvočísel. Takže ak majú vodu, tak na jeden hmotnostný diel vodíka... ... Veľká lekárska encyklopédia
DALTONOVE ZÁKONY: 1) tlak zmesi plynov, ktoré medzi sebou chemicky neinteragujú, sa rovná súčtu ich parciálnych tlakov 2) rozpustnosť zložky zmesi plynov v danej kvapaline pri konštantnej teplote je; úmerné čiastočnému ...... Veľký encyklopedický slovník
1) tlak zmesi chemicky neinteragujúcich ideálnych plynov sa rovná súčtu parciálnych tlakov. Približne použiteľné pre reálne plyny pri teplotách p a tlakoch ďaleko od kritických hodnôt. 2) Pri konštantnom rýchlosť rozpustnosti v danej kvapaline... ... Fyzická encyklopédia
1) tlak zmesi chemicky neinteragujúcich ideálnych plynov sa rovná súčtu parciálnych tlakov. Približne použiteľné na skutočné plyny pri teplotách a tlakoch, ktoré nie sú kritické. 2) Pri konštantnom teplotná rozpustnosť v danej... Fyzická encyklopédia
DALTONOVE ZÁKONY: 1) tlak zmesi plynov, ktoré medzi sebou chemicky neinteragujú, sa rovná súčtu ich parciálnych tlakov; 2) rozpustnosť zložky zmesi plynov v danej kvapaline pri konštantnej teplote je úmerná parciálnej... ... encyklopedický slovník
Opíšte procesy prebiehajúce v rovnovážnych systémoch „kvapalný roztok-para“ pod vplyvom teploty alebo tlaku. Obsah 1 Konovalov prvý zákon 2 Konovalov druhý zákon ... Wikipedia
Tento článok alebo sekcia potrebuje revíziu. Vylepšite prosím článok v súlade s pravidlami pre písanie článkov. Celá ... Wikipedia
Zmesi plynov, v ktorých zložky navzájom neinteragujú, možno opísať pomocou Daltonovho zákona. Vzťahuje parciálne tlaky zložiek a ich mólové zlomky do jednej rovnice. Pozrime sa na tento zákon bližšie a na konkrétnych príkladoch si tiež ukážme, ako sa dá použiť.
Ideálne plyny
Daltonov zákon vo fyzike sa ukazuje ako platný výlučne pre ideálne plyny. Sú to plyny, ktorých častice (atómy, molekuly) navzájom neinteragujú. Pre ideálny plyn s konštantným počtom molekúl (atómov) v ňom (n = konštanta) platí rovnosť, ktorá súvisí s tromi makroskopickými parametrami (tlak P, objem V a teplota T):
P*V = n*R*T, R = 8,314 J/(K*mol) je konštantná hodnota.
Všetky skutočné plyny pri tlakoch niekoľkých atmosfér a teplotách rádovo izbovej teploty a vyšších možno s dobrou presnosťou považovať za ideálne, to znamená, že pre ne platí vyššie uvedená rovnosť.
Parciálny tlak komponentu
Pre pochopenie podstaty Daltonovho zákona je potrebné pochopiť pojem „čiastočný tlak“.
Pretože molekuly rôznych plynov sa navzájom „necítia“, pre každú chemickú zložku i v zmesi plynov bude platiť rovnosť:
Tlak Pi sa pre i-tu zložku nazýva čiastočný. Inými slovami, parciálny tlak je tlak, ktorý vytvára na stenách nádoby iba i-tá zložka. Nazýva sa čiastočný, pretože je súčasťou celkového tlaku alebo jeho časti.
Vyhlásenie Daltonovho zákona

V prvých rokoch 19. storočia britský vedec John Dalton pri štúdiu správania rôznych zmesí plynov zistil nasledujúcu skutočnosť: ak spočítate všetky parciálne tlaky zložiek zmesi plynov, dostanete celkový tlak, ktorý možno merať barometrom, tlakomerom alebo iným prístrojom na to určeným. Toto je Daltonov zákon. Napíšme to vo forme matematickej rovnosti:
Prečo je táto rovnosť pravdivá, pochopíte, ak si zapamätáte, že zložky zmesi vytvárajú tlak nezávisle od seba.
Ak vezmeme do úvahy, že parciálny tlak Pi je priamo úmerný látkovému množstvu ni zložky i, čo platí vždy, keď T = const a V = const, dostávame sa k ďalšej rovnosti:
Množstvo xi sa nazýva molárny zlomok. Vzťahuje sa k atómovým percentám ai zložky jednoduchým vzťahom:
Výraz, ktorý umožňuje určiť molárny zlomok zložky prostredníctvom jej parciálneho tlaku a naopak, sa nazýva aj Daltonov zákon.

Netreba zabúdať, že uvažovaný zákon platí nielen v prípade ideálnych plynov, ale aj bez chemických reakcií v nich. Tie vedú k zmenám v zložke a molárnom zložení, čo porušuje zákon o tlaku plynnej zmesi.
Príklady riešenia problémov
V tomto odseku zvážime príklady aplikácie Daltonovho zákona na riešenie praktických problémov.
Úloha 1. Je potrebné určiť parciálny tlak troch hlavných zložiek v suchom vzduchu.
Z literatúry môžete zistiť, že keďže je vzduch suchý, jeho hlavnými zložkami budú dusík (asi 78 %), kyslík (asi 21 %) a vzácny plyn argón (asi 1 %). Ak vezmeme do úvahy, že celkový tlak vzduchu na hladine mora je 1 atmosféra a premenou atómových percent na mólové frakcie, získame parciálne tlaky pre každú zložku:
Pi = Ptot*xiPN2 = 1 *0,78 = 0,78 atm.PO2 = 1*0,21 = 0,21 atm.PAr = 1*0,01 = 0,01 atm.
Problém 2. Existujú dva valce s čistými plynmi. Prvý valec obsahuje dusík s teplotou 300 K, objemom 10 litrov a tlakom 2 atmosféry. Druhý valec obsahuje kyslík s teplotou 300 K, ale s objemom 15 litrov a tlakom 1,5 atmosféry. Oba valce boli navzájom spojené. Je potrebné vypočítať parciálny tlak každej zložky vo výslednej zmesi.

Začnime tento problém riešiť výpočtom množstva látky pre dusík a kyslík. Použitím rovnice ideálneho plynu dostaneme:
PN2*VN2 = nN2*R*T =>nN2 = PN2*VN2/R*T = 2*101325*10-2/(8,314*300) = 0,812 mol; 5*101325*1,5*10-2/(8,314*300) = 0,914 mol.
Pri spojení dvoch valcov sa plyny zmiešajú tak, aby každá zložka zabrala celý objem dvoch valcov. Celkový tlak, ktorý bude v systéme, je možné vypočítať aj pomocou stavovej rovnice ideálneho plynu:
Vtot = VN2+V02 = 2,5 x 10-2 m3 n = nN2 + n02 = 0,812 + 0,914 = 1,726 mol. 172199,568 Pa alebo 1,7 atm.
Teraz môžete použiť vzorce Daltonovho zákona na výpočet parciálnych tlakov kyslíka a dusíka:
PN2 = Ptot*nN2/n = 1,7*0,812/1,726 = 0,8 atm; PO2 = Ptot - PN2 = 1,7 - 0,8 = 0,9 atm.
Pomer výsledných parciálnych tlakov plynov sa rovná pomeru látkových množstiev pre ne.