Sustancia puracontiene solo partículas un tipo. Algunos ejemplos son la plata (que contiene sólo átomos de plata), el ácido sulfúrico y el monóxido de carbono ( IV) (contienen solo las moléculas de las sustancias correspondientes). Todas las sustancias puras tienen propiedades físicas constantes, por ejemplo, punto de fusión (T pl ) y punto de ebullición ( bala en T ).
Una sustancia no es pura si contiene cualquier cantidad de una o más sustancias:impurezas.
Los contaminantes reducen el punto de congelación y aumentan el punto de ebullición de un líquido limpio. Por ejemplo, si se añade sal al agua, el punto de congelación de la solución disminuirá.
Mezclas constan de dos o más sustancias. El suelo, el agua de mar y el aire son ejemplos de mezclas diferentes. Muchas mezclas se pueden separar en sus componentes: Componentes - basado en la diferencia en sus propiedades físicas.
Tradicional Los métodos que se utilizan en la práctica de laboratorio para separar mezclas en componentes individuales son:
filtración,
decantación seguida de decantación,
separación mediante embudo de decantación,
centrifugación,
evaporación,
cristalización,
destilación (incluida la destilación fraccionada),
cromatografía,
sublimación y otros.
Filtración. La filtración se utiliza para separar líquidos de finas partículas sólidas suspendidas en él.(figura 37) , es decir. Filtrar líquido a través de materiales finamente porosos.filtros, que dejan pasar el líquido y retienen las partículas sólidas en su superficie. El líquido que ha pasado a través del filtro y se ha liberado de las impurezas sólidas que contiene se llama filtrar.
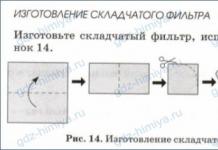
A menudo se utiliza en la práctica de laboratorio.papel liso y doblado filtros(figura 38) hecho de papel de filtro no pegado.
Para filtrar soluciones calientes (por ejemplo, para recristalizar sales), se utiliza un especialembudo de filtro caliente(figura 39) con calentamiento eléctrico o de agua).
Utilizado a menudofiltración al vacío. La filtración al vacío se utiliza para acelerar la filtración y liberar más completamente el precipitado de la solución. Para ello se monta un dispositivo de filtración al vacío. (figura 40) . Consiste enMatraz Bunsen, embudo de porcelana Buchner, botella de seguridad y bomba de vacío(normalmente chorro de agua).
En el caso de filtrar una suspensión de una sal poco soluble, los cristales de esta última pueden lavarse con agua destilada en un embudo Buchner para eliminar la solución inicial de su superficie. Para ello utilice lavadora(figura 41) .
Decantación. Los líquidos se pueden separar de los sólidos insolubles.decantación(figura 42) . Este método se puede utilizar si el sólido tiene una densidad mayor que el líquido. Por ejemplo, si se agrega arena de río a un vaso de agua, cuando se asiente, se depositará en el fondo del vaso, porque la densidad de la arena es mayor que la del agua. Luego se puede separar el agua de la arena simplemente escurriendo. Este método de decantación y posterior drenaje del filtrado se denomina decantación.
Centrifugación.D Para acelerar el proceso de separación de partículas muy pequeñas que forman suspensiones o emulsiones estables en un líquido, se utiliza el método. centrifugación. Este método se puede utilizar para separar mezclas de sustancias líquidas y sólidas que difieren en densidad. La división se realiza en centrífugas manuales o eléctricas(figura 43) .
Separación de dos líquidos inmiscibles, tener diferentes densidades y no formar emulsiones estables,se puede hacer con un embudo de decantación (figura 44) . Así se puede separar, por ejemplo, una mezcla de benceno y agua. Capa de benceno (densidad = 0,879 gramos/cm 3 ) ubicado sobre una capa de agua, que tiene una alta densidad ( = 1,0 g/cm 3 ). Abriendo la llave de paso del embudo de decantación se puede drenar con cuidado la capa inferior y separar un líquido de otro.
Evaporación(figura 45) - este método implica la eliminación de un disolvente, como agua, de una solución calentándola en un recipiente de porcelana que se evapora. En este caso, el líquido evaporado se elimina y la sustancia disuelta permanece en el recipiente de evaporación.
Cristalización- este es el proceso de separar cristales de un sólido cuando una solución se enfría, por ejemplo, después de que se haya evaporado. Hay que tener en cuenta que se forman cristales grandes cuando la solución se enfría lentamente. Tras un enfriamiento rápido (por ejemplo, bajo agua corriente), se forman cristales finos.
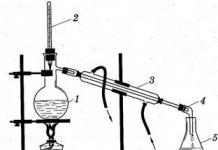
Destilación- un método para limpiar una sustancia basado en la evaporación de un líquido cuando se calienta, seguida de la condensación de los vapores resultantes. La purificación del agua a partir de sales (u otras sustancias, por ejemplo, colorantes) disueltas en ella mediante destilación se denomina destilación, y el agua purificada se destila.
Destilación fraccionada(figura 46) Se utiliza para separar mezclas de líquidos con diferentes puntos de ebullición. Un líquido con un punto de ebullición más bajo hierve más rápido y pasa a través columna fraccionaria(odeflemador). Cuando este líquido llega a la parte superior de la columna de fraccionamiento, ingresa alrefrigerador, enfriado por agua ypermitirir areceptor(matraz o tubo de ensayo).
La destilación fraccionada puede separar, por ejemplo, una mezcla de etanol y agua. Punto de ebullición del etanol 78. 0 C y agua 100 0 C. El etanol se evapora más fácilmente y entra primero al receptor a través del condensador.
Sublimación - Este método se utiliza para purificar sustancias capaces de pasar de un estado sólido a un estado gaseoso cuando se calientan, sin pasar por el estado líquido. Además, se condensan los vapores de la sustancia a purificar y se separan las impurezas que no pueden sublimar.
1. Complete los espacios en blanco del texto utilizando las palabras "componentes", "diferencias", "dos", "físicos".
Se puede preparar una mezcla mezclando al menos dos sustancias. Las mezclas se pueden separar en componentes individuales utilizando métodos físicos basados en diferencias en las propiedades físicas de los componentes.
2. Completa las oraciones.
a) El método de liquidación se basa en El hecho de que las partículas sólidas sean lo suficientemente grandes, se depositan rápidamente en el fondo y el líquido se puede drenar con cuidado del sedimento.
b) El método de centrifugación se basa en la acción de la fuerza centrífuga: las partículas más pesadas se depositan y las ligeras quedan encima.
c) El método de filtrado se basa en pasar una solución de un sólido a través de un filtro, donde las partículas sólidas quedan retenidas en el filtro.
3. Inserte una palabra que falta:
a) harina y azúcar granulada - un colador; limaduras de azufre y hierro: un imán.
b) agua y aceite de girasol - embudo de decantación; agua y arena de río - filtro.
c) aire y polvo - respirador; aire y gas venenoso - absorbente.
4. Haga una lista del equipo de filtración requerido.
a) filtro de papel
b) un vaso con una solución
c) embudo de vidrio
d) vidrio limpio
e) varilla de vidrio
f) trípode con pie
5. Experiencia de laboratorio. Fabricación de filtros ordinarios y plegados a partir de papel de filtro o servilleta de papel.

¿Qué crees, a través de qué filtro pasará la solución más rápido: regular o plisado? ¿Por qué?
Gracias al plisado, el área de contacto de la filtración es mayor que la de un filtro convencional.
6. Sugerir métodos para separar las mezclas indicadas en la Tabla 16.
Formas de separar algunas mezclas.
7. Experiencia en casa. Adsorción de colorantes de Pepsi-Cola por carbón activado.
Reactivos y equipos: bebida carbonatada, carbón activado; cacerola, embudo, papel de filtro, cocina eléctrica (gas).
Progreso. Vierte media taza (100 ml) de bebida gaseosa en una cacerola. Agrega 5 tabletas de carbón activado en el mismo lugar. Calienta la sartén durante 10 minutos en la estufa. Filtrar el carbón. Explique los resultados del experimento.
La solución se volvió incolora debido a la absorción de materia colorante con carbón activado.
8. Experiencia en casa. Adsorción de vapores olorosos por palitos de maíz.
Reactivos y equipos.: palitos de maíz, perfume o colonia; 2 tarros de cristal idénticos con tapa.
Progreso. Pon una gota de perfume en dos frascos de vidrio. Pon 4 o 5 palitos de maíz en uno de los frascos. Cierre ambos frascos con tapas. Agite un poco el frasco que contiene los palitos de maíz. ¿Para qué?
Para aumentar la tasa de adsorción.
Abra ambos bancos. Explique los resultados del experimento.
No hay olor en el frasco donde estaban los palitos de maíz, ya que adsorbieron el olor del perfume.
Sustancias puras y mezclas. Métodos para separar mezclas.Para establecer las propiedades de una sustancia es necesario tenerla en su forma pura, pero las sustancias en la naturaleza no se encuentran en forma pura. Cada sustancia siempre contiene una cierta cantidad de impurezas. Una sustancia que casi no contiene impurezas se llama pura. Trabajan con estas sustancias en un laboratorio científico, en una sala de química de la escuela. Tenga en cuenta que no existen sustancias absolutamente puras.
Casi todas las sustancias naturales, los alimentos (excepto la sal, el azúcar y algunos otros), los materiales de construcción, los productos químicos domésticos y muchos medicamentos y cosméticos son mezclas.
Las sustancias naturales son mezclas, que a veces constan de una gran cantidad de sustancias diferentes. Por ejemplo, el agua natural siempre contiene sales y gases disueltos. A veces, un contenido de impurezas muy pequeño puede provocar un cambio muy fuerte en algunas propiedades de una sustancia. Por ejemplo, el contenido en zinc de sólo unas centésimas de hierro o cobre acelera cientos de veces su interacción con el ácido clorhídrico. Cuando una de las sustancias está en la mezcla en una cantidad predominante, la mezcla entera suele llevar su nombre.
Un componente es cada sustancia contenida en una mezcla.
mezclas uniformes.
Agrega una pequeña porción de azúcar a un vaso de agua y revuelve hasta que se disuelva todo el azúcar. El líquido tendrá un sabor dulce. Así, el azúcar no desapareció, sino que permaneció en la mezcla. Pero no veremos sus cristales, ni siquiera examinando una gota de líquido a través de un potente microscopio.

Arroz. 3. Mezcla homogénea (solución acuosa de azúcar)
La mezcla preparada de azúcar y agua es homogénea (Fig. 3); En él se mezclan uniformemente las partículas más pequeñas de estas sustancias.
Las mezclas en las que los componentes no se pueden detectar a simple vista se denominan homogéneas.
El agua mezclada con arena, tiza o arcilla se congela a 0 0 C y hierve a 100 0 C.
Algunos tipos de mezclas heterogéneas tienen nombres especiales: espuma (por ejemplo, espuma, espuma de jabón), suspensión (una mezcla de agua con una pequeña cantidad de harina), emulsión (leche, aceite vegetal bien batido con agua), aerosol (humo , niebla).

Arroz. 5. Mezclas heterogéneas:
a - una mezcla de agua y azufre;
b - una mezcla de aceite vegetal y agua;
c - una mezcla de aire y agua
Hay diferentes formas de separar mezclas. La elección del método para separar una mezcla está influenciada por las propiedades de las sustancias que la forman.

Echemos un vistazo más de cerca a cada método:
asentamiento- un método común para purificar líquidos de impurezas mecánicas insolubles en agua, o Sustancias líquidas que son insolubles entre sí y tienen diferentes densidades.
La decantación se utiliza en la preparación de agua para necesidades tecnológicas y domésticas, el tratamiento de aguas residuales, la deshidratación y desalinización de petróleo crudo y en muchos procesos de tecnología química. Es una etapa importante en la autodepuración natural de embalses naturales y artificiales.
Filtración- separación del líquido de las impurezas sólidas insolubles que contiene; Las moléculas de líquido pasan a través de los poros del filtro y se retienen grandes partículas de impurezas.
Imagina que tienes una mezcla de arena de río y agua. Determinar el tipo de mezcla. ( heterogéneo). Compara las propiedades físicas de la arena de río y el agua. (Se trata de sustancias que son insolubles entre sí y tienen diferentes densidades). Sugiera un método para separar esta mezcla ( filtración).
Acción magnética- este es un método de separación de mezclas no homogéneas, cuando una de las sustancias de la mezcla puede ser atraída por un imán
Evaporación - este es un método para separar mezclas homogéneas, en este caso, una sustancia sólida soluble se libera de una solución, cuando se calienta, el agua se evapora y quedan cristales sólidos.
Destilación (del latín que significa "gotar") – Este es un método para separar mezclas homogéneas, en cuyo caso las mezclas líquidas se separan en fracciones de diferente composición. Se lleva a cabo por evaporación parcial del líquido, seguida de condensación del vapor. La fracción destilada (destilado) se enriquece con sustancias relativamente más volátiles (de bajo punto de ebullición), y el líquido no destilado (residuo de destilación) se enriquece con sustancias relativamente menos volátiles (de alto punto de ebullición).
En el laboratorio, la destilación se realiza en una instalación especial (Fig. 6). Cuando se calienta una mezcla de líquidos, la sustancia con el punto de ebullición más bajo hierve primero. Su vapor sale del recipiente, se enfría, se condensa1 y el líquido resultante fluye hacia el receptor. Cuando esta sustancia ya no esté en la mezcla, la temperatura comenzará a subir y, con el tiempo, otro componente líquido hervirá. Los líquidos no volátiles permanecen en el recipiente.

Arroz. 6. Instalación de laboratorio para destilación: a - convencional; b - simplificado
1 - una mezcla de líquidos con diferentes puntos de ebullición;
2 - termómetro;
3 - enfriador de agua;
4 - receptor
Considere cómo algunos métodos separación de mezclas.
El proceso de filtrado es la base del funcionamiento de un respirador, un dispositivo que protege los pulmones de una persona que trabaja en un ambiente con mucho polvo. El respirador tiene filtros que evitan que el polvo entre a los pulmones (Fig. 7). El respirador más simple es un vendaje hecho de varias capas de gasa. La aspiradora también tiene un filtro que extrae el polvo del aire.
 Arroz. 7. Trabajador en un respirador.
Arroz. 7. Trabajador en un respirador.
Concluya mediante qué métodos es posible separar una mezcla de sustancias solubles e insolubles en agua.
Cada sustancia contiene impurezas. Una sustancia se considera pura si casi no contiene impurezas.
Las mezclas de sustancias son homogéneas o heterogéneas. En una mezcla homogénea los componentes no se pueden detectar mediante observación, pero en una mezcla no homogénea sí es posible.
Algunas propiedades físicas de una mezcla homogénea difieren de las de los componentes.
En una mezcla heterogénea, se conservan las propiedades de los componentes.
Las mezclas heterogéneas de sustancias se separan mediante sedimentación, filtración, a veces mediante la acción de un imán, y las mezclas homogéneas se separan mediante evaporación y destilación (destilación).
Sustancias puras y mezclas.
Vivimos entre productos químicos. Inhalamos aire, y este es una mezcla de gases (nitrógeno, oxígeno y otros), exhalamos dióxido de carbono. Nos lavamos con agua: esta es otra sustancia, la más común en la Tierra. Bebemos leche, una mezcla de agua con las gotitas más pequeñas de grasa láctea, y no solo: también hay proteína de leche, caseína, sales minerales, vitaminas e incluso azúcar, pero no aquella con la que beben té, sino una leche especial. lactosa. Comemos manzanas, que contienen toda una serie de sustancias químicas: azúcar, ácido málico, vitaminas... manzana, pero también cualquier otro alimento. No sólo vivimos entre sustancias químicas, sino que nosotros mismos estamos hechos de ellas. Cada persona: su piel, sus músculos, su sangre, sus dientes, sus huesos y su cabello, están construidos con sustancias químicas, como una casa de ladrillos. El nitrógeno, el oxígeno, el azúcar y las vitaminas son sustancias de origen natural y natural. El vidrio, el caucho y el acero también son sustancias, más precisamente, materiales (mezclas de sustancias). Tanto el vidrio como el caucho son de origen artificial, no existían en la naturaleza. Las sustancias completamente puras no se encuentran en la naturaleza o son muy raras.
Cada sustancia siempre contiene una cierta cantidad de impurezas. Una sustancia que casi no contiene impurezas se llama pura. Trabajan con estas sustancias en un laboratorio científico, en una sala de química de la escuela. Tenga en cuenta que no existen sustancias absolutamente puras.
Una sustancia pura individual tiene un cierto conjunto de propiedades características (propiedades físicas constantes). Sólo el agua destilada pura tiene tderretir = 0 °С, thervir = 100 °С y no tiene sabor. El agua de mar se congela a una temperatura más baja y hierve a una temperatura más alta, su sabor es amargo y salado. El agua del Mar Negro se congela a una temperatura más baja y hierve a una temperatura más alta que el agua del Mar Báltico. ¿Por qué? El hecho es que el agua de mar contiene otras sustancias, por ejemplo, sales disueltas, es decir. es una mezcla de varias sustancias, cuya composición varía en un amplio rango, pero las propiedades de la mezcla no son constantes. El concepto de "mezcla" se definió en el siglo XVII. El científico inglés Robert Boyle: "Una mezcla es un sistema integral que consta de componentes heterogéneos".
Casi todas las sustancias naturales, los productos alimenticios (excepto la sal, el azúcar y algunos otros), muchos productos medicinales y cosméticos, los productos químicos domésticos y los materiales de construcción son mezclas.
Características comparativas de una mezcla y una sustancia pura.
Cada sustancia contenida en una mezcla se llama componente.
Clasificación de mezclas.
Hay mezclas homogéneas y heterogéneas.
Mezclas homogéneas (homogéneas)
Agrega una pequeña porción de azúcar a un vaso de agua y revuelve hasta que se disuelva todo el azúcar. El líquido tendrá un sabor dulce. Así, el azúcar no desapareció, sino que permaneció en la mezcla. Ho, no veremos sus cristales, ni siquiera cuando examinemos una gota de líquido en un potente microscopio. La mezcla preparada de azúcar y agua es homogénea; en ella se mezclan uniformemente las partículas más pequeñas de estas sustancias.
Las mezclas en las que los componentes no pueden detectarse mediante observación se denominan homogéneas.
La mayoría de las aleaciones metálicas también son mezclas homogéneas. Por ejemplo, una aleación de oro y cobre (utilizada para fabricar joyas) carece de partículas de cobre rojo y de oro amarillo.
A partir de materiales que son mezclas homogéneas de sustancias, se fabrican muchos artículos para diversos fines.
Todas las mezclas de gases, incluido el aire, pertenecen a mezclas homogéneas. Hay muchas mezclas homogéneas de líquidos.
Las mezclas homogéneas también se denominan soluciones, aunque sean sólidas o gaseosas.
Pongamos ejemplos de soluciones (aire en un matraz, sal de mesa + agua, calderilla: aluminio + cobre o níquel + cobre).
Mezclas heterogéneas (heterogéneas)
Sabes que la tiza no se disuelve en agua. Si su polvo se vierte en un vaso de agua, en la mezcla resultante siempre se pueden encontrar partículas de tiza, que son visibles a simple vista o a través de un microscopio.
Las mezclas en las que los componentes pueden detectarse mediante observación se denominan heterogéneas.
Las mezclas heterogéneas incluyen la mayoría de los minerales, suelo, materiales de construcción, tejidos vivos, agua turbia, leche y otros alimentos, algunos medicamentos y cosméticos.
En una mezcla heterogénea, se conservan las propiedades físicas de los componentes. Así, las limaduras de hierro mezcladas con cobre o aluminio no pierden su capacidad de ser atraídas por un imán.
Algunos tipos de mezclas heterogéneas tienen nombres especiales: espuma (por ejemplo, espuma, espuma de jabón), suspensión (una mezcla de agua con una pequeña cantidad de harina), emulsión (leche, aceite vegetal bien batido con agua), aerosol (humo , niebla).
Métodos para separar mezclas.
En la naturaleza las sustancias existen en forma de mezclas. Para la investigación de laboratorio, la producción industrial, para las necesidades de la farmacología y la medicina, se necesitan sustancias puras.
Existen muchos métodos para separar mezclas. Se eligen teniendo en cuenta el tipo de mezcla, estado de agregación y diferencias en las propiedades físicas de los componentes.
Métodos para separar mezclas.

Estos métodos se basan en diferencias en las propiedades físicas de los componentes de la mezcla.
Considere métodos para separar mezclas heterogéneas y homogéneas.
Ejemplo de mezcla |
Método de separación |
Suspensión: una mezcla de arena de río con agua. |
asentamiento La separación por decantación se basa en diferentes densidades de las sustancias. La arena más pesada se deposita en el fondo. También puedes separar la emulsión: para separar el aceite o el aceite vegetal del agua. En el laboratorio, esto se puede hacer usando un embudo de decantación. El aceite o el aceite vegetal forman la capa superior y más ligera. Como resultado de la sedimentación, el rocío cae de la niebla, el hollín del humo se deposita y la crema se deposita en la leche. |
Una mezcla de arena y sal de mesa en agua. |
Filtración La separación de mezclas heterogéneas mediante filtración se basa en la diferente solubilidad de las sustancias en agua y en los diferentes tamaños de partículas. A través de los poros del filtro solo pasan partículas de sustancias proporcionales a ellas, mientras que las partículas más grandes quedan retenidas en el filtro. Así puedes separar una mezcla heterogénea de sal de mesa y arena de río. Como filtros se pueden utilizar diversas sustancias porosas: algodón, carbón, arcilla cocida, vidrio prensado y otros. El método de filtrado es la base para el funcionamiento de electrodomésticos, como por ejemplo las aspiradoras. Lo utilizan los cirujanos: vendas de gasa; perforadores y trabajadores de ascensores - mascarillas respiratorias. Con la ayuda de un colador para filtrar las hojas de té, Ostap Bender, el héroe de la obra de Ilf y Petrov, logró quitarle una de las sillas a Ellochka Ogre ("Las Doce Sillas"). |
Una mezcla de polvo de hierro y azufre. |
Acción por imán o agua. El polvo de hierro fue atraído por un imán, pero el polvo de azufre no. El polvo de azufre no humectable flotó hacia la superficie del agua, mientras que el polvo de hierro pesado y humectable se depositó en el fondo. |
Una solución de sal en agua es una mezcla homogénea. |
Evaporación o cristalización El agua se evapora y quedan cristales de sal en la taza de porcelana. Cuando el agua se evapora de los lagos Elton y Baskunchak, se obtiene sal de mesa. Este método de separación se basa en la diferencia en los puntos de ebullición del disolvente y el soluto. Si una sustancia, como el azúcar, se descompone cuando se calienta, entonces el agua no se evapora por completo: la solución se evapora y luego los cristales de azúcar precipitan de una solución saturada. A veces es necesario eliminar las impurezas de disolventes con un punto de ebullición más bajo, por ejemplo, el agua de la sal. En este caso, los vapores de la sustancia deben recogerse y luego condensarse al enfriarse. Este método de separar una mezcla homogénea se llama destilación o destilación. En dispositivos especiales, destiladores, se obtiene agua destilada, que se utiliza para las necesidades de farmacología, laboratorios y sistemas de refrigeración de automóviles. En casa, puedes diseñar un destilador de este tipo. Sin embargo, si se separa una mezcla de alcohol y agua, entonces el primero que se destilará (se recogerá en un tubo de ensayo receptor) será el alcohol con una temperatura de ebullición = 78 °C, y quedará agua en el tubo de ensayo. La destilación se utiliza para obtener gasolina, queroseno y gasóleo a partir del petróleo. |
La cromatografía es un método especial para separar componentes en función de su diferente absorción por parte de una determinada sustancia.
Si cuelgas una tira de papel de filtro sobre un recipiente con tinta roja, sumergiendo en ellos solo el extremo de la tira. La solución es absorbida por el papel y sube a lo largo de él. Pero el borde de subida de la pintura va por detrás del borde de subida del agua. Así se produce la separación de dos sustancias: el agua y la materia colorante de la tinta.
Con la ayuda de la cromatografía, el botánico ruso M. S. Tsvet fue el primero en aislar la clorofila de las partes verdes de las plantas. En la industria y los laboratorios, en lugar de papel de filtro para cromatografía, se utilizan almidón, carbón, piedra caliza y óxido de aluminio. ¿Se requieren siempre sustancias con el mismo grado de purificación?
Para diferentes propósitos se necesitan sustancias con diferentes grados de purificación. El agua de cocción está suficientemente sedimentada para eliminar impurezas y se utiliza cloro para desinfectarla. Primero se debe hervir el agua potable. Y en los laboratorios químicos para la preparación de soluciones y experimentos, en medicina, se necesita agua destilada, lo más purificada posible de las sustancias disueltas en ella. Las sustancias de alta pureza, cuyo contenido de impurezas no supera la millonésima parte por ciento, se utilizan en la electrónica, los semiconductores, la tecnología nuclear y otras industrias de precisión.
¿Sabes qué métodos existen para separar mezclas? No se apresure a dar una respuesta negativa. Muchos de ellos los aplicas en tus actividades diarias.
Sustancia pura: ¿que es?
Átomos, moléculas, sustancias y mezclas son los conceptos químicos básicos. ¿Qué representan? En la tabla de D. I. Mendeleev hay 118 elementos químicos. Estos son diferentes tipos de partículas elementales: los átomos. Se diferencian en masa.
Los átomos se combinan entre sí para formar moléculas o sustancias. Estos últimos, cuando se combinan entre sí, forman mezclas. Las sustancias puras tienen composición y propiedades constantes. Estas son estructuras homogéneas. Pero se pueden separar en componentes mediante reacciones químicas.
Los científicos dicen que prácticamente no existen sustancias puras en la naturaleza. En cada uno de ellos hay una pequeña cantidad de impurezas. Esto se debe a que la mayoría de las sustancias difieren en su actividad. Incluso los metales sumergidos en agua se disuelven en ella a nivel de iones.
La composición de las sustancias puras es siempre constante. Es simplemente imposible cambiarlo. Entonces, si aumenta la cantidad de carbono u oxígeno en una molécula de dióxido de carbono, será una sustancia completamente diferente. Y en la mezcla, puede aumentar o disminuir la cantidad de componentes. Esto cambiará su composición, pero no el hecho de su existencia.
que es una mezcla
Una combinación de varias sustancias se llama mezcla. Pueden ser de dos tipos. Si los componentes individuales de una mezcla son indistinguibles, se llama homogénea u homogénea. Hay otro nombre que se usa con mayor frecuencia en la vida cotidiana: solución. Los componentes de dicha mezcla no pueden separarse por métodos físicos. Por ejemplo, de una solución salina no será posible extraer mecánicamente los cristales que en ella se disuelven. En la naturaleza no sólo existen soluciones líquidas. Entonces, el aire es una mezcla gaseosa homogénea y una aleación de metales es un sólido.
En mezclas heterogéneas o heterogéneas, las partículas individuales son visibles a simple vista. Se diferencian entre sí en composición y propiedades. Esto significa que se pueden separar entre sí de forma puramente mecánica. Cenicienta hizo frente perfectamente a esta tarea, que la malvada madrastra obligó a separar los frijoles de los guisantes.
Química: formas de separar mezclas.
En la vida cotidiana y en la naturaleza se encuentran una gran cantidad de mezclas. ¿Cómo elegir la forma correcta de separarlos? Debe basarse necesariamente en las propiedades físicas de los componentes individuales. Si las sustancias tienen diferentes puntos de ebullición, entonces la evaporación seguida de la cristalización, así como la destilación, serán efectivas. Estos métodos se utilizan para separar soluciones homogéneas. Para separar mezclas heterogéneas se utiliza la diferencia en otras propiedades de sus constituyentes: densidad, humectabilidad, solubilidad, tamaño, magnetismo, etc.
Métodos físicos para separar mezclas.
Cuando se separan los componentes de la mezcla, la composición de las sustancias mismas no cambia. Por lo tanto, es imposible llamar a los métodos para separar mezclas un proceso químico. Así, mediante sedimentación, filtración y aplicación de un imán, es posible separar mecánicamente los componentes individuales. En el laboratorio se utilizan varios dispositivos: embudo de decantación, papel de filtro, bandas magnéticas. Estos son métodos para separar mezclas heterogéneas.

Poner en pantalla
Este método es quizás el más sencillo. Toda ama de casa lo conoce. Se basa en la diferencia de tamaños de los componentes sólidos de la mezcla. El tamizado se utiliza en la vida cotidiana para separar la harina de impurezas, larvas de insectos y diversos contaminantes. En la producción agrícola, los granos de cereales se limpian de residuos extraños. Los trabajadores de la construcción están tamizando una mezcla de arena y grava.

asentamiento
Este método de separación de mezclas se utiliza para componentes con diferentes densidades. Si la arena entra en contacto con el agua, la solución resultante se debe mezclar bien y dejar reposar un rato. Lo mismo se puede hacer con una mezcla de agua y aceite o aceite vegetal. La arena se hundirá hasta el fondo. Pero el petróleo, por el contrario, será recogido desde arriba. Este método se observa en la vida cotidiana y en la naturaleza. Por ejemplo, el hollín se deposita en el humo y las gotas de rocío se separan de la niebla. Y si dejas leche casera para la noche, por la mañana podrás recoger la crema.
Filtración
Los bebedores de té preparado utilizan este método a diario. Estamos hablando de filtración, un método de separación de mezclas basado en la diferente solubilidad de los componentes. Imagínese que se metieran limaduras de hierro y sal en el agua. Grandes partículas insolubles quedarán en el filtro. Y la sal disuelta pasará por él. El principio de este método se basa en el trabajo de las aspiradoras, la acción de las mascarillas respiratorias y las vendas de gasa.

Acción magnética
Sugiera un método para separar mezclas de azufre y polvos de hierro. Naturalmente, ésta es la acción de un imán. ¿Todos los metales son capaces de esto? De nada. Según el grado de susceptibilidad se distinguen tres grupos de sustancias. Por ejemplo, el oro, el cobre y el zinc no se adhieren a un imán. Pertenecen al grupo de los diamagnetos. El magnesio, el platino y el aluminio tienen una percepción débil. Pero si la composición de la mezcla incluye ferromagnetos, este método será el más efectivo. A éstos pertenecen, por ejemplo, el hierro, el cobalto, el níquel, el terbio, el holmio y el tulio.

Evaporación
¿Qué método de separación de mezclas es adecuado para una solución acuosa homogénea? Esto es evaporación. Si solo tienes agua salada, pero necesitas agua limpia, no te enojes de inmediato. Necesitas calentar la mezcla hasta el punto de ebullición. Como resultado, el agua se evaporará. Y en el fondo del plato se verán cristales de la sustancia disuelta. Para recolectar agua, es necesario condensarla, transferirla de un estado gaseoso a uno líquido. Para ello, los vapores se enfrían, tocan la superficie con una temperatura más baja y fluyen hacia el recipiente preparado.
Cristalización
En ciencia, este término se considera en un sentido más amplio. No es sólo un método para obtener sustancias puras. Por su naturaleza, los icebergs, los minerales, los huesos y el esmalte dental son cristales.
Su crecimiento se produce en las mismas condiciones. Los cristales se forman como resultado del enfriamiento de líquidos o la sobresaturación del vapor y, en el futuro, la temperatura ya no debería cambiar. Por lo tanto, primero se alcanzan algunas condiciones limitantes. Como resultado, aparece un centro de cristalización, alrededor del cual se acumulan los átomos de un líquido, masa fundida, gas o vidrio.

Destilación
Seguro que has oído hablar del agua, que se llama destilada. Este líquido purificado es necesario para la fabricación de medicamentos, investigaciones de laboratorio y sistemas de refrigeración. Y lo consiguen en dispositivos especiales. Se les llama destiladores.
La destilación es un método de separación de mezclas de sustancias con diferentes puntos de ebullición. Traducido del latín, el término significa "gotas drenantes". Con este método se pueden separar, por ejemplo, alcohol y agua de una solución. La primera sustancia comenzará a hervir a una temperatura de +78 o C. Posteriormente se condensarán los vapores de alcohol. El agua permanecerá en forma líquida.
De manera similar, del petróleo se obtienen los productos de su procesamiento: gasolina, queroseno, gasóleo. Este proceso no es una reacción química. El aceite se separa en fracciones separadas, cada una de las cuales tiene su propio punto de ebullición. Esto sucede en varias etapas. En primer lugar, se lleva a cabo la separación primaria del petróleo. Se limpia de gases asociados, impurezas mecánicas y vapor de agua. En la siguiente etapa, el producto resultante se coloca en columnas de destilación y se calienta. Esta es la destilación atmosférica del petróleo. A una temperatura inferior a 62 grados, el gas asociado restante se volatiliza. Al calentar la mezcla a 180 grados, se obtienen fracciones de gasolina, hasta 240 - queroseno, hasta 350 - combustible diesel. El residuo del procesamiento del aceite térmico es el fueloil, que se utiliza como lubricante.

cromatografía
Este método lleva el nombre del científico que lo utilizó por primera vez. Su nombre era Mijail Semenovich Tsvet. Inicialmente, el método se utilizó para separar pigmentos vegetales. Literalmente, la cromatografía se traduce del griego como "escribo con color". Sumerge el papel de filtro en la mezcla de agua y tinta. El primero comenzará a absorberse inmediatamente. Esto se debe a diversos grados de propiedades adsorbentes. Esto también tiene en cuenta la difusión y el grado de solubilidad.
Adsorción
Algunas sustancias tienen la capacidad de atraer moléculas de otro tipo. Por ejemplo, tomamos carbón activado para envenenar y eliminar toxinas. Este proceso requiere una interfaz que se encuentre entre las dos fases.
Este método se utiliza en la industria química para separar el benceno de mezclas gaseosas, purificar productos líquidos del refinado de petróleo y limpiarlos de impurezas.
Entonces, en nuestro artículo examinamos los principales métodos para separar mezclas. Una persona los utiliza tanto en casa como a escala industrial. La elección del método depende del tipo de mezcla. Un factor importante son las características de las propiedades físicas de sus componentes. Para separar soluciones en las que las partes individuales son visualmente indistinguibles, se utilizan métodos de evaporación, cristalización, cromatografía y destilación. Si se pueden determinar los componentes individuales, estas mezclas se denominan heterogéneas. Para separarlos se utilizan métodos de sedimentación, filtración y uso de un imán.