Resumen por disciplina: Química
Sobre el tema: Métodos para separar mezclas.
Riga - 2009
Introducción…………………………………………………………………………..página 3
Tipos de mezclas…………………………………………………………………………p.4
Métodos para separar mezclas……………………………………………………..página 6
Conclusión…………………………………………………………………….página 11
Lista de referencias…………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………… ………..p.12
Introducción
En la naturaleza, las sustancias en forma pura son muy raras. La mayoría de los objetos que nos rodean están formados por una mezcla de sustancias. En un laboratorio químico, los químicos trabajan con sustancias puras. Si la sustancia contiene impurezas, cualquier químico puede separar la sustancia necesaria para el experimento de las impurezas. Para estudiar las propiedades de las sustancias, es necesario purificar esta sustancia, es decir. dividir en partes que lo componen. La separación de una mezcla es un proceso físico. Los métodos físicos para la separación de sustancias se utilizan ampliamente en laboratorios químicos, en la producción de productos alimenticios, en la producción de metales y otras sustancias.
Tipos de mezclas
No existen sustancias puras en la naturaleza. Al considerar los cantos rodados, el granito, estamos convencidos de que están formados por granos, vetas de varios colores; la leche contiene grasas, proteínas, agua; el petróleo y el gas natural contienen sustancias orgánicas llamadas hidrocarburos; el aire contiene varios gases; El agua natural no es una sustancia químicamente pura. Una mezcla es una mezcla de dos o más sustancias diferentes.
Las mezclas se pueden dividir en dos grandes grupos (ri
Si los componentes de la mezcla son visibles a simple vista, entonces dichas mezclas se denominan heterogéneo. Por ejemplo, una mezcla de madera y virutas de hierro, una mezcla de agua y aceite vegetal, una mezcla de arena de río y agua, etc.
Si los componentes de la mezcla no se pueden distinguir a simple vista, entonces dichas mezclas se denominan homogéneo. Mezclas como leche, aceite, una solución de azúcar en agua, etc. se clasifican como mezclas homogéneas.
Hay sustancias sólidas, líquidas y gaseosas. Las sustancias se pueden mezclar en cualquier estado de agregación. El estado de agregación de una mezcla determina una sustancia que es cuantitativamente superior al resto.
Las mezclas heterogéneas se forman a partir de sustancias de diferentes estados agregados, cuando las sustancias no se disuelven entre sí y se mezclan mal (Tabla 1).
|
Tipos de mezclas heterogéneas |
|
|
antes de mezclar |
Ejemplos |
|
duro/sólido |
Minerales; hierro/azufre |
|
líquido sólido |
Mortero de cal; aguas residuales |
|
sólido/gaseoso |
Fumar; aire polvoriento |
|
líquido/sólido |
Perla; minerales; agua helada |
|
líquido / líquido |
Leche; aceite vegetal/agua |
|
líquido/gaseoso |
Niebla; nubes |
|
gaseoso/sólido |
espuma de poliestireno |
|
gaseoso/líquido |
espuma de jabón |
Las mezclas homogéneas se forman cuando las sustancias se disuelven bien entre sí y se mezclan bien (Tabla 2).
|
Tipos de mezclas homogéneas |
|
|
Estado agregado de las partes constituyentes antes de mezclar |
Ejemplos |
|
duro/sólido |
Aleación de oro y plata. |
|
líquido sólido |
azucar agua |
|
sólido/gaseoso |
Vapores de yodo en el aire. |
|
líquido/sólido |
gelatina hinchada |
|
líquido / líquido |
alcohol/agua |
|
líquido/gaseoso |
Agua/aire |
|
gaseoso/sólido |
Hidrógeno en paladio |
|
gaseoso/líquido |
|
Cuando se forman mezclas, generalmente no ocurren transformaciones químicas y las sustancias de la mezcla conservan sus propiedades. Las diferencias en las propiedades de las sustancias se utilizan para separar mezclas.
Métodos para separar mezclas.
Las mezclas, tanto heterogéneas como homogéneas, se pueden dividir en partes constituyentes, es decir para sustancias puras. Las sustancias puras son sustancias que no se pueden separar en dos o más sustancias mediante métodos físicos y no cambian sus propiedades físicas. Existen varios métodos para separar mezclas; ciertos métodos para separar mezclas se utilizan dependiendo de la composición de la mezcla.
- Poner en pantalla;
- Filtración;
- asentamiento;
- Decantación
- centrifugación;
- Evaporación;
- Evaporación;
- Recristalización;
- Destilación (destilación);
- Congelación;
- La acción del imán;
- Cromatografía;
- Extracción;
- Adsorción.
Conozcamos algunos de ellos. Cabe señalar aquí que es más fácil separar mezclas heterogéneas que homogéneas, a continuación damos ejemplos de separación de sustancias de mezclas homogéneas y heterogéneas.
Poner en pantalla.
Imaginemos que se metió azúcar granulada en la harina. Quizás la manera más fácil de separarse es poner en pantalla. Con la ayuda de un colador, puedes separar fácilmente pequeñas partículas de harina de cristales de azúcar relativamente grandes. En agricultura, el cribado se utiliza para separar las semillas de las plantas de los restos extraños. En la construcción, la grava se separa de la arena de esta forma.
Filtración
El componente sólido de la suspensión se separa del líquido. filtración, utilizando filtros de papel o tela, algodón, una fina capa de arena fina. Imaginemos que nos dan una mezcla de sal de mesa, arena y arcilla. Es necesario separar la sal de mesa de la mezcla. Para ello, coloca la mezcla en un vaso con agua y agita. La sal de mesa se disuelve y la arena se asienta. La arcilla no se disuelve ni se deposita en el fondo del vaso, por lo que el agua permanece turbia. Para eliminar las partículas de arcilla insolubles de la solución, se filtra la mezcla. Para hacer esto, debe ensamblar un pequeño dispositivo de filtrado a partir de un embudo de vidrio, papel de filtro y un trípode. La solución salina se filtra. Para hacer esto, la solución filtrada se vierte con cuidado en un embudo con un filtro bien insertado. Las partículas de arena y arcilla permanecen en el filtro y una solución salina transparente pasa a través del filtro. La recristalización se utiliza para aislar la sal disuelta en agua.
recristalización, evaporación
Recristalización Se llama un método de purificación, en el que la sustancia primero se disuelve en agua y luego se evapora la solución de la sustancia en agua. Como resultado, el agua se evapora y la sustancia se libera en forma de cristales.
Pongamos un ejemplo: es necesario aislar la sal de mesa de una solución.
Arriba, consideramos un ejemplo en el que era necesario aislar la sal de mesa de una mezcla heterogénea. Ahora separemos la sal de mesa de una mezcla homogénea. La solución obtenida por filtración se llama filtrado. El filtrado se debe verter en una taza de porcelana. Coloque el vaso con la solución sobre el anillo del trípode y caliente la solución sobre la llama de la lámpara de alcohol. El agua comenzará a evaporarse y el volumen de la solución disminuirá. Tal proceso se llama evaporación. A medida que el agua se evapora, la solución se vuelve más concentrada. Cuando la solución alcance un estado de saturación con sal de mesa, aparecerán cristales en las paredes de la taza. En este punto, deje de calentar y enfríe la solución. La sal de mesa fría se destacará en forma de cristales. Si es necesario, los cristales de sal se pueden separar de la solución mediante filtración. La solución no debe evaporarse hasta que el agua se haya evaporado por completo, ya que otras impurezas solubles también pueden precipitar en forma de cristales y contaminar la sal de mesa.
Asentar, decantar
Se utiliza para aislar sustancias insolubles de líquidos. sosteniendo. Si las partículas sólidas son lo suficientemente grandes, se depositan rápidamente en el fondo y el líquido se vuelve transparente. Se puede drenar con cuidado el sedimento y esta sencilla operación también tiene su propio nombre: decantación.
Cuanto más pequeños sean los sólidos en el líquido, más tiempo se asentará la mezcla. Es posible separar entre sí y dos líquidos que no se mezclan entre sí.
centrifugación
Si las partículas de una mezcla no homogénea son muy pequeñas, no se puede separar ni por sedimentación ni por filtración. Ejemplos de tales mezclas son leche y pasta de dientes disuelta en agua. Estas mezclas se dividen centrifugación. Las mezclas que contienen dicho líquido se colocan en tubos de ensayo y se hacen girar a alta velocidad en aparatos especiales: centrífugas. Como resultado de la centrifugación, las partículas más pesadas se "presionan" hacia el fondo del recipiente y los pulmones quedan arriba. La leche son las partículas más pequeñas de grasa distribuidas en una solución acuosa de otras sustancias: azúcares, proteínas. Para separar dicha mezcla, se utiliza una centrífuga especial llamada separador. Al separar la leche, las grasas quedan en la superficie, son fáciles de separar. Lo que queda es agua con sustancias disueltas: es leche desnatada.
Adsorción
En tecnología, a menudo surge el problema de limpiar gases, como el aire, de componentes no deseados o dañinos. Muchas sustancias tienen una propiedad interesante: pueden "adherirse" a la superficie de sustancias porosas, como el hierro a un imán. Adsorción Se llama capacidad de algunos sólidos para absorber sustancias gaseosas o disueltas en su superficie. Las sustancias capaces de adsorción se llaman adsorbentes. Los adsorbentes son sustancias sólidas en las que hay muchos canales internos, huecos, poros, es decir. Tienen una superficie de absorción total muy grande. Los adsorbentes son carbón activado, gel de sílice (en la caja de zapatos nuevos puede encontrar una pequeña bolsa de guisantes blancos, esto es gel de sílice), papel de filtro. Las diferentes sustancias se "adhieren" a la superficie de los adsorbentes de diferentes maneras: algunas se sujetan firmemente a la superficie, otras son más débiles. El carbón activado es capaz de absorber no solo sustancias gaseosas, sino también disueltas en líquidos. En caso de intoxicación, se toma para que se absorban sustancias tóxicas.
Destilación (destilación)
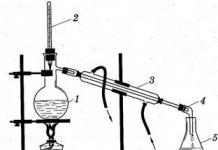
Dos líquidos que forman una mezcla homogénea, como el alcohol etílico y el agua, se separan mediante destilación o destilación. Este método se basa en el hecho de que el líquido se calienta hasta el punto de ebullición y su vapor se elimina a través de un tubo de salida de gas a otro recipiente. Al enfriarse, el vapor se condensa y las impurezas permanecen en el matraz de destilación. El aparato de destilación se muestra en la Fig. 2.

El líquido se coloca en un matraz Wurtz (1), el cuello del matraz Wurtz se cierra herméticamente con un tapón con un termómetro insertado en él (2), mientras que el depósito de mercurio debe estar al nivel de la abertura del tubo de salida. El extremo del tubo de salida se inserta a través de un tapón bien ajustado en el frigorífico Liebig (3), en cuyo otro extremo se fija el allonge (4). El extremo estrechado del allonge se baja al receptor (5). El extremo inferior de la cubierta del refrigerador está conectado con una manguera de goma a un grifo de agua, y desde el extremo superior se hace un desagüe hacia el fregadero. La cubierta del frigorífico siempre debe estar llena de agua. El matraz Wurtz y el condensador se fijan en bastidores separados. El líquido se vierte en el matraz a través de un embudo con un tubo largo, llenando el matraz de destilación hasta 2/3 de su volumen. Para una ebullición uniforme, se colocan varios puntos de ebullición en el fondo del matraz: capilares de vidrio sellados en un extremo. Después de cerrar el matraz, se suministra agua al refrigerador y se calienta el líquido del matraz. El calentamiento se puede realizar sobre un quemador de gas, una estufa eléctrica, un baño de agua, arena o aceite, dependiendo del punto de ebullición del líquido. En ningún caso se deben calentar líquidos inflamables y combustibles (alcohol, éter, acetona, etc.) a fuego abierto para evitar accidentes: solo se debe utilizar agua u otro baño. El líquido no debe evaporarse por completo: debe quedar en el matraz entre un 10 y un 15% del volumen tomado inicialmente. Se puede verter una nueva porción del líquido solo cuando el matraz se haya enfriado un poco.
Congelación
Las sustancias con diferentes puntos de fusión se separan mediante el método. congelación, enfriar la solución. Al congelarla, puedes obtener agua muy limpia en casa. Para ello, vierte agua del grifo en un frasco o taza y colócalo en el congelador del frigorífico (o sácalo al frío en invierno). Tan pronto como aproximadamente la mitad del agua se convierte en hielo, se debe verter la parte no congelada, donde se acumulan las impurezas, y dejar que el hielo se derrita.
En la industria y en condiciones de laboratorio, se utilizan métodos para separar mezclas, basándose en otras propiedades diferentes de las partes constituyentes de la mezcla. Por ejemplo, las virutas de hierro se pueden aislar de una mezcla. imán. La capacidad de las sustancias para disolverse en diversos disolventes se utiliza en extracción- un método para separar mezclas sólidas o líquidas tratándolas con varios disolventes. Por ejemplo, el yodo de una solución acuosa se puede aislar mediante cualquier disolvente orgánico en el que el yodo se disuelva mejor.
Conclusión
En la práctica de laboratorio y en la vida cotidiana, muy a menudo es necesario aislar componentes individuales de una mezcla de sustancias. Tenga en cuenta que las mezclas incluyen dos o más sustancias, divididas en dos grandes grupos: homogéneas y heterogéneas. Existen diversas formas de separar mezclas, como filtración, evaporación, destilación (destilación) y otras. Los métodos para separar mezclas dependen principalmente del tipo y composición de la mezcla.
Lista de literatura usada
1. S.Ozols, E.Lepiņš química para la escuela primaria., 1996. P. 289
2. Información de Internet
El material de la lección contiene información sobre varios métodos para separar mezclas y purificar sustancias. Aprenderá a utilizar el conocimiento de las diferencias en las propiedades de los componentes de una mezcla para seleccionar el método óptimo para separar una mezcla determinada.
Tema: Ideas químicas iniciales.
Lección: Métodos para separar mezclas y purificar sustancias.
Definamos la diferencia entre "métodos para separar mezclas" y "métodos para purificar sustancias". En el primer caso, es importante obtener en forma pura todos los componentes que componen la mezcla. Al purificar una sustancia, generalmente se descuida la obtención de impurezas en forma pura.
ASENTAMIENTO
¿Cómo separar una mezcla de arena y arcilla? Esta es una de las etapas de la producción cerámica (por ejemplo, en la producción de ladrillos). Para separar dicha mezcla, se utiliza el método de sedimentación. La mezcla se coloca en agua y se agita. La arcilla y la arena se depositan en el agua a diferentes velocidades. Por tanto, la arena se asentará mucho más rápido que la arcilla (Fig. 1).
Arroz. 1. Separación de una mezcla de arcilla y arena mediante sedimentación.
El método de sedimentación también se utiliza para separar mezclas de sólidos insolubles en agua con diferentes densidades. Por ejemplo, de esta forma se puede separar una mezcla de hierro y aserrín (el aserrín flotará en el agua, mientras que el hierro se asentará).
Una mezcla de aceite vegetal y agua también se puede separar mediante decantación, porque el aceite no se disuelve en agua y tiene menor densidad (Fig. 2). Así, mediante decantación es posible separar mezclas de líquidos insolubles entre sí con diferentes densidades.

Arroz. 2. Separación de una mezcla de aceite vegetal y agua por sedimentación.
Para separar una mezcla de sal de mesa y arena de río, puede utilizar el método de sedimentación (cuando se mezcla con agua, la sal se disolverá, la arena se asentará), pero será más confiable separar la arena de la solución salina con otro método: el método de filtración.
La filtración de esta mezcla se puede realizar utilizando un filtro de papel y un embudo sumergido en un vaso. Los granos de arena permanecen en el papel de filtro y una solución clara de sal de mesa pasa a través del filtro. En este caso, la arena del río es el sedimento y la solución salina es el lixiviado (Fig. 3).

Arroz. 3. Uso del método de filtración para separar la arena del río de la solución salina
La filtración se puede realizar no sólo con papel de filtro, sino también con otros materiales porosos o sueltos. Por ejemplo, los materiales a granel incluyen arena de cuarzo y los materiales porosos incluyen lana de vidrio y arcilla cocida.
Algunas mezclas se pueden separar mediante el método de "filtración en caliente". Por ejemplo, una mezcla de azufre y polvos de hierro. El hierro se funde a más de 1500 C y el azufre a unos 120 C. El azufre fundido se puede separar del polvo de hierro mediante lana de vidrio calentada.
La sal se puede aislar del filtrado mediante evaporación, es decir, Calienta la mezcla y el agua se evaporará y la sal quedará en la taza de porcelana. A veces se utiliza la evaporación, la evaporación parcial del agua. Como resultado, se forma una solución más concentrada, al enfriarse el soluto se libera en forma de cristales.
Si en la mezcla hay una sustancia capaz de magnetizarse, entonces es fácil aislarla en su forma pura utilizando un imán. De esta manera se puede separar, por ejemplo, una mezcla de polvos de azufre y hierro.
La misma mezcla se puede separar mediante otro método, utilizando el conocimiento de la humectabilidad de los componentes de la mezcla con agua. El hierro se humedece con agua, es decir. el agua se esparce por la superficie del hierro. El azufre no se moja con agua. Si pones un trozo de azufre en agua, se hundirá, es decir. La densidad del azufre es mayor que la densidad del agua. Pero el polvo de azufre saldrá, es decir. Las burbujas de aire se adhieren a los granos de azufre que no son humedecidos por el agua y los empujan hacia la superficie. Para separar la mezcla, debes colocarla en agua. El polvo de azufre flotará y el hierro se hundirá (Fig. 4).

Arroz. 4. Separación de una mezcla de polvos de azufre y hierro por flotación.
El método de separación de mezclas basado en la diferencia en la humectabilidad de los componentes se llama flotación (flotter francés - flotar). Consideremos algunos métodos más para la separación y purificación de sustancias.
Uno de los métodos más antiguos para separar mezclas es la destilación (o destilación). Con este método es posible separar componentes que son solubles entre sí y tienen diferentes puntos de ebullición. Así se obtiene el agua destilada. En un recipiente se hierve agua con impurezas. El vapor de agua resultante se condensa al enfriarse en otro recipiente en forma de agua ya destilada (pura).

Arroz. 5. Obtención de agua destilada
Los componentes con propiedades similares se pueden separar mediante el método de cromatografía. Este método se basa en la diferente absorción de las sustancias a separar por la superficie de otra sustancia.
Por ejemplo, la tinta roja se puede separar en sus componentes (agua y tinte) mediante cromatografía.

Arroz. 6. Separación de tinta roja mediante cromatografía en papel.
En los laboratorios químicos, la cromatografía se lleva a cabo utilizando instrumentos especiales: cromatógrafos, cuyas partes principales son una columna cromatográfica y un detector.
La adsorción se utiliza ampliamente en química para purificar determinadas sustancias. Es la acumulación de una sustancia sobre la superficie de otra sustancia. Los adsorbentes incluyen, por ejemplo, carbón activado.
Intente dejar caer una tableta de carbón activado en un recipiente con agua coloreada, revuelva, filtre y verá que el filtrado se ha vuelto incoloro. Los átomos de carbono atraen moléculas, en este caso, el tinte.
Actualmente, la adsorción se utiliza ampliamente para la purificación de agua y aire. Por ejemplo, los filtros de agua contienen carbón activado como adsorbente.
1. Colección de tareas y ejercicios de química: 8º grado: al libro de texto de P.A. Orzhekovsky y otros "Química, grado 8" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Libro de trabajo de química: octavo grado: al libro de texto de P.A. Orzhekovsky y otros: “Química. Grado 8” / V.O. Ushakova, P. I. Bespalov, PA Orzhekovsky; bajo. ed. profe. PENSILVANIA. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (p. 10-11)
3. Química: 8º grado: libro de texto. en general instituciones / A.P. Orzhekovsky, L. M. Meshcheryakova, L. S. Pontak. M.: AST: Astrel, 2005.(§4)
4. Química: inorg. química: libro de texto. para 8 celdas. general instituciones / G.E. Rudzitis, FuGyu Feldman. - M.: Educación, JSC "Libros de texto de Moscú", 2009. (§ 2)
5. Enciclopedia para niños. Volumen 17. Química/Capítulo. editado por V. A. Volodin, líder. científico ed. I. Leenson. – M.: Avanta+, 2003.
Recursos web adicionales
1. Una colección única de recursos educativos digitales ().
2. Versión electrónica de la revista "Química y Vida" ().
Tarea
Del libro de texto P.A. Orzhekovsky y otros "Química, grado 8" Con. 33 Nos. 2,4,6,T.
Sustancia puracontiene solo partículas un tipo. Algunos ejemplos son la plata (que contiene sólo átomos de plata), el ácido sulfúrico y el monóxido de carbono ( IV) (contienen solo las moléculas de las sustancias correspondientes). Todas las sustancias puras tienen propiedades físicas constantes, por ejemplo, punto de fusión (T pl ) y punto de ebullición ( bala en T ).
Una sustancia no es pura si contiene cualquier cantidad de una o más sustancias:impurezas.
Los contaminantes reducen el punto de congelación y aumentan el punto de ebullición de un líquido limpio. Por ejemplo, si se añade sal al agua, el punto de congelación de la solución disminuirá.
Mezclas constan de dos o más sustancias. El suelo, el agua de mar y el aire son ejemplos de mezclas diferentes. Muchas mezclas se pueden separar en sus componentes: Componentes - basado en la diferencia en sus propiedades físicas.
Tradicional Los métodos que se utilizan en la práctica de laboratorio para separar mezclas en componentes individuales son:
filtración,
decantación seguida de decantación,
separación mediante embudo de decantación,
centrifugación,
evaporación,
cristalización,
destilación (incluida la destilación fraccionada),
cromatografía,
sublimación y otros.
Filtración. La filtración se utiliza para separar líquidos de finas partículas sólidas suspendidas en él.(figura 37) , es decir. Filtrar líquido a través de materiales finamente porosos.filtros, que dejan pasar el líquido y retienen las partículas sólidas en su superficie. El líquido que ha pasado a través del filtro y se ha liberado de las impurezas sólidas que contiene se llama filtrar.
A menudo se utiliza en la práctica de laboratorio.papel liso y doblado filtros(figura 38) hecho de papel de filtro no pegado.
Para filtrar soluciones calientes (por ejemplo, para recristalizar sales), se utiliza un especialembudo de filtro caliente(figura 39) con calentamiento eléctrico o de agua).
Utilizado a menudofiltración al vacío. La filtración al vacío se utiliza para acelerar la filtración y liberar más completamente el precipitado de la solución. Para ello se monta un dispositivo de filtración al vacío. (figura 40) . Consiste enMatraz Bunsen, embudo de porcelana Buchner, botella de seguridad y bomba de vacío(normalmente chorro de agua).
En el caso de filtrar una suspensión de una sal poco soluble, los cristales de esta última pueden lavarse con agua destilada en un embudo Buchner para eliminar la solución inicial de su superficie. Para ello utilice lavadora(figura 41) .
Decantación. Los líquidos se pueden separar de los sólidos insolubles.decantación(figura 42) . Este método se puede utilizar si el sólido tiene una densidad mayor que el líquido. Por ejemplo, si se agrega arena de río a un vaso de agua, cuando se asiente, se depositará en el fondo del vaso, porque la densidad de la arena es mayor que la del agua. Luego se puede separar el agua de la arena simplemente escurriendo. Este método de decantación y posterior drenaje del filtrado se denomina decantación.
Centrifugación.D Para acelerar el proceso de separación de partículas muy pequeñas que forman suspensiones o emulsiones estables en un líquido, se utiliza el método. centrifugación. Este método se puede utilizar para separar mezclas de sustancias líquidas y sólidas que difieren en densidad. La división se realiza en centrífugas manuales o eléctricas(figura 43) .
Separación de dos líquidos inmiscibles, tener diferentes densidades y no formar emulsiones estables,se puede hacer con un embudo de decantación (figura 44) . Así se puede separar, por ejemplo, una mezcla de benceno y agua. Capa de benceno (densidad = 0,879 gramos/cm 3 ) ubicado sobre una capa de agua, que tiene una alta densidad ( = 1,0 g/cm 3 ). Abriendo la llave de paso del embudo de decantación se puede drenar con cuidado la capa inferior y separar un líquido de otro.
Evaporación(figura 45) - este método implica la eliminación de un disolvente, como agua, de una solución calentándola en un recipiente de porcelana que se evapora. En este caso, el líquido evaporado se elimina y la sustancia disuelta permanece en el recipiente de evaporación.
Cristalización- este es el proceso de separar cristales de un sólido cuando una solución se enfría, por ejemplo, después de que se haya evaporado. Hay que tener en cuenta que se forman cristales grandes cuando la solución se enfría lentamente. Tras un enfriamiento rápido (por ejemplo, bajo agua corriente), se forman cristales finos.
Destilación- un método para limpiar una sustancia basado en la evaporación de un líquido cuando se calienta, seguida de la condensación de los vapores resultantes. La purificación del agua a partir de sales (u otras sustancias, por ejemplo, colorantes) disueltas en ella mediante destilación se denomina destilación, y el agua purificada se destila.
Destilación fraccionada(figura 46) Se utiliza para separar mezclas de líquidos con diferentes puntos de ebullición. Un líquido con un punto de ebullición más bajo hierve más rápido y pasa a través columna fraccionaria(odeflemador). Cuando este líquido llega a la parte superior de la columna de fraccionamiento, ingresa alrefrigerador, enfriado por agua ypermitirir areceptor(matraz o tubo de ensayo).
La destilación fraccionada puede separar, por ejemplo, una mezcla de etanol y agua. Punto de ebullición del etanol 78. 0 C y agua 100 0 C. El etanol se evapora más fácilmente y entra primero al receptor a través del condensador.
Sublimación - Este método se utiliza para purificar sustancias capaces de pasar de un estado sólido a un estado gaseoso cuando se calientan, sin pasar por el estado líquido. Además, se condensan los vapores de la sustancia a purificar y se separan las impurezas que no pueden sublimar.
Métodos para separar mezclas.
La mayoría de las sustancias de nuestro planeta no se encuentran en forma pura, sino en compuestos y mezclas, junto con otras sustancias.
Entonces, la composición del granito incluye tres sustancias que son visibles a simple vista.
Pero la leche nos parece homogénea hasta que se vuelve agria. Agrio
la leche se separa en un suero claro y un precipitado sólido blanco: proteína
caseína. hombre hace mucho tiempo utiliza estas sustancias , incluidos en la leche, resaltándolos
de la mezcla. La cuajada se prepara a partir de proteína insoluble, caseína, y soluble.
Las proteínas del suero se utilizan para la nutrición clínica.
¿Cómo se pueden separar las mezclas?
1. Si la sustancia es insoluble en agua, como cereales (arroz, trigo sarraceno, sémola, etc.), arena de río, tiza, arcilla, se puede utilizar el método de filtración.
Filtración-Filtrar líquidos (gases) a través de un filtro para purificarlos de impurezas sólidas.

1. Poner un filtro. Lo colocamos en un embudo mojándolo ligeramente con agua.
2. Insertar el embudo con el filtro en el matraz.
3. Pasar una mezcla de materia no disuelta y agua a través del filtro.
Conclusión. El agua purificada por filtración pasó libremente a través del filtro; queda una sustancia insoluble en agua en el filtro.
2. Si el sólido es soluble en agua (sal de mesa, azúcar, ácido cítrico), entonces para la separaciónmezclas, se puede utilizar el método de evaporación.
Evaporación- Separación de sólidos disueltos en un líquido convirtiéndolo en vapor.
En un vaso de agua, la sal no desapareció, aunque se volvió invisible: la solución es transparente. La evaporación permitió aislar una sustancia disuelta en agua a partir de una mezcla de sustancias (agua y sal). En el cristal se ven cristales de sal. Esto confirma la conclusión de que que cada sustancia (tanto agua como sal) de la mezcla conserve sus propiedades.
Conclusión. Las sustancias solubles se pueden aislar de una solución.
3 .Para separar líquidos solubles entre sí, para obtener agua pura (sin impurezas), se utiliza el método de destilación.
(o destilación)
Destilación-destilación, separación de sustancias contenidas en mezclas líquidas según los puntos de ebullición, seguido de enfriamiento del vapor.
En la naturaleza, el agua en su forma pura (sin sales) no se encuentra. El agua de mar, de mar, de río, de pozo y de manantial son variedades de soluciones salinas en agua. Sin embargo, a menudo la gente necesita agua limpia que no contenga sales (utilizada en motores de automóviles; en la producción química para obtener diversas soluciones y sustancias; en la fabricación de fotografías). Esta agua se llama destilada y el método para obtenerla se llama destilación.

Calentamos agua del grifo sobre la llama de una lámpara de alcohol en un tubo de ensayo cerrado con un corcho con un tubo de salida de gas. Bajamos el extremo del tubo a un tubo de ensayo limpio y seco colocado en un vaso con hielo. Aparecerán gotas de agua destilada (purificada de sales e impurezas) en el fondo y las paredes de un tubo de ensayo en un vaso con hielo.
Ejercicio
1. Mire dentro de una tetera vacía en la que se hierve agua. ¿Hay depósitos blancos (incrustaciones) en las paredes y el fondo de sustancias que se han disuelto en agua?
2. Gotas de agua fluyen de la tapa del hervidor en el que se hierve el agua. ¿Qué agua, la de la tapa o la del propio hervidor, contiene más sales? Explica tu respuesta.
3. ¿Cómo se llama el proceso que se muestra en la imagen?

4. Si la mezcla contiene hierro, entonces se puede utilizar un imán para aislarlo, porque. El hierro y sus aleaciones son atraídos por un imán.
5. Para separar dos líquidos inmiscibles (aceite y agua, aceite de girasol y agua), es necesario utilizar un embudo de decantación.

El líquido con mayor densidad se fusionará en un vaso y un líquido más ligero quedará en el embudo de decantación.
Cada sustancia contiene impurezas. Una sustancia se considera pura si casi no contiene impurezas.
Las mezclas de sustancias son homogéneas o heterogéneas. En una mezcla homogénea los componentes no se pueden detectar mediante observación, pero en una mezcla no homogénea sí es posible.
Algunas propiedades físicas de una mezcla homogénea difieren de las de los componentes.
En una mezcla heterogénea, se conservan las propiedades de los componentes.
Las mezclas heterogéneas de sustancias se separan mediante sedimentación, filtración, a veces mediante la acción de un imán, y las mezclas homogéneas se separan mediante evaporación y destilación (destilación).
Sustancias puras y mezclas.
Vivimos entre productos químicos. Inhalamos aire, y este es una mezcla de gases (nitrógeno, oxígeno y otros), exhalamos dióxido de carbono. Nos lavamos con agua: esta es otra sustancia, la más común en la Tierra. Bebemos leche, una mezcla de agua con las gotitas más pequeñas de grasa láctea, y no solo: también hay proteína de leche, caseína, sales minerales, vitaminas e incluso azúcar, pero no aquella con la que beben té, sino una leche especial. lactosa. Comemos manzanas, que contienen toda una serie de sustancias químicas: azúcar, ácido málico, vitaminas... manzana, pero también cualquier otro alimento. No sólo vivimos entre sustancias químicas, sino que nosotros mismos estamos hechos de ellas. Cada persona: su piel, sus músculos, su sangre, sus dientes, sus huesos y su cabello, están construidos con sustancias químicas, como una casa de ladrillos. El nitrógeno, el oxígeno, el azúcar y las vitaminas son sustancias de origen natural y natural. El vidrio, el caucho y el acero también son sustancias, más precisamente, materiales (mezclas de sustancias). Tanto el vidrio como el caucho son de origen artificial, no existían en la naturaleza. Las sustancias completamente puras no se encuentran en la naturaleza o son muy raras.
Cada sustancia siempre contiene una cierta cantidad de impurezas. Una sustancia que casi no contiene impurezas se llama pura. Trabajan con estas sustancias en un laboratorio científico, en una sala de química de la escuela. Tenga en cuenta que no existen sustancias absolutamente puras.
Una sustancia pura individual tiene un cierto conjunto de propiedades características (propiedades físicas constantes). Sólo el agua destilada pura tiene tderretir = 0 °С, thervir = 100 °С y no tiene sabor. El agua de mar se congela a una temperatura más baja y hierve a una temperatura más alta, su sabor es amargo y salado. El agua del Mar Negro se congela a una temperatura más baja y hierve a una temperatura más alta que el agua del Mar Báltico. ¿Por qué? El hecho es que el agua de mar contiene otras sustancias, por ejemplo, sales disueltas, es decir. es una mezcla de varias sustancias, cuya composición varía en un amplio rango, pero las propiedades de la mezcla no son constantes. El concepto de "mezcla" se definió en el siglo XVII. El científico inglés Robert Boyle: "Una mezcla es un sistema integral que consta de componentes heterogéneos".
Casi todas las sustancias naturales, los productos alimenticios (excepto la sal, el azúcar y algunos otros), muchos productos medicinales y cosméticos, los productos químicos domésticos y los materiales de construcción son mezclas.
Características comparativas de una mezcla y una sustancia pura.
Cada sustancia contenida en una mezcla se llama componente.
Clasificación de mezclas.
Hay mezclas homogéneas y heterogéneas.
Mezclas homogéneas (homogéneas)
Agrega una pequeña porción de azúcar a un vaso de agua y revuelve hasta que se disuelva todo el azúcar. El líquido tendrá un sabor dulce. Así, el azúcar no desapareció, sino que permaneció en la mezcla. Ho, no veremos sus cristales, ni siquiera cuando examinemos una gota de líquido en un potente microscopio. La mezcla preparada de azúcar y agua es homogénea; en ella se mezclan uniformemente las partículas más pequeñas de estas sustancias.
Las mezclas en las que los componentes no pueden detectarse mediante observación se denominan homogéneas.
La mayoría de las aleaciones metálicas también son mezclas homogéneas. Por ejemplo, una aleación de oro y cobre (utilizada para fabricar joyas) carece de partículas de cobre rojo y de oro amarillo.
A partir de materiales que son mezclas homogéneas de sustancias, se fabrican muchos artículos para diversos fines.
Todas las mezclas de gases, incluido el aire, pertenecen a mezclas homogéneas. Hay muchas mezclas homogéneas de líquidos.
Las mezclas homogéneas también se denominan soluciones, aunque sean sólidas o gaseosas.
Pongamos ejemplos de soluciones (aire en un matraz, sal de mesa + agua, calderilla: aluminio + cobre o níquel + cobre).
Mezclas heterogéneas (heterogéneas)
Sabes que la tiza no se disuelve en agua. Si su polvo se vierte en un vaso de agua, en la mezcla resultante siempre se pueden encontrar partículas de tiza, que son visibles a simple vista o a través de un microscopio.
Las mezclas en las que los componentes pueden detectarse mediante observación se denominan heterogéneas.
Las mezclas heterogéneas incluyen la mayoría de los minerales, suelo, materiales de construcción, tejidos vivos, agua turbia, leche y otros alimentos, algunos medicamentos y cosméticos.
En una mezcla heterogénea, se conservan las propiedades físicas de los componentes. Así, las limaduras de hierro mezcladas con cobre o aluminio no pierden su capacidad de ser atraídas por un imán.
Algunos tipos de mezclas heterogéneas tienen nombres especiales: espuma (por ejemplo, espuma, espuma de jabón), suspensión (una mezcla de agua con una pequeña cantidad de harina), emulsión (leche, aceite vegetal bien batido con agua), aerosol (humo , niebla).
Métodos para separar mezclas.
En la naturaleza las sustancias existen en forma de mezclas. Para la investigación de laboratorio, la producción industrial, para las necesidades de la farmacología y la medicina, se necesitan sustancias puras.
Existen muchos métodos para separar mezclas. Se eligen teniendo en cuenta el tipo de mezcla, estado de agregación y diferencias en las propiedades físicas de los componentes.
Métodos para separar mezclas.

Estos métodos se basan en diferencias en las propiedades físicas de los componentes de la mezcla.
Considere métodos para separar mezclas heterogéneas y homogéneas.
Ejemplo de mezcla |
Método de separación |
Suspensión: una mezcla de arena de río con agua. |
asentamiento La separación por decantación se basa en diferentes densidades de las sustancias. La arena más pesada se deposita en el fondo. También puedes separar la emulsión: para separar el aceite o el aceite vegetal del agua. En el laboratorio, esto se puede hacer usando un embudo de decantación. El aceite o el aceite vegetal forman la capa superior y más ligera. Como resultado de la sedimentación, el rocío cae de la niebla, el hollín del humo se deposita y la crema se deposita en la leche. |
Una mezcla de arena y sal de mesa en agua. |
Filtración La separación de mezclas heterogéneas mediante filtración se basa en la diferente solubilidad de las sustancias en agua y en los diferentes tamaños de partículas. A través de los poros del filtro solo pasan partículas de sustancias proporcionales a ellas, mientras que las partículas más grandes quedan retenidas en el filtro. Así puedes separar una mezcla heterogénea de sal de mesa y arena de río. Como filtros se pueden utilizar diversas sustancias porosas: algodón, carbón, arcilla cocida, vidrio prensado y otros. El método de filtrado es la base para el funcionamiento de electrodomésticos, como por ejemplo las aspiradoras. Lo utilizan los cirujanos: vendas de gasa; perforadores y trabajadores de ascensores - mascarillas respiratorias. Con la ayuda de un colador para filtrar las hojas de té, Ostap Bender, el héroe de la obra de Ilf y Petrov, logró quitarle una de las sillas a Ellochka Ogre ("Las Doce Sillas"). |
Una mezcla de polvo de hierro y azufre. |
Acción por imán o agua. El polvo de hierro fue atraído por un imán, pero el polvo de azufre no. El polvo de azufre no humectable flotó hacia la superficie del agua, mientras que el polvo de hierro pesado y humectable se depositó en el fondo. |
Una solución de sal en agua es una mezcla homogénea. |
Evaporación o cristalización El agua se evapora y quedan cristales de sal en la taza de porcelana. Cuando el agua se evapora de los lagos Elton y Baskunchak, se obtiene sal de mesa. Este método de separación se basa en la diferencia en los puntos de ebullición del disolvente y el soluto. Si una sustancia, como el azúcar, se descompone cuando se calienta, entonces el agua no se evapora por completo: la solución se evapora y luego los cristales de azúcar precipitan de una solución saturada. A veces es necesario eliminar las impurezas de disolventes con un punto de ebullición más bajo, por ejemplo, el agua de la sal. En este caso, los vapores de la sustancia deben recogerse y luego condensarse al enfriarse. Este método de separar una mezcla homogénea se llama destilación o destilación. En dispositivos especiales, destiladores, se obtiene agua destilada, que se utiliza para las necesidades de farmacología, laboratorios y sistemas de refrigeración de automóviles. En casa, puedes diseñar un destilador de este tipo. Sin embargo, si se separa una mezcla de alcohol y agua, entonces el primero que se destilará (se recogerá en un tubo de ensayo receptor) será el alcohol con una temperatura de ebullición = 78 °C, y quedará agua en el tubo de ensayo. La destilación se utiliza para obtener gasolina, queroseno y gasóleo a partir del petróleo. |
La cromatografía es un método especial para separar componentes en función de su diferente absorción por parte de una determinada sustancia.
Si cuelgas una tira de papel de filtro sobre un recipiente con tinta roja, sumergiendo en ellos solo el extremo de la tira. La solución es absorbida por el papel y sube a lo largo de él. Pero el borde de subida de la pintura va por detrás del borde de subida del agua. Así se produce la separación de dos sustancias: el agua y la materia colorante de la tinta.
Con la ayuda de la cromatografía, el botánico ruso M. S. Tsvet fue el primero en aislar la clorofila de las partes verdes de las plantas. En la industria y los laboratorios, en lugar de papel de filtro para cromatografía, se utilizan almidón, carbón, piedra caliza y óxido de aluminio. ¿Se requieren siempre sustancias con el mismo grado de purificación?
Para diferentes propósitos se necesitan sustancias con diferentes grados de purificación. El agua de cocción está suficientemente sedimentada para eliminar impurezas y se utiliza cloro para desinfectarla. Primero se debe hervir el agua potable. Y en los laboratorios químicos para la preparación de soluciones y experimentos, en medicina, se necesita agua destilada, lo más purificada posible de las sustancias disueltas en ella. Las sustancias de alta pureza, cuyo contenido de impurezas no supera la millonésima parte por ciento, se utilizan en la electrónica, los semiconductores, la tecnología nuclear y otras industrias de precisión.