Положение элементов-неметаллов в Периодической системе химических элементов Д.И. Менделеева
· Элементы-неметаллы:
· s-элемент – водород;
· р-элементы 3 группы – бор;
· 4 группы – углерод и кремний;
· 5 группы – азот, фосфор и мышьяк,
· 6 группы – кислород, сера, селен и теллур
· 7 группы – фтор, хлор, бром, йод и астат.
Элементы 8 группы – инертные газы, занимают особое положение, они имеют полностью завершенный внешний электронный слой.
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями (принимают электроны) - являются фтор, кислород и хлор, преимущественно восстановительные свойства (отдают) проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
1. Взаимодействие с металлами:
2Na + Cl 2 = 2NaCl, Fe + S = FeS, 6Li + N 2 = 2Li 3 N, 2Ca + O 2 = 2CaO
в этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
2. Взаимодействие с другими неметаллами:
· взаимодействуя с водородом , большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H 2 + N 2 = 2NH 3 , H 2 + Br 2 = 2HBr;
· взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O 2 = SO 2 , 4P + 5O 2 = 2P 2 O 5 ;
· при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем: 2F 2 + O 2 = 2OF 2 ;
· неметаллы взаимодействуют между собой , более электроотрицательный металл играет роль окислителя, менее электроотрицательный – роль восстановителя: S + 3F 2 = SF 6 , C + 2Cl 2 = CCl 4 .
Галогены (7 группа)
Химические свойства галогенов.
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ ХЛОРА
· Хлорноватистая кислота HCl +1 O соли – гипохлориты
Существует только в виде разбавленных водных растворов.
Получение Cl2 + H2O = HCl + HClO
Химические свойства
HClO - слабая кислота и сильный окислитель:
1) Разлагается на свету, выделяя атомарный кислород HClO = HCl + O
2) Со щелочами дает соли – гипохлориты HClO + KOH = KClO + H2O
3) Взаимодействует с галогеноводородами 2HI + HClO = I2 + HCl + H2O
Хлористая кислота HClO2 (HClO2 - слабая кислота и сильный окислитель; соли хлористой кислоты – хлориты)
Химические свойства
1.HClO2 + KOH = KClO2 + H2O
2. Неустойчива, при хранении разлагается 4HClO2 = HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота HCl O3 (HClO3 - Сильная кислота и сильный окислитель; соли хлорноватой кислоты – хлораты)
KClO 3 - Бертоллетова соль ; ее получают при пропускании хлора через подогретый (40°C) раствор KOH:
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
Бертоллетову соль используют в качестве окислителя; при нагревании она разлагается:
4KClO 3 = KCl + 3KClO 4 (без катализатора)
2KClO 3 = 2KCl + 3O 2 (катализатор MnO 2)
Хлорная кислота HClO4 (HClO4 - очень сильная кислота и очень сильный окислитель; соли хлорной кислоты – перхлораты )
Получение KClO4 + H2SO4 = KHSO4 + HClO4
Химические свойства
1) Взаимодействует со щелочами HClO4 + KOH = KClO4 + H2O
2) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 = 4ClO2 + 3O2 + 2H2O KClO4 = KCl + 2O2
Халькогены (элементы VIA группы)
Кислород, S, Se, Te, Po. Название халькогены означает «рождающие руды». Соединения серы: пирит, или железный колчедан – FeS2, киноварь – HgS, цинковая обманка – ZnS.
На внешнем энергетическом уровне у халькогенов 6 электронов. До завершения внешнего энергетического уровня атомам не хватает 2 электрона, поэтому они присоединяют электроны и проявляют в своих соединениях степень окисления -2.
Атомы серы, селена и теллура в своих соединениях с более электроотрицательными элементами проявляют положительные степени окисления +2, +4 и +6.
Кислород n=8 1s 2 2s 2 2p 4
Кислород входит в состав таких руд, как корунд – Al2O3, магнитный железняк, – Fe3O4, красный железняк – Fe2O3, бурый железняк - Fe2O3 ·
Кислород в соединении с фтором – OF2 проявляет степень окисления +2. Кислород входит в состав атмосферы, где на его долю приходится 21%.
Получение кислорода.
· В промышленности кислород получают из жидкого воздуха.
· Кислород можно получить и при разложении воды в специальном устройстве – электролизёре.

· В лаборатории используют пероксид водорода (Н2О2). Эта реакция идёт в присутствии катализатора – оксида марганца IV
![]()
· в лаборатории ещё используют реакцию разложения перманганата калия – KMnO 4 – «марганцовки».

· В лабораторных условиях кислород выделяется кислород при нагревании бертолетовой соли (хлората калия)
2KClO 3 = 2KCl + 3O 2 Катализатор - оксид марганца (MnO 2).
кислород существует в виде двух аллотропных модификаций –O 2 и О 3 .
Химические свойства
Кислород не взаимодействует с галогенами, благородными газами, золотом и платиной.
· Кислород энергично реагирует с металлами. Например, в реакции с литием, образуется оксид лития, в реакции с медью – оксид меди (II).
4Li + O 2 = 2Li 2 O 2Cu + O 2 = 2CuO
· Кислород реагирует с неметаллами.
S + O 2 = SO 2 4P + 5O 2 = 2P 2 O 5
Почти все реакции с кислородом экзотермические (то есть сопровождаются выделением теплоты). Исключение составляет реакция азота с кислородом, которая является эндотермической.
N 2 + O 2 ↔ 2NO – Q
· Кислород сложные вещества.
CH 4 + 2O 2 = CO 2 + 2H 2 O 2H 2 S + 3O 2 = 2SO 2 + 2H 2 O
СЕРА n=16 1s 2 2s 2 2p 6 3s 2 3p 4
Химические свойства металлов
- Металлы реагируют с неметаллами.
- Металлы, стоящие до водорода, реагируют с кислотами (кроме азотной и серной конц.) с выделением водорода
- Активные металлы реагируют с водой с образованием щелочи и выделением водорода.
- Металлы средней активности реагируют с водой при нагревании, образуя оксид металла и водород.
- Металлы, стоящие после водорода, с водой и растворами кислот (кроме азотной и серной конц.) не реагируют
- Более активные металлы вытесняют менее активные из растворов их солей.
- Галогены реагируют с водой и раствором щелочи.
- Активные галогены (кроме фтора) вытесняют менее активные галогены из растворов их солей.
- Галогены не реагируют с кислородом.
- Амфотерные металлы (Al, Be, Zn) реагируют с растворами щелочей и кислот.
- Магний реагирует с углекислым газом и оксидом кремния.
- Щелочные металлы (кроме лития) с кислородом образуют пероксиды.
Химические свойства неметаллов
- Неметаллы реагируют с металлами и друг с другом.
- Из неметаллов с водой реагируют только наиболее активные – фтор, хлор, бром и йод.
- Фтор, хлор, бром и йод реагируют со щелочами по той же схеме, что и с водой, только образуются не кислоты, а их соли, и реакции не обратимы, а протекают до конца.

Изучай химические свойства
Неметаллы – химические элементы, которые имеют типичные неметаллические свойства и располагаются в правом верхнем углу Периодической системы. Какие же свойства присущи этим элементам, и с чем реагируют неметаллы?
Неметаллы: общая характеристика
Неметаллы отличаются от металлов тем, что на внешнем энергетическом уровне они имеют большее количество электронов. Поэтому их окислительные свойства выражены сильнее, чем у металлов. Неметаллы характеризуются высокими значениями электроотрицательности и высокий восстановительный потенциал.
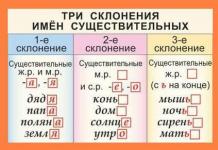
К неметаллам относятся химические элементы, которые находятся в газообразном, жидком или твердом агрегатном состоянии. Так, например, азот, кислород, фтор, хлор, водород – газы; йод, сера, фосфор – твердые; бром – жидкость (при комнатной температуре). Всего существует 22 неметалла.

Рис. 1. Неметаллы – газы, твердые, жидкости.
С увеличением заряда ядра атома наблюдается закономерность изменения свойств химических элементов от металлических к неметаллическим.
Химические свойства неметаллов
Водородные свойства неметаллов в основном являются летучими соединениями, которые в водных растворах имеют кислотный характер. Они имеют молекулярные структуры, а также ковалентную полярную связь. Некоторые, например, вода, аммиак или фтороводород образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Пример:
S+H 2 =H 2 S (до 350 градусов равновесие смещено вправо)
Все водородные соединения имеют восстановительные свойства, причем их восстановительная сила возрастает справа налево по периоду и сверху вниз в группе. Так, сероводород сгорает при большом количестве кислорода:
2H 2 S+3O 3 =2SO 2 +2H 2 O+1158 кДж.
Окисление может идти по другому пути. Так, уже на воздухе водный раствор сероводорода мутнеет в результате образования серы:
H 2 S+3O 2 =2S+2H 2 O
Соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты (оксокислоты). Структура оксидов типичных неметаллов молекулярная.
Чем выше степень окисления неметалла, тем сильнее соответствующая кислородосодержащая кислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Наиболее известны такие соли этих кислот, как хлорная известь CaOCl 2 (смешанная соль хлорноватистой и хлороводородной кислот), бертолетова соль KClO 3 (хлорат калия).
Азот в оксидах проявляет положительные степени окисления +1, +2, +3, +4, +5. Первые два оксида N 2 O и NO – несолеобразующие и являются газами. N 2 O 3 (оксид азота III) – является ангидридом азотистой кислоты HNO 2 . Оксид азота IV – бурый газ NO 2 – газ, который хорошо растворяется в воде, образуя при этом две кислоты. Этот процесс можно выразить уравнением:
2NO 2 +H 2 O=HNO 3 (азотная кислота)+HNO 2 (азотистая кислота) – окислительно-восстановительная реакция диспропорционирования

Рис. 2. Азотистая кислота.
Ангидрид азотной кислоты N 2 O 5 – белое кристаллическое вещество, которое легко растворяется в воде. Пример:
N 2 O 5 +H 2 O=2HNO 3
Соли азотной кислоты называются селитрами, они растворимы в воде. Соли калия, кальция, натрия используют для получения азотных удобрений.
Фосфор образует оксиды, проявляя степени окисления +3 и +5. Наиболее устойчивый оксид – фосфорный ангидрид P 2 O 5 , образующий молекулярную решетку, в узлах которой находятся димеры P 4 O 10 . Соли ортофосфорной кислоты применяются в качестве фосфорных удобрений, например, аммофос NH 4 H 2 PO 4 (дигидрофосфат аммония).
Таблица расположения неметаллов
| Группа | I | III | IV | V | VI | VII | VIII |
| Первый период | H | He | |||||
| Второй период | B | C | N | O | F | Ne | |
| Третий период | Si | P | S | Cl | Ar | ||
| Четвертый период | As | Se | Br | Kr | |||
| Пятый период | Te | I | Xe | ||||
| Шестой период | At | Rn |

Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Как видно из рисунка, подавляющее большинство элементов являются металлами.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-. Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН —) 2 , (Li +)2СO 3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga 2 , в твердом состоянии хлориды алюминия и ртути (II) АlСl 3 и НgСl 2 содержат сильно ковалентные связи, но в растворе АlСl 3 диссоциирует почти полностью, а НgСl 2 — в очень малой степени (да и то на ионы НgСl + и Сl —).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность . Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O 2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl 2 – t° → NiCl 2
4) С азотом:
3Ca + N 2 – t° → Ca 3 N 2
5) С фосфором:
3Ca + 2P – t° → Ca 3 P 2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H 2 → 2LiH
Ca + H 2 → CaH 2
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl 2 + H 2
2Al+ 6HCl → 2AlCl 3 + 3H 2
6Na + 2H 3 PO 4 → 2Na 3 PO 4 + 3H 2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H 2 SO 4(К) → ZnSO 4 + SO 2 + 2H 2 O
4Zn + 5H 2 SO 4(К) → 4ZnSO 4 + H 2 S + 4H 2 O
3Zn + 4H 2 SO 4(К) → 3ZnSO 4 + S + 4H 2 O
2H 2 SO 4(к) + Сu → Сu SO 4 + SO 2 + 2H 2 O
10HNO 3 + 4Mg → 4Mg(NO 3) 2 + NH 4 NO 3 + 3H 2 O
4HNO 3 (к) + Сu → Сu (NO 3) 2 + 2NO 2 + 2H 2 O
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H 2 O → 2NaOH + H 2
Ca+ 2H 2 O → Ca(OH) 2 + H 2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H 2 O – t° → ZnO + H 2
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl 2 → Hg+ CuCl 2
Fe+ CuSO 4 → Cu+ FeSO 4

В промышленности часто используют не чистые металлы, а их смеси - сплавы , в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь ) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией . Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их , т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО 2 и SО 2 ; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н 2 (водородная коррозия ).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении ; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь ), имеют высокую коррозионную стойкость.
электрометаллургия , т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
пирометаллургия , т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
гидрометаллургия , т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO 4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды ). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
Химические
свойства неметаллов
В соответствии с численными
значениями относительных электроотрицательностей окислительные способности неметаллов
увеличивается
в следующем порядке: Si, B, H, P, C, S, I, N, Cl,
O, F.
Неметаллы как окислители
Окислительные свойства неметаллов
проявляются при их взаимодействии:
· с металлами: 2Na + Cl 2 = 2NaCl;
· с водородом: H 2 + F 2 = 2HF;
· с неметаллами, которые имеют более низкую электроотрицательность: 2Р + 5S = Р 2 S 5 ;
· с некоторыми сложными веществами: 4NH 3 + 5O 2 = 4NO + 6H 2 O,
2FeCl 2 + Cl 2 = 2 FeCl 3 .
Неметаллы как восстановители1. Все неметаллы (кроме фтора) проявляют восстановительные свойства при взаимодействии с кислородом:
S + O 2 = SO 2 , 2H 2 + O 2 = 2H 2 О.
Кислород в соединении с фтором может проявлять и положительную степень окисления, т. е. являться восстановителем. Все остальные неметаллы проявляют восстановительные свойства. Так, например, хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl 2 O, ClO 2 , Cl 2 O 2), в которых хлор проявляет положительную степень окисления. Азот при высокой температуре непосредственно соединяется с кислородом и проявляет восстановительные свойства. Еще легче с кислородом реагирует сера.
2. Многие неметаллы проявляют восстановительные свойства при взаимодействии со сложными веществами:
ZnO + C = Zn + CO, S + 6HNO 3 конц = H 2 SO 4 + 6NO 2 + 2H 2 О .
3. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем и восстановителем:
Cl 2 + H 2 О = HCl + HClO.
4. Фтор ― самый типичный неметалл, которому нехарактерны восстановительные свойства, т. е. способность отдавать электроны в химических реакциях.
Соединения неметалловНеметаллы могут образовывать соединения с разными внутримолекулярными связями.
Виды соединений неметаллов
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблицe :
|
RH 2 |
RH 3 |
RH 4 |
RH 3 |
H 2 R |
||
|
Нелетучие водородные соединения
|
Летучие водородные соединения
|
|||||
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO 2 , N 2 O 5), а других ― более низкую (например, SO 2 , N 2 O 3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO 3 сильнее азотистой HNO 2 , а серная кислота H 2 SO 4 сильнее сернистой H 2 SO 3 .
Характеристики кислородных соединений неметаллов
1. Свойства высших оксидов (т. е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
3. Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
4. В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.