Инфекция, вызванная вирусом иммунодефицита человека, – серьезный диагноз. Ошибки при диагностике могут привести к плачевным последствиям. Анализ ИФА на ВИЧ – наиболее доступный метод исследования, но не во всех случаях он информативен.
ИФА – иммуноферментный анализ. Задача метода ИФА – выявление антител к вирусу иммунодефицита в биологическом материале. С помощью метода можно отследить присутствие в жидкости не самих вирусов, но только антител, вырабатывающихся в ответ на их присутствие. Иммуноферментный анализ широко используется при диагностике ЗППП. Он помогает выявить , передающиеся половым путем.
Существует несколько видов ИФА: прямой вариант, косвенный вариант, метод «сэндвича». В любом случае методика основана на определении наличия антител, которые служат индикатором проникновения чужеродного агента. Чтобы выявить эти «метки», биологический компонент обрабатывают ферментами.
Иммуноферментный анализ определяет антитела с точностью 96 – 98%, погрешность незначительна. Она составляет 2 – 4%.
ИФА – метод диагностики ВИЧ
ИФА анализ на ВИЧ – это первый этап диагностики. Антигенами вируса иммунодефицита являются протеины p24, p15, p17, p31 и гликопротеины gp 41, gp55, gp66, gp120, gp160.
Чтобы обнаружить вирусный белок, берут порцию крови из вены. Образец, направленный на исследование крови ИФА, обрабатывают иммуноферментными реагентами. Из крови выделяют сыворотку. Если в ходе исследования обнаруживаются , значит, в крови уже присутствует вирус.
Кровь сдают строго натощак. За 2 дня до анализа не рекомендуется есть жирную пищу и употреблять алкоголь. Следует за 14 дней прекратить прием противовирусных препаратов.
Преимущества метода:
- сравнительно небольшая стоимость;
- высокая стабильность реагентов;
- высокая чувствительность;
- короткий срок проведения;
- минимальное влияние человеческого фактора.
Современные тест-системы для ИФА производят по мировым стандартам. Это повышает точность метода.
Иммуноферментный анализ не всегда дает достоверные результаты. После попадания вируса в кровь начинается латентная (скрытая) стадия развития. Период, пока вирусы не начали размножаться, и антитела еще не сформированы, называется «время серонегативного окна». Делать ИФА на этом этапе бессмысленно. Если заражение произошло, результат будет . Как быстро вирус себя обнаружит, зависит от того, какое количество опасных клеток попало в организм. При незащищенном половом акте или переливании зараженной крови этот срок будет минимальным.
Для высокой достоверности ИФА на ВИЧ исследование проводят трижды. Сроки сдачи ИФА на вирус иммунодефицита человека:
- через 6 недель после вероятного контакта,
- через 3 месяца,
- спустя полгода.
ИФА 4 поколения на ВИЧ – метод, наиболее информативный на ранних сроках заражения. Его можно проводить уже через 1 месяц после предполагаемого инфицирования. Тест на является дорогостоящим по сравнению с аналогом 3-го поколения. Поэтому в государственных медучреждениях он используется как дополнительный метод диагностики. Бесплатно проводится тест 3. Если по его итогам однозначного ответа дать нельзя, пациента направляют на ИФА 4 поколения.
Важно! Сразу после инфицирования человек становится заразным. Он опасен для окружающих, даже когда еще не знает о своем диагнозе!
Если при ИФА выявлены антитела к антигенам ВИЧ, необходимо проводить дополнительные исследования. К таким относится . Достоверность этого метода – 80%. С помощью ПЦР исследуют кровь, сперму и влагалищные выделения. Биологическую жидкость расщепляют в медицинском реакторе, затем подвергают обработке ферментами. В итоге получают данные о том, какова концентрация клеток ВИЧ в жидкой среде. Из-за большой погрешности (20%) при положительном результате дополнительно проводят иммунный блоттинг.
Следующий этап диагностики – тест Комбо (или иммунный блоттинг). Это высокочувствительное исследование (98% достоверности), которое проводят, если через 6 месяцев результаты ИФА неоднозначны.
Расшифровка результатов ИФА
Время расшифровки составляет от 24 до 48 часов. Если необходимо получить информацию срочно (требуется хирургическое вмешательство), расшифровку проводят за 2 часа. В провинциальных медицинских пунктах не всегда есть необходимые реагенты. Пробу берут по месту обращения, затем ее передают в областной центр. При таких обстоятельствах итог можно узнать через 1- 2 недели.
Результат иммуноферментного анализа может быть либо положительным, либо отрицательным; других вариантов нет.
Даже если при первичном и повторных ИФА итог был положительным, пациента нельзя признать ВИЧ-инфицированным. Возможна погрешность. Причины ложноположительного результата:
- хронические заболевания;
- длительные инфекционные заболевания;
- беременность.
Поэтому результат анализа должен быть уточнен дополнительными исследованиями.
Если при проведении иммуноблоттинга на ВИЧ (реактивный), человек считается ВИЧ-инфицированным, а значит, что он здоров.
Клетки вируса со временем адаптируются к назначенным препаратам. Чтобы контролировать , тест ИФА периодически повторяют.
Иногда иммуноблоттинг показывает ложноотрицательный результат. Крайне редко вирус иммунодефицита 6 месяцев (и более) . Это возможно, если в кровь попало незначительное количество клеток вируса. В 0,5% от общего числа случаев диагностировать заражение удается лишь через год. В 99,5% в течение полугода после инфицирования при проведении ИФА получится достоверный результат.
Даже при проведении высокоточных исследований остается вероятность ошибки, составляющая 2%. Не следует забывать о человеческом факторе. Чтобы исключить вероятность ошибки, тест можно провести в 2-х разных учреждениях.
Для проведения комплексной оценки состояния организма применяется ИФА-метод проведения диагностики. Иммуноферментный анализ крови предназначен для диагностирования инфекционных, гематологических, первичных и вторичных иммунодефицитов.
Что такое анализ ИФА
Многие пациенты интересуются методом ИФА: что это, для чего проводится исследование. Иммуноферментный анализ начал использоваться сравнительно недавно. Изначально с его помощью изучались антигенные структуры, и он проводился только в научных целях. Затем ученые пришли к выводу, что при помощи ферментов можно выявить специфические антитела, возникающие в ответ на протекающее заболевание.
Изначально эта методика применялась только узкопрофильными медицинскими учреждениями, в основном на станциях переливания крови. Особое значение имеет метод ИФА для выявления ВИЧ-инфекции.
На сегодняшний день этот метод имеет широкую сферу применения. Современные лаборатории используют его для диагностирования:
- опухолей;
- гормональных нарушений;
- инфекций;
- хронических или перенесенных ранее инфекционных процессов;
- гельминтов.
Если в организме протекает инфекционный процесс, то этот вид диагностики считается наиболее оптимальным для определения типа заболевания.
Суть метода и его виды
Метод ИФА - что это, какова суть этого вида исследования? Этот и многие другие вопросы интересуют пациентов. Основой этого способа диагностики считается связывание иммунных клеток организма с антигенами возбудителей инфекции. Получившийся комплекс определяют при помощи специального фермента.

Чтобы понять принцип метода ИФА, нужно знать, как проходит реакция антиген-антитело. Антиген - чужеродная для организма молекула белкового происхождения, которая проникает вместе с инфекцией. Частички чужой крови, несовпадающие по группе, также считаются антигенами. В организме они провоцируют иммунную реакцию, направленную на защиту от чужеродных веществ. Поэтому тело человека вырабатывает антитела - иммуноглобулины, способные присоединяться к антигенам, образуя иммунный комплекс. Такие соединения намного легче распознаются и уничтожаются клетками иммунитета.
Реакцию на наличие таких иммунных комплексов проводят в лабораторных условиях, применяя уже готовые соединения, чтобы определить, есть ли в крови подобные им.
Суть метода ИФА достаточно простая, однако из-за того, что анализ крови проводится для выявления многих инфекций и болезней, существует несколько его разновидностей. Каждый отличается схемой проведения и областью применения. Может быть прямой или непрямой ИФА. Прямой метод подразумевает под собой то, что применяются обездвиженные антитела, реагирующие с антигенами. Основным плюсом такого метода является то, что все процессы можно автоматизировать, а значит, диагностика занимает немного времени.
Непрямой метод подразумевает, что применяются антитела вторичного характера. А на твердой фазе обездвиживается антиген. Анализ позволяет определить антитела к различным антигенам. Это помогает достигнуть более точного результата, однако метод отличается сложностью.
Преимущества исследования
Методом ИФА имеют множество преимуществ в сравнении с другими способами диагностики. К основным можно отнести такие:
- высокая чувствительность;
- стабильность при хранении ингредиентов;
- скорость проведения диагностики;
- можно применять небольшое количество исследуемого материала;
- есть возможность автоматизации всех процессов;
- можно выявить инфекцию на самых ранних стадиях.

Этот метод диагностики универсальный, поэтому подходит для проведения массового обследования. При помощи анализа есть возможность проследить динамику протекания инфекционного процесса.
Показания для анализа и забор материала
Проведение исследования при помощи метода ИФА могут назначить при подозрении на множество болезней:
На наличие антител исследуется венозная кровь. Перед проведением анализа из нее выделяют элементы, которые могут осложнять исследование. Может проводиться забор и других биологических жидкостей.

Чтобы получить наиболее точную информацию, забор крови проводится на голодный желудок. Если процедура была назначена для определения скрытой инфекции, то за несколько недель до проведения анализа нужно прекратить принимать антибактериальные и противовирусные препараты. В зависимости от оснащенности лаборатории, где проводился забор материала, результат можно получить в течение суток. В экстренных случаях это время сокращается до нескольких часов.
Анализ на сифилис
Использование метода ИФА помогает определить наличие многих инфекций в организме, в частности и сифилиса. Для проведения исследования берется кровь из вены натощак. Затем осуществляется исследование, помогающее определить не только наличие болезни в организме, но и точные сроки ее начала, так как в течение болезни одни антитела заменяются другими в строго определенном порядке.
При острой фазе, свидетельствующей о продолжительном течении болезни, или при обострении хронической инфекции в крови будут обнаружены иммуноглобулины типа M. Наличие иммуноглобулинов типа A свидетельствует о том, что инфекция обитает в организме более 4 недель. Иммуноглобулины группы G говорят о разгаре болезни или о ранее проведенной терапии.

По степени окраса лунок оценивают интенсивность протекания инфекционного процесса, так как его насыщенность зависит от количества образовавшихся иммунных комплексов.
Анализ на ВИЧ-инфекцию
ИФА-метод применяется и для проведения анализа на в таком случае имеет определенные особенности, которые связаны с протеканием и прогрессированием болезни. Этот метод исследования считается наиболее приемлемым для определения, однако проводить его нужно не ранее чем через месяц после воздействия факторов риска. Это связано с наличием инкубационного периода, протекающего от 45 дней и до 6 месяцев. Именно поэтому анализ нужно повторить через полгода.
- аскаридоз;
- лямблиоз;
- токсоплазмоз и др.

Несмотря на все преимущества, существуют также недостатки метода ИФА. Основным недостатком считается то, что при проведении исследования доктор должен заранее иметь предположение о заболевании.
При нет возможности случайно найти возбудителя и определить его иммуноферментные свойства. Тест только указывает на наличие антител в крови больного. Кроме того, это достаточно дорогостоящий анализ.
Расшифровка анализа
Результатом качественного ИФА будет либо наличие антител, либо их отсутствие в крови. Если проводится количественный анализ, то концентрация антител может выражаться или в цифровом значении, или в определенным количеством знаков +.
Кроме того, анализируются такие показатели, как:
Показатель IgM указывает на протекание острого инфекционного процесса в организме. Полное его отсутствие может говорить об отсутствии возбудителя болезни или переходе ее в хроническую стадию.

Показатель IgA при отрицательном результате теста на IgM говорит о хронической или скрытой инфекции. Одновременное присутствие IgM и IgA свидетельствует о том, что болезнь находится в острой стадии. Наличие IgG говорит о переходе болезни в хроническую стадию или о полном выздоровлении и выработке иммунитета.
Сейчас существуют специальные тесты ИФА, которые можно провести самостоятельно.
ИФА (иммуноферментный анализ, ELISA – англ.) вошел в жизнь практической медицины еще где-то в 60-х прошлого столетия. Первоначальной его задачей были гистологические исследования в научных целях, которые сводились к поиску и идентификации антигенной структуры клеток живого организма.
В основе метода ИФА лежит взаимодействие специфических (АТ) и родственных антигенов (АГ) с образованием комплекса «антиген – антитело» , который выявляют при помощи фермента. Этот факт натолкнул ученых на мысль, что метод может быть использован в диагностических целях для выявления специфических иммуноглобулинов различных классов, участвующих в иммунном ответе на ту или иную инфекцию. И это был прорыв в клинической лабораторной диагностике!
Активно использоваться метод начал только в начале 80-х и то, в основном, в специализированных учреждениях. Первыми иммуноферментными анализаторами были снабжены центры и станции переливания крови, инфекционные и венерологические стационары, поскольку рожденный на африканском континенте, появившийся на горизонте у нас и тут же примкнувший к «старым» инфекциям грозный СПИД, требовал незамедлительных мер диагностики и поиска лечебных препаратов, воздействующих на него.
Область применения метода ИФА
Возможности иммуноферментного анализа поистине обширны. Теперь и представить себе трудно, как можно обойтись без подобных исследований, применяемых буквально во всех отраслях медицины. Кажется, что может сделать ИФА в онкологии? Оказывается, может. И многое. Способность анализа находить маркеры, свойственные некоторым видам злокачественных новообразований, лежит в основе раннего выявления опухоли, когда другим способом она еще не определяется из-за своих небольших размеров.
 Современная клиническая лабораторная диагностика (КДЛ), кроме онкомаркеров, располагает значительным арсеналом панелей для ИФА и использует их для диагностики различных патологических состояний (инфекционных процессов, гормональных нарушений) и мониторинга фармацевтических лечебных препаратов с целью выявления их влияния на организм больного и, кстати, не только человека. В настоящее время иммуноферментный анализ широко используется и в ветеринарной службе, ведь «братья наши меньшие» тоже подвержены многим заболеваниям, от которых, порой, очень сильно страдают.
Современная клиническая лабораторная диагностика (КДЛ), кроме онкомаркеров, располагает значительным арсеналом панелей для ИФА и использует их для диагностики различных патологических состояний (инфекционных процессов, гормональных нарушений) и мониторинга фармацевтических лечебных препаратов с целью выявления их влияния на организм больного и, кстати, не только человека. В настоящее время иммуноферментный анализ широко используется и в ветеринарной службе, ведь «братья наши меньшие» тоже подвержены многим заболеваниям, от которых, порой, очень сильно страдают.
Таким образом, ИФА, благодаря своей чувствительности и специфичности, по образцу крови, взятому из вены, может определить:
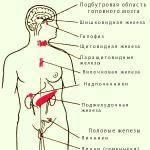
- Гормональный статус (гормоны щитовидной железы и надпочечников, половые гормоны);
- Присутствие вирусной и бактериальной инфекции (ВИЧ, В и С, хламидиоз, сифилис, и , и , а также многие другие болезни, вызванные патогенными микроорганизмами);
- Следы жизнедеятельности микроорганизмов, возбудивших инфекционный процесс, который благополучно закончился и перешел в стадию формирования иммунного ответа на этот возбудитель. Такие следы, то есть, антитела, во многих случаях остаются циркулировать в крови пожизненно, чем защищают человека от повторного заражения.
В чем суть ИФА?
Иммуноферментный метод, позволяет определить не только присутствие самого возбудителя (качественный анализ), но и его количественное содержание в сыворотке крови больного.
Вирусовая или бактериальная доза существенно влияет на течение инфекционного процесса и его исход, поэтому количественному анализу отведена не последняя роль в диагностике и лечении заболеваний в различных формах и стадиях.
Однако зная иммуноферментные исследования, как метод ИФА, мы даже не задумываемся, как же ему удается охватить такой широкий круг микроорганизмов, населяющих нашу планету, многие из которых несут прямую угрозу здоровью и жизни человека и животных. А дело в том, что ИФА имеет много вариантов (неконкурентный и конкурентный – прямой и непрямой), каждый из которых решает свою задачу и, таким образом, позволяет проводить целенаправленный поиск.
Для выявления иммуноглобулинов того или иного класса используется традиционная 96-луночная полистироловая панель (планшет), в лунках которой в твердой фазе сосредоточены сорбированные рекомбинантные белки. Попавшие в лунку с сывороткой крови антитела или антигены, находят «знакомый» объект и образуют с ним комплекс (АГ – АТ), который, закрепившись ферментным конъюгатом, при считывании результатов проявится изменением окраски лунки.

Иммуноферментный анализ проводится на тест-системах определенной специфичности, изготовленных в специальных лабораториях и укомплектованными всеми необходимыми реагирующими компонентами. Исследования можно проводить с помощью промывных аппаратов («вошеров») и считывающих спектрофотометров, где большей частью задействован ручной труд. На полных автоматах, освобождающих лаборанта от монотонного закапывания, промывания и прочих рутинных дел, конечно, работать быстрее и удобнее, но не все лаборатории могут позволить себе такую роскошь и продолжают работать по старинке – на полуавтоматах.
Интерпретация результатов ИФА находится в компетенции врача лабораторной диагностики, при этом обязательно берется в расчет и присущее практически всем иммунохимическим реакциям свойство давать ложноположительные или ложноотрицательные ответы.
Видео: современное проведение иммуноферментного анализа
Результаты ИФА на примере сифилиса
Иммуноферментный анализ подходит для выявления всех форм , а, кроме этого, применяется в проведении скрининговых исследований. Для проведения анализа используют венозную кровь пациента, взятую натощак. В работе используются планшеты с определенной специфичностью (АТ классов А, М, G) или суммарные антитела.

Учитывая то, что АТ при сифилисе продуцируются в конкретной последовательности, ИФА может легко ответить на вопрос, когда произошло заражение и в какой стадии находится процесс, а расшифровка полученных результатов может быть представлена в следующем виде:
- IgM указывают на продолжительность инфекционного процесса (могут появляться при обострении хронических воспалительных заболеваний);
- IgA констатируют, что заражение случилось более месяца назад;
- IgG свидетельствуют о том, что инфекция находится в самом разгаре или о проведенном недавно лечении, что легко выясняется при сборе анамнеза.
При проведении анализа на сифилис, лунки с отрицательным ответом (и отрицательный контроль) останутся бесцветными, в то время как положительный результат (как и положительный контроль) даст ярко-желтое окрашивание за счет изменения цвета хромогена, добавленного в ходе исследования. Однако интенсивность окраски не всегда совпадает с контролем, то есть, она может быть немного бледнее или слегка желтоватой. Это сомнительные результаты, которые, как правило, подлежат повторному исследованию с обязательным учетом количественных показателей, полученных на спектрофотометре, но в целом, окраска находится в прямо пропорциональной зависимости от количества иммунных комплексов (связанные между собой АГ и АТ).
Самый волнительный из иммуноферментных анализов – ИФА на ВИЧ
Анализ на , пожалуй, больше других интересен широкому кругу населения, ведь пока нельзя с уверенностью утверждать, что исчезли многие социальные проблемы (проституция, наркомания и др.). К сожалению, ВИЧ затрагивает не только эти слои человеческого общества, заразиться можно при различных обстоятельствах, не связанных с половой распущенностью или приемом наркотиков. Но коль возникла необходимость обследования на ВИЧ, то бояться не следует, что все вокруг узнают о посещении такой лаборатории. Сейчас ВИЧ-инфицированные люди защищены законом, а сомневающиеся могут обратиться в анонимные кабинеты, где можно решить проблему, не боясь огласки и осуждения.
Иммуноферментный метод, применяемый для диагностики ВИЧ инфекции, относится к первостепенным стандартным исследованиям, которые, однако, требуют особых условий, поскольку тема очень деликатная.
ИФА на ВИЧ имеет смысл проводить после полового контакта, переливания крови, других медицинских манипуляций , предполагающих заражение, и по окончании инкубационного периода («серонегативное окно»), но следует учитывать, что этот промежуток времени не является постоянным. Он может закончиться через 14-30 дней, а может продолжаться до полугода, поэтому средним значением принято считать интервал от 45 до 90 дней. На ВИЧ кровь сдают так же, как и на другие инфекции – из вены на голодный желудок. Результаты будут готовы в зависимости от накопления материала в лаборатории и ее загруженности (от 2 до 10 дней), хотя чаще всего лаборатории обеспечивают получение ответа в тот же день или на следующий.
Что можно ожидать от результатов на ВИЧ?
 ИФА на ВИЧ-инфекцию определяет антитела к двум разновидностям вируса: ВИЧ-1 (более распространенный в России и других странах Европы и Азии) и ВИЧ-2 (встречающийся чаще на территории Западной Африки).
ИФА на ВИЧ-инфекцию определяет антитела к двум разновидностям вируса: ВИЧ-1 (более распространенный в России и других странах Европы и Азии) и ВИЧ-2 (встречающийся чаще на территории Западной Африки).
Задачей ИФА ВИЧ является поиск АТ класса G, которые выявляются на всех тест-системах, но в более позднем периоде, и АТ классов А и М, выявляемых на рекомбинантных тест-наборах нового поколения, позволяющих найти антитела на самых ранних стадиях (инкубационный период – «серонегативное окно»). От ИФА можно ожидать следующие варианты ответов:
- Первичный положительный результат: кровь подлежит перепроверке на тест-системе такого же типа, но по возможности другой серии и другим человеком (лаборантом);
- Повторный (+) предполагает новый забор крови у пациента с исследованием ее подобно первичному анализу;
- Очередной положительный результат подлежит референтному анализу, при котором используются высокоспецифичные тест-наборы (2-3 шт.);
- Положительный результат в обеих (или в трех) системах направляется на иммуноблотинг (тот же ИФА, но выполненный в индивидуальном порядке на тест наборах особо высокой специфичности).
Заключение о ВИЧ инфицировании выносится только на основании иммуноблотинга. Проводится беседа с инфицированным в условиях полной конфиденциальности. Разглашение медицинской тайны в России, как, впрочем, и в других странах, подлежит уголовному наказанию.
Анализы на хламидии и цитомегаловирус иммуноферментным методом также обрели особую популярность, ввиду того, что позволяют определить время заражения, стадию заболевания и эффективность лечебных мероприятий.

При внедрении тоже можно наблюдать появление антител различных классов в разных фазах патологического состояния, вызванного инфекционным агентом:
- IgM могут обнаружиться уже дней через семь после заражения;
- IgA говорят о том, что инфекция в организме живет уже более месяца;
- IgG подтверждают диагноз хламидиоза, помогает следить за лечением и определить его действенность. Следует заметить, что антитела класса G остаются и циркулируют в организме независимо от давности болезни, поэтому для правильной расшифровки анализа нужно принимать во внимание референтные значения (нормы), которые, кстати, для каждой КДЛ свои: с учетом марки тест-системы и специфичности реагентов, входящих в набор. Значения нормы вписываются в бланк рядом с результатом ИФА.
Что касается , то здесь несколько иначе: антитела класса М появляются приблизительно через месяц-полтора, то есть, положительным результат (IgM+) становится в фазе первичного инфицирования или при реактивации скрытой инфекции и остается таковым от 4 месяцев до полугода.
Наличие АТ класса G характерно для начала первичной острой инфекции или реинфекции. Анализ констатирует, что вирус имеет место, однако информации, в какой стадии находится инфекционный процесс – не дает. Между тем, определение нормы титра IgG тоже вызывает затруднения, так как она целиком зависит от иммунного статуса конкретного человека, который, впрочем, устанавливается выявлением иммуноглобулинов класса G. Учитывая такое поведение антител, при диагностике ЦМВИ возникает необходимость в оценке способностей антител класса G взаимодействовать с ЦМВ, чтобы потом «обезвредить» его (авидность АТ). На начальном этапе болезни IgG очень плохо связываются с антигенами вируса (низкая авидность) и лишь потом начинают проявлять активность, стало быть, можно говорить о повышении авидности антител.

О достоинствах иммуноферментного анализа можно говорить долго и много, ведь этот метод сумел решить многие диагностические задачи, используя лишь венозную кровь. Не нужно долгих ожиданий, волнений и проблем с забором материала для исследования. К тому же тест-системы для ИФА продолжают совершенствоваться и не за горами тот день, когда тест выдаст 100% достоверность результата.
Видео: учебный фильм МГМУ им. Сеченова об основах ИФА
А.П. ОБРЯДИНА, Т.И. УЛАНОВА
ООО «Научно-производственное объединение «Диагностические системы»,
Нижний Новгород
ИММУНОФЕРМЕНТНЫЕ ТЕСТ-СИСТЕМЫ «ДС-ИФА-HBeAg» и «ДС-ИФА-анти-HBe» ДЛЯ СПЕЦИФИЧЕСКОЙ ДИАГНОСТИКИ И ПРОГНОЗИРОВАНИЯ ИСХОДОВ ОСТРОГО И ХРОНИЧЕСКОГО ГЕПАТИТА В
Гепатит В – вирусное инфекционное заболевание, характеризующееся тяжелым
воспалительным поражением печени . Около 1% летальных исходов наблюдается в
острый период болезни, в 4-10 % случаев происходит трансформация в хронический
процесс с возможным формированием в последующем цирроза печени и первичной
гепатокарциномы .
Несмотря на тенденцию к снижению заболеваемости острым гепатитом В, продолжает формироваться опасная в эпидемиологическом плане группа больных, которым впервые поставлен диагноз «хронический вирусный гепатит», а также группа носителей возбудителя заболевания. Сохраняется неблагополучный прогноз, связанный с высокой заболеваемостью гепатитом В среди населения репродуктивного возраста, а также среди подростков .
Поэтому, сейчас особенно актуальны вопросы лечения, профилактики и диагностики гепатита В. В настоящее время для детекции маркеров этой инфекции широко применяются методы иммуноферментного анализа. К числу важнейших серологических маркеров ВГВ относятся е-антиген (HBeAg) и антитела к е-антигену (анти-HBe). HBeAg ассоциируется с высокой инфицированностью крови, свидетельствуя об активной репликации вируса гепатита В (HBV). Установлено, что высокие титры HBeAg соответствуют высокой ДНК-полимеразной активности и всегда сочетаются с обнаружением полных частиц Дейна . При попадании сыворотки, содержащей HBeAg, в кровь здорового человека опасность заражения на много порядков выше, чем после наступления сероконверсии.
При остром гепатите В HBeAg обнаруживается в крови на ранних этапах инфекционного процесса уже при первых клинических проявлениях болезни, отставая на неделю от появления HBsAg. Острый гепатит В (ОГВ) циклического течения характеризуется кратковременной циркуляцией HBeAg. Вскоре, на 2-3 неделе желтушного периода появляются анти-HBe, что позволяет прогнозировать благоприятный исход заболевания .
Анти-HBe циркулируют в крови на протяжении 2-5 лет, реже несколько месяцев.
Наступление сероконверсии HBeAg-антиHBe знаменует резкое снижение активности
инфекционного процесса . Обнаружение HBeAg в крови пациентов после 2-х месяцев заболевания обозначает хронизацию патологического процесса . В этом случае анти-HBe могут образовываться спустя много лет после появления антител к HBcAg или вовсе не выявляться.
Появление анти-HBe может иметь неблагоприятное прогностическое значение в
остром периоде ВГВ при тяжелых формах, что соответствует мутации в pre-core зоне с
образованием HBV «e-» штамма .
Целью данной работы была разработка высокочувствительных и специфичных
иммуноферментных тест-систем для выявления HBeAg и анти-HBe и оценка их основных характеристик.
Материалы и методы.
1. Иммуноферментная тест-система «ДС-ИФА-HВeAg». Действующим началом теста
являются поликлональные антитела козы к рекомбинантному HBeAg, производства НПО «Диагностические системы», Нижний Новгород, сорбированные на твердую фазу, и конъюгат, представляющий собой поликлональные антитела козы к рекомбинантному HBeAg, меченные пероксидазой хрена, производства НПО «Диагностические системы», Нижний Новгород. Схема проведения анализа представляет собой одностадийный «сэндвич».Общая продолжительность реакции 1,5 часа. Образец сыворотки анализируется неразведенным.
2. Иммуноферментная тест-система «ДС-ИФА-анти-HBe». Основу теста составляют
рекомбинантный HBeAg (AHBV 102), производства НПО «Диагностические системы»,
Нижний Новгород, сорбированный на твердой фазе и конъюгат анти-IgG с пероксидазой хрена, производства «Сорбент Сервис», Москва. Реакция проходит в две стадии. К иммобилизованному антигену добавляют исследуемую сыворотку в разведении 1/10 и, после инкубации и удаления не связавшихся компонентов, проводят выявление специфических иммунокомплексов с помощью мышиных моноклональных антител против IgG человека, меченных пероксидазой хрена.
3. Для оценки разработанных тест-систем было использовано 2178 образцов сывороток
крови. Из них 480 образцов сывороток здоровых доноров. 1680 образцов представляют
собой образцы сывороток крови, содержащие различные маркеры вируса гепатита В.
Восемнадцать образцов были получены в динамике от больных с клиническим диагнозом «острый вирусный гепатит В». Предварительно все образцы были проверены на наличие HBsAg, HBeAg, анти-HBe, анти-HBc с помощью тест-систем производства НПО «Диагностические системы», Нижний Новгород: «ИФА-НВsAg/m», «ДС-ИФА-НВеAg», «ДС-ИФА-анти-HBe», «ИФА-анти-НВс».
4. Сравнительную оценку разработанных тест-систем осуществляли с помощью
коммерческого препарата «Monolisa HBe», производства BIO-RAD, Франция;
Результаты и обсуждение. В НПО «Диагностические системы» разработаны 2 новых диагностикума: «ДС-ИФА-HBeAg» и «ДС-ИФА-анти-HBe». Тест-система «ДС-ИФА-HBeAg» предназначена для выявления е-антигена вируса гепатита В в сыворотке (плазме) крови людей методом иммуноферментного анализа и может быть использована для специфической диагностики, определения активности инфекционного процесса, прогнозирования тяжести и исхода гепатита В.
Тест-система «ДС-ИФА-анти-HBe» предназначена для выявления антител класса IgG к е-антигену вируса гепатита В в сыворотке (плазме) крови человека и может быть
использована при прогнозе течения инфекционного процесса и контроле проводимой терапии при гепатите В.
Для изучения специфичности новых тестов была проведена оценка распределения
оптической плотности (ОП) образцов сывороток крови, содержащих и не содержащих
НВeАg или анти-НВе. Были использованы образцы сывороток крови здоровых доноров и образцы сывороток крови, отобранные по различным маркерам вируса гепатита В на
станциях переливания крови. Результаты исследования показали достоверное разделение двух популяций. Значения ОП образцов сывороток, не содержащих НВеАg, колебались в пределах от 0,011 до 0,111, а основной пик образцов сывороток, содержащих НВеАg находился в пределах от 2,186 до 3,186 (рисунок 1а).
Рис.1a. Распределение ОП образцов сывороток, содержащих и не содержащих
HBeAg
в тест-системе «ДС-ИФА-
HBeAg
»
Пик, соответствующий группе сывороток с низкой ОП (0,3-0,6), вероятно, составляют образцы сывороток, отобранные на ранних этапах инфекционного процесса.
Уже в инкубационном периоде у больных закономерно регистрируются в крови НВsAg и НВеАg, что подтверждает их потенциальную эпидемиологическую опасность.
Диапазон оптической плотности образцов сывороток, не содержащих анти-НВе
находился в пределах от 0,002 до 0,122, а основной пик ОП образцов сывороток, содержащих анти-НВе, находился в пределах от 2,431 до 3,231(рисунок 1б).

Рис. 1б. Распределение ОП образцов сывороток, содержащих и не содержащих анти-Н
Be
, в тест-системе «ДС-ИФА-анти-
HBeAg
»
Были изучены особенности распределения ОП анти-НВе положительных образцов
сывороток, содержащих (n
=78) и не содержащих HВsAg (n
=56). 
Рис. 2а. HBe
-положительных образцов сывороток, содержащих
HBsAg
в тест-системе «ДС-ИФА-анти-
HBe
».

Рис.2б. Особенности распределения ОП анти-
HBe
-положительных образцов сывороток, не содержащих
HBsAg
в тест-системе
«ДС-ИФА-анти-
HBe
».
Оптические плотности 87% анти-HBe-позитивных образцов сывороток, не содержащих HВsAg, находились в пределах от 0,41до 0,81 (рисунок 2б). При этом лишь у 14% анти-HBe-положительных образцов сывороток, содержащих HВsAg, ОП была в этом диапазоне (рисунок 2а). Известно, что в фазу поздней реконвалесценции при отрицательной реактивности на НВsAg постепенно происходит снижение титров антител к НBеAg (рисунок 2б). Поэтому, возможно, преимущественная концентрация анти-НВе-положительных образцов соответствовала ОП меньше 0,8.
Полученные данные свидетельствуют о достоверности разделения положительных и
отрицательных образцов сывороток крови независимо от стадии заболевания. Изучение чувствительности и специфичности тест-систем «ДС-ИФА-HBeAg» и «ДС-ИФА-антиHBe» проводили в сравнении с тестом «Monolisa HBe» («BIORAD»,Франция) (таблица 1).
Таблица 1
Сравнительная характеристика чувствительности и специфичности
тест-систем ДС-ИФА-HВeAg и ДС-ИФА-антиHB
| Показатель | Определение HВeAg | Определение антиHBe |
||
| НПО «ДС», ДС-ИФА-HВeAg | «BIO-RAD», «Monolisa HВe» | НПО «ДС», ДС-ИФА-антиHBe | «BIO-RAD», |
|
| Количество исследованных образцов | 67 | 67 | 32 | 32 |
| Выявлено положительных образцов | 47 | 47 | 16 | 16 |
| Выявлено отрицательных образцов | 20 | 20 | 16 | 16 |
Данные, приведенные в таблице 1, показывают, 100%-ное совпадение результатов.
Известно, что дополнительное прогностическое значение имеет сочетанная индикация НВеАg и анти-НВе, особенно их количественная оценка. Быстрое нарастание титра анти-НВе характеризует активный гуморальный иммунный ответ и практически исключает угрозу хронизации . Нами проанализировано изменение содержания НВеАg/анти-НВе в образцах сывороток крови пациентов с клиническим диагнозом «острый вирусный гепатит В» (таблица 2).
Таблица 2
Динамика сероконверсии НВеАg/анти-НВе у больных ОГВ
| Обследуемый больной | День отбора крови* | НВеАg | анти-НВе ОПобр./ОПкр. | Анти-HBc | Анти- HBc IgM |
|
| 1 | 1,4+ | 2,1+ | + | + | + |
|
| 12 | 0,5- | 1,0+ | + | + | + |
|
| 21 | 0,3- | 1,3+ | + | + | + |
|
| 1 | 1,2+ | 1,2+ | + | + | + |
|
| 5 | 0,4- | 1,0+ | + | + | + |
|
| 13 | 0,2- | 2,5+ | + | + | + |
|
| 1 | 1,2+ | 0,6- | + | + | + |
|
| 21 | 0,2- | 4,6+ | + | + | + |
|
| 30 | 0,2- | 9,7+ | + | + | + |
|
| 1 | 2,1+ | 0,5- | + | + | + |
|
| 8 | 0,6- | 1,1+ | + | + | + |
|
| 28 | 0,3- | 2,8+ | + | + | + |
|
| 1 | 0,7- | 2,2+ | + | + | + |
|
| 8 | 0,3- | 2,2+ | + | + | + |
|
| 15 | 0,3- | 2,8+ | + | + | + |
|
| 38 | 0,2- | 3,0+ | + | + | + |
|
| 6 | 1 | 1,1+ | 4,4+ | + | + | + |
| 14 | 0,5- | 3,8+ | + | + | + |
* от поступления в стационар
Все образцы сывороток были исследованы на наличие серологических маркеров
ОГВ: НВsAg, анти-НВс, анти-НВс IgM. Период наблюдения варьировал от 13 до 38 дней. У больных №1, №2 и №6 анти-НВе обнаружены уже на фоне снижения титра НВеАg. У пациентов №3 и №4 анти-НВе появились после исчезновения из сыворотки крови НВеАg на 21 и 8 день соответственно. Анализ детекции НВеАg в сыворотке крови пациента №5 при поступлении в стационар показал отрицательный результат. При этом была зарегистрирована конверсия на анти-НВе уже в первый день обследования.
У всех обследуемых прослежена тенденция к увеличению титра антител к НВеАg в
сыворотке крови, что позволяет прогнозировать благоприятную динамику клинических
проявлений ОГВ и скорое выздоровление.
Проведенное изучение новых тест-системы показало их высокую диагностическую надежность. Результаты сравнения ДС-ИФА-HBeAg» и «ДС-ИФА-антиHBe» показали 100% совпадение с тестом «Monolisa HBe».
При исследовании образцов сывороток больных гепатитом В в динамике, тесты
подтвердили высокую чувствительность и специфичность.
Короткое время инкубации исследуемых образцов и конъюгата (1 ч) позволяет в минимальные сроки определить правильную тактику проведения лечебных мероприятий. Созданные тест-системы удобны в постановке, экономичны (требуется 50 мкл сыворотки для определения HBeAg и 10 мкл сыворотки для определения анти-HBe). Высокие качественные характеристики тестов позволяют успешно использовать их при прогнозе течения инфекционного процесса и контроле проводимой терапии при гепатите В.
ЛИТЕРАТУРА
1.Майер К.П. Гепатит и последствия гепатита / К.П. Майер.– М., ГЕОТАР, Медицина,1999.- C.720
2.Онищенко Г.Г. Распространение вирусных гепатитов как угроза национальной безопасности / Г.Г. Онищенко, Л.А. Дементьева // Журнал микробиологии. –2003.-№ 4.- С.93-99.
3.Соринсон С.Н. Вирусные гепатиты / С.Н.Соринсон. - Санкт-Петербург, Теза, 1997.- 306 С.
4. Baumeister M. Hepatitis B Virus e Antigen Specific Epitopes and Limitations of Commercial Anti-HВe Immunoassays / M. Baumeister // Journal of Medical Virology.- 2000.-N 60.- Р.256-263.
5.Kane M. Global program for control of hepatitis B infection / M. Kane// Vaccine. – 1995.-N131(Suppl. 1).- Р.47-6. Shunichi Sat о . Hepatitis B Virus Strains with Mutations in the Core Promoter in Patients with Fulminant Hepatitis / Shunichi Sato, Kazuyuki Suzuki // Annals of Internal Medicine. – 1995.- N122.- Р.241-248.
7. Ou J.- Н . Molecular biology of hepatitis B virus e antigen./ J.-Н.Ou // Journal of Gastroenterology and Hepatology. – 1997.- № 12 (Suppl.1)- Р. 178- 187.
8.Tiollais P.
The hepatitis B virus. / P.Tiollais, C.Pourcel, A.Dejean // Nature. – 1985. – P.317, 489-495
Опубликовано: Ж. «Клиническая лабораторная диагностика» - 2005.-№6-С.-34-37
1 Назначение набора
1.1 Набор предназначен для одновременного выявления антител к вирусу иммунодефицита человека первого и второго типов (ВИЧ-1 и ВИЧ-2) и антигена р24 ВИЧ-1 в сыворотке и плазме крови человека “in vitro” методом непрямого твердофазного иммуноферментного анализа.
2 Характеристика и принцип работы набора
2.1 Состав набора:
|
Наименование компонента |
Количество |
|
Иммуносорбент |
2 планшета |
|
Положительный контрольный образец АТ (К + АТ) |
1 флакон, 3 мл |
|
Положительный контрольный образец АГ (К + АГ) |
3 флакона, лиофилизованный препарат |
|
Отрицательный контрольный образец (К –) |
2 флакона по 3 мл |
|
Раствор конъюгата №1 (РК-1) |
1 флакон, 12 мл |
|
Конъюгат №2 (Кг-2) |
1 флакон, 1 мл |
|
Раствор для разведения конъюгата №2 (РР-К2) |
2 флакона по 18 мл |
|
Буферный раствор для субстрата (БРС ) |
2 флакона по 18 мл |
|
Хромоген ТМБ |
1 флакон, 1 мл |
|
Концентрат фосфатно-солевого буферного раствора с твином (ФСБ-Т×25) |
2 флакона по 50 мл |
|
Стоп-реагент |
1 флакон, 12 мл |
|
Комплект ванночки для реагентов с наконечниками для многоканальных пипеток |
1 комплект |
|
Клейкая пленка |
2.2 Основные компоненты набора " ИФА-HIV 1,2 AGAT " – иммуносорбент, раствор конъюгата №1 и конъюгат №2.
Иммуносорбент представляет собой полистироловый планшет, в лунках которого сорбирована смесь рекомбинантных антигенов ВИЧ-1 (gp41) и ВИЧ-2 (gp36) и моноклональных антител к антигену р24 ВИЧ-1.
Раствор конъюгата №1 представляет собой смесь меченых биотином моноклональных человеческих антител против антигена р24 ВИЧ-1 и меченых биотином рекомбинантных белков ВИЧ-1 и ВИЧ-2.
Конъюгат №2 представляет собой стрептавидин, конъюгированный с пероксидазой хрена.
Положительный контрольный образец АТ – сыворотка крови человека, содержащая антитела к ВИЧ-1 и ВИЧ-2, не содержащая антитела к вирусу гепатита С и Treponema pallidum, антиген р24 ВИЧ-1 и НВs-антиген, инактивированная прогреванием в течение 3 ч при температуре 56 ºC.
Положительный контрольный образец АГ – сыворотка крови человека содержащая нативный антиген р24 ВИЧ-1, не содержащая антитела к ВИЧ-1, ВИЧ-2, вирусу гепатита С и Treponema pallidum и НВs-антиген, инактивированная прогреванием в течение 3 ч при температуре 56 ºC.
Отрицательный контрольный образец – сыворотка крови человека, не содержащая антитела к ВИЧ-1, ВИЧ-2, ВГС, антиген р24 ВИЧ-1 и НВs-антиген, инактивированная прогреванием в течение 3 ч при температуре 56 ºC.
Принцип работы набора. При внесении в лунки планшета раствора конъюгата №1 и образцов сывороток инфицированной крови антиген р24 связывается как со специфическими антителами на твердой фазе, так и с моноклональными биотинилированными анти-р24 антителами, входящими в состав раствора конъюгата №1; ВИЧ-специфические антитела связываются как с рекомбинантными антигенами ВИЧ-1 и ВИЧ-2, сорбированными на твердой фазе, так и с антигенами, входящими в состав раствора конъюгата №1, образуя комплексы антиген-антитело. Иммунные комплексы анти-р24 специфических антител и антигена р24 выявляются конъюгатом №2. После отмывания несвязавшихся компонентов в лунки планшета добавляют раствор субстрата пероксидазы (перекись водорода) и хромогена ТМБ.
Пероксидазную реакцию останавливают, добавляя стоп-реагент (0,9 М раствор серной кислоты), и интенсивность окрашивания раствора в лунках измеряют на спектрофотометре как величину оптической плотности (ОП) при длине волны 450 нм.
Величина ОП прямо пропорциональна концентрации специфических антител и/или антигена р24 в образце сыворотки или плазмы. Чем выше содержание антител и/или антигена р24 в образце сыворотки, тем выше интенсивность окрашивания.
2.3 Набор рассчитан на проведение на проведение 24 постановок ИФА: 1 постановка – 1 стрип (8 лунок). Всего – 192 определений , включая контрольные образцы.
3 Меры предосторожности при работе с набором
3.1 Все компоненты набора в используемых концентрациях являются нетоксичными. Однако работа со всеми исследуемыми образцами сыворотки (плазмы) крови человека, которые следует рассматривать как потенциально инфицированные, способные сохранять и передавать ВИЧ, вирус гепатита В или любой другой возбудитель вирусной инфекции, с отработанными растворами и жидкостями, различным оборудованием, которое может быть загрязнено в процессе анализа, требует определенных мер безопасности при использовании набора:
Работу необходимо проводить в специально оборудованном помещении;
Работать необходимо с применением средств индивидуальной защиты и с соблюдением мер предосторожности в соответствии с требованиями , , и .
3.2 Стоп-реагент, содержащий серную кислоту, обладает раздражающим действием. При попадании на кожу и слизистые немедленно промыть большим количеством воды.
3.3 При работе с набором рабочие места должны быть обеспечены приточно-вытяжной вентиляцией.
3.4 Все лица, работающие в лаборатории с наборами, должны проходить обязательный медицинский осмотр в соответствии с требованиями .
3.5 Утилизация медицинских отходов и/или неиспользованных наборов с истекшим сроком годности должна производиться в соответствии с требованиями .
4 Правила работы с набором
4.1 Для исключения ложных результатов исследуемые образцы необходимо готовить и хранить в условиях, предотвращающих бактериальный пророст. Необходимо осветлять образцы сывороток, содержащие агрегированные компоненты сыворотки или осадок, при помощи центрифугирования в течение (5-10) мин при скорости вращения 3000 об/мин. Образцы сывороток можно хранить при температуре (2-8) °С не более 5 сут. Замороженные образцы (желательно до температуры не менее минус 20 °С) можно хранить не более 1 года. Необходимо избегать повторных циклов замораживания-оттаивания образцов.
Необходимо помнить, что образцы с гемолизом, гиперлипидемией, бактериальным проростом, а также длительно хранившиеся без замораживания не пригодны для анализа.
Надежность результатов зависит от выполнения следующих правил:
Не допускается использование набора после окончания срока годности, а также смешивание компонентов наборов разных серий;
Для приготовления каждого реагента должна использоваться отдельная емкость;
Всю используемую для приготовления реагентов посуду не обрабатывать дезрастворами и моющими средствами. В случае необходимости промыть водой питьевой проточной, а затем пять раз ополоснуть дистиллированной водой;
Для работы с хромогеном ТМБ и РХ необходимо использовать отдельные емкости для растворов, наконечники для пипеток, посуду.
Необходимо обратить внимание на тщательное перемешивание реагентов;
Время между заполнением и опорожнением лунок планшета растворами и реагентами должно быть не менее 30 с. Не допускается подсыхание лунок на всех этапах постановки ИФА;
При использовании промывателя следить за состоянием емкости для раствора для промывания планшета и соединительных шлангов: в них не должно быть признаков бактериального или грибкового роста;
Необходимо использовать пипетки автоматические со сменными наконечниками, аттестованные по значению средней дозы и сходимости результатов пипетирования (погрешность не более 3 %);
Дозаторы и рабочие поверхности обрабатывать раствором с объемной долей спирта этилового 70 %. Не использовать хлорамин и другие хлорсодержащие вещества;
Для работы с исследуемыми и контрольными образцами рекомендуется использовать одноразовые наконечники для пипеток. Каждый образец сыворотки, а также реагенты набора необходимо отбирать отдельным наконечником.
При внесении в лунки РК-1 нельзя касаться наконечником пипетки поверхности планшета и раствора, находящегося в лунках.
Во время проведения анализа следует избегать попадания прямых солнечных лучей на рабочую поверхность.
4.2 При вскрытии и растворении лиофилизованных компонентов необходимо следить, чтобы на крышке и стенках флаконов не оставалось сухого вещества.
5 Оборудование и материалы, необходимые для проведения анализа
5.1 Спектрофотометр вертикального сканирования, позволяющий проводить измерения оптической плотности растворов в лунках планшета при длине волны 450 нм;
Полу- или автоматическое устройство для промывания планшетов (вошер);
Суховоздушный термостат типа ТС-80 М2, поддерживающий температуру (37±1) °С, или аналогичный ему по характеристикам;
Пипетки одноканальные автоматические со сменными наконечниками, позволяющие отбирать объемы жидкости от 0,01 до 5,0 мл;
Пипетки 8-ми канальные автоматические со сменными наконечниками, позволяющие отбирать объемы жидкости до 0,5 мл;
Мерный цилиндр вместимостью 2000 мл;
Колба лабораторная вместимостью 2000 мл;
Флаконы стеклянные вместимостью 20 мл;
Ванночки для реагентов или чашки Петри (диаметр 100 мм);
Вата медицинская гигроскопическая;
Бумага фильтровальная;
Перчатки резиновые хирургические;
Раствор с объемной долей этилового спирта 70 %;
Раствор с массовой долей перекиси водорода 6 %;
Вода деионизированная или дистиллированная;
Контейнер для сбора твердых отходов;
Контейнер для слива жидких отходов.
6 Подготовка к проведению анализа
6.1 Набор реагентов перед проведением анализа извлечь из холодильника, открыть крышку коробки и выдержать компоненты набора при температуре (18-25) °С в течение 30 мин .
Все образцы сывороток (плазмы) и реагенты перед проведением анализа тщательно перемешать.
Расход реагентов набора для постановки анализа, который определяется количеством используемых стрипов, приведен в таблице А.1 Приложения А.
6.2 Приготовление раствора для промывания планшета
Внимание! Раствор для промывания планшета готовить за 15 мин до начала проведения анализа!
Если флакон с ФСБ-Т×25 содержит осадок, его необходимо прогреть перед использованием при температуре (37±1) °С до полного растворения осадка. В мерный цилиндр вместимостью 2000 мл внести содержимое флакона с ФСБ-Т×25, затем добавить дистиллированной воды до метки 1250 мл и аккуратно перемешать раствор. Раствор можно хранить при температуре (2-8) °С в течение 72 ч.
В случае использования одного или несколько стрипов содержимое флакона с ФСБ-Т×25 интенсивно встряхнуть в течение (20-30) с, отобрать необходимый объем раствора (таблица А.1) в мерный стакан или цилиндр, добавить необходимое количество дистиллированной воды и перемешать раствор. Неиспользованный ФСБ-Т×25 можно хранить в закрытом флаконе при температуре (2-8) °С в течение срока годности набора.
6.3 Подготовка иммуносорбента
Иммуносорбент готов к использованию.
Открыть пакет и установить на рамку необходимое количество стрипов. Оставшиеся стрипы хранить в плотно закрытом пакете с влагопоглотителем при температуре (2-8) °С в течение 3 месяцев.
6.4 Подготовка К + АТ, К – , РК-1, РР-К2, БРС и стоп-реагента
К + АТ, К – , РК-1, РР-К2, БРС и стоп-реагент готовы к использованию.
Внимание! Во флаконе с РК-1 возможно выпадение осадка. Для проведения анализа необходимо использовать надосадочную жидкость.
Неиспользованные РК-1, РР-К2, БРС и стоп-реагент после вскрытия флаконов можно хранить в закрытых флаконах при температуре (2-8) °С в течение срока годности набора.
Остаток К + АТ и К - после вскрытия флакона можно хранить в закрытых флаконах при температуре (2-8) °С в течение срока годности набора.
6.5 Приготовление раствора К + АГ
Внимание! Раствор К + АГ готовить за 15 мин до начала проведения анализа!
Для восстановления лиофилизированного К + АГ перед вскрытием флакона легким постукиванием стряхнуть частицы, прилипшие к стенкам флакона или пробки. Открыть флакон и положить пробку перевернутой на сухую поверхность. Внести во флакон 0,8 мл дистиллированной воды. Флакон закрыть пробкой, выдержать в течение 10 мин при температуре (18-25) °С и аккуратно наклоняя и вращая флакон, перемешать его содержимое до полного растворения, избегая образования пены.
Восстановленный К + АГ можно хранить в закрытом флаконе при температуре (2-8) °С в течение одного месяца, при температуре минус 20 °С – в течение шести месяцев. Допускается однократное замораживание-оттаивание восстановленного К + АГ.
6.6 Приготовление раствора Кг-2 в рабочем разведении
Из флакона с Кг-2 отобрать указанный в таблице А.1 объем и перенести во флакон с РР-К2. Содержимое флакона тщательно перемешать, не допуская образования пены.
В случае использования одного или несколько стрипов в чистый флакон отобрать необходимое количество РР-К2, добавить Кг-2 в соответствии с таблицей А.1 и перемешать раствор, не допуская образования пены.
Внимание! Раствор Кг-2 в рабочем разведении готовят непосредственно перед использованием! Раствор Кг-2 в рабочем разведении можно хранить в течение 15 мин при температуре (18-25) °С. Использовать только новую ванночку для реагентов и новые наконечники!
Остаток Кг-2 можно хранить в закрытом флаконе при температуре (2-8) °С в течение срока годности набора.
6.7 Приготовление рабочего раствора субстрата
Флакон с хромогеном ТМБ необходимо прогреть перед использованием при температуре (37±1) ° С до полного растворения кристаллов .
Из флакона с хромогеном ТМБ отобрать указанный в таблице А.1 объем и перенести во флакон с БРС. Содержимое флакона тщательно перемешать, не допуская образования пены.
В случае использования одного или несколько стрипов в чистый флакон отобрать необходимое количество БРС, добавить хромогена ТМБ в соответствии с таблицей А.1 и перемешать раствор, не допуская образования пены.
Внимание! Рабочий раствор субстрата готовят непосредственно перед использованием в защищенном от света месте! Раствор можно хранить в течение 20 мин при температуре (18-25) °С в защищенном от света месте.
Раствор необходимо предохранять от попадания света и контакта с металлами или ионами металлов. Перед использованием раствор субстрата должен быть бесцветным. Посуду, которая будет в ходе реакции контактировать с раствором субстрата, отмывать без применения синтетических моющих средств. Использовать только новую ванночку для реагентов и новые наконечники!
Остаток хромогена ТМБ можно хранить в закрытом флаконе при температуре (2-8) °С в течение срока годности набора.
7 Требования к промыванию планшета
На всех этапах промывания необходимо контролировать заполнение всех лунок и полное удаление (аспирацию) жидкости из них;
Необходимо при каждом промывании все лунки заполнить раствором до краев (0,30-0,35 мл в лунку), без переполнения и перетекания жидкости из соседних лунок;
Необходимо выдерживать лунки, заполненными раствором для промывания планшета, в течение 30 с;
При каждой аспирации тщательно удалять остатки жидкости из лунок постукиванием рамкой со стрипами в перевернутом положении по сложенной в несколько раз фильтровальной бумаге, положенной на лист полиэтилена;
Некачественное промывание планшета приводит к получению некорректных результатов.
8 Проведение анализа
8.1 В любые две лунки планшета внести по 0,07 мл (70 мкл) К + АТ , в две другие лунки– по 0,07 мл (70 мкл) К + АГ , в три другие лунки – по 0,07 мл (70 мкл) К – .
Внимание! При постановке ИФА на одном стрипе допускается использовать для К – - две лунки, для К + АТ – одну лунку, для К + АГ – одну лунку.
В остальные лунки планшета внести по 0,07 мл (70 мкл) исследуемых образцов сыворотки (плазмы) крови человека.
Внимание! Каждый образец необходимо отбирать одноразовым наконечником!
8.2 Во все лунки планшета поверх контрольных образцов и исследуемых образцов сыворотки (плазмы) крови сразу внести по 0,05 мл (50 мкл) РК-1 . Содержимое лунок перемешать осторожным постукиванием по краям планшета.
8.3 (37 ± 1) ° С в течение 60 мин .
Внимание! За (1-2) мин до окончания инкубации приготовить раствор Кг-2 в рабочем разведении (п 6.6).
8.4 Удалить содержимое лунок с помощью промывателя, затем промыть лунки планшета раствором для промывания планшета (п 6.2) семь раз.
8.5 Внести во все лунки планшета по 0,15 мл (150 мкл) раствора Кг-2 в рабочем разведении (п 6.6).
8.6 Планшет заклеить пленкой или закрыть крышкой и инкубировать в термостате при температуре (37 ± 1) ° С в течение 10 мин .
8.7 Удалить содержимое лунок планшета с помощью промывателя, затем промыть лунки планшетов раствором для промывания планшета (п 6.2) семь раз.
8.8 Во все лунки планшета внести по 0,15 мл (150 мкл) рабочего раствора субстрата (п 6.7).
При приготовлении рабочего раствора субстрата (п.6.7) флакон с хромогеном ТМБ необходимо прогреть перед использованием в течение (3-5) мин при температуре (37 ± 1)° С до полного растворения кристаллов.
8.9 Планшет заклеить пленкой или закрыть крышкой и инкубировать в термостате при температуре (37 ± 1) ° С в защищенном от света месте в течение 15 мин .
Внимание! По окончании инкубации в лунках с образцами сывороток, содержащими антитела к ВИЧ-1 и/или ВИЧ-2, и/или антиген р24 ВИЧ-1, произойдет изменение окраски раствора от бесцветной до голубой различной интенсивности в зависимости от концентрации антител и/или антигена в исследуемом образце сыворотки.
8.10 Остановить пероксидазную реакцию путем внесения во все лунки по 0,05 мл (50 мкл) стоп-реагента .
Внимание! В лунках с образцами сывороток, содержащими антитела к ВИЧ-1 и/или ВИЧ-2, и/или антиген р24 ВИЧ-1, произойдет изменение окраски раствора с голубой на желтую различной интенсивности.
8.11 Не позже чем через (1-2) мин после остановки реакции определить ОП в лунках в одноволновом режиме при длине волны 450 нм .
9 Обработка результатов анализа
9.2 Результаты учитывать только в том случае если:
Значение ОПср К - не превышает 0,2 ОЕ;
Каждое отдельное значение ОП К - не должно отклоняться от ОПср К - более чем на 30%. Если одно из трех значений ОП К - выходит за этот предел, его следует исключить из расчета ОПср К - . Если два из трех значений ОП К - выходят за этот предел, анализ следует повторить на реагентах нового набора;
Значение ОПср К + АТ более 1,0 ОЕ;
Значение ОПср К + АГ более 1,0 ОЕ.
9.3 При соблюдении выше перечисленных условий вычислить критическое значение (ОПкрит.), ОЕ, по формуле (1):
ОПкрит. = ОПср К - + 0,14 (1).
10 Аналитические и диагностические характеристики
Чувствительность набора реагентов ИФА-HIV 1,2 AGAT по выявлению антигена р24 ВИЧ-1 –
Специфичность набора реагентов ИФА-HIV 1,2 AGAT – 100 % Стандарт АТ(-)ВИЧ. Стандартная панель сывороток, не содержащих антитела к вирусу иммунодефицита человека первого и второго типов (ВИЧ-1,2) и антиген ВИЧ-1(р24).ОСО42-28-214-02П.Кат№INS-20. ЗАО «МБС».
11 Форма выпуска набора
11.1 Набор выпускается в пяти вариантах комплектации:
1 комплект 1Р – проведение анализа ручным способом. Набор рассчитан на проведение 12 постановок ИФА на разборном планшете: 1 постановка – 1 стрип (8 лунок). Всего – 96 определений, включая контрольные образцы;
2 комплект 2М – проведение анализа ручным способом. Набор рассчитан на проведение 2 постановок ИФА на монолитных планшетах: 1 постановка – 1 планшет. Всего – 192 определений, включая контрольные образцы;
3 комплект 2Р – проведение анализа ручным способом. Набор рассчитан на проведение 24 постановок ИФА на 2 разборны х планшетах: 1 постановка – 1 стрип (8 лунок). Всего – 192 определений , включая контрольные образцы;
4 комплект А2М – проведение анализа на автоматическом анализаторе. Набор рассчитан на проведение 2 постановок ИФА на монолитных планшетах: 1 постановка – 1 планшет. Всего – 192 определений, включая контрольные образцы;
5 комплект А2Р – проведение анализа на автоматическом анализаторе. Набор рассчитан на проведение 24 постановок ИФА на 2 разборных планшетах: 1 постановка – 1 стрип (8 лунок). Всего – 192 определений, включая контрольные образцы.
12 Условия хранения и применения набора
12.1 Хранение набора должно производиться в чистом, защищенном от влаги и света помещении при температуре (2-8)° С в течение всего срока годности. Запрещается замораживать компоненты набора.
12.2 Для получения надежных результатов необходимо строгое соблюдение инструкции по применению набора.
12.3 Срок годности набора – 12 месяцев .
Приложение А
Таблица А.1 – Расход реагентов набора для постановки ИФА
|
реагента, мл |
Количество используемых стрипов, шт. |
|||||||||||
|
Приготовление раствора для промывания планшета |
||||||||||||
|
ФСБ-Т×25 |
||||||||||||
|
Дистиллированная вода |
||||||||||||
|
Приготовление раствора Кг-2 в рабочем разведении |
||||||||||||
|
РР-К2 |
||||||||||||
|
Приготовление рабочего раствора субстрата |
||||||||||||
|
Хромоген ТМБ |
||||||||||||
Библиография
|
Санитарные правила |
Приказ Министерства здравоохранения Республики Беларусь от 16.12.1998 г. № 351 О пересмотре ведомственных нормативных актов, регламентирующих вопросы по проблеме ВИЧ/СПИД |
|
|
Приказ Министерства здравоохранения Республики Беларусь от 25.11.2002 г. № 165 О проведении дезинфекции и стерилизации учреждениями здравоохранения |
||
|
Постановление Министерства здравоохранения Республики Беларусь от 28.04.2010 г. № 47 Об утверждении Инструкции о порядке проведения обязательных медицинских осмотров работающих и признании утратившими силу некоторых постановлений Министерства здравоохранения Республики Беларусь |
||